Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї - Я«фЯ«ЙЯ«ЪЯ«џЯ»ЇЯ«џЯ»ЂЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї: Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї Я««Я«ЙЯ«цЯ«┐Я«░Я«┐ | 11th Chemistry : UNIT 2 : Quantum Mechanical Model of Atom
11 Я«хЯ«цЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«▓Я«ЋЯ»Ђ 2 : Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї Я««Я«ЙЯ«цЯ«┐Я«░Я«┐
Я«фЯ«ЙЯ«ЪЯ«џЯ»ЇЯ«џЯ»ЂЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї: Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї Я««Я«ЙЯ«цЯ«┐Я«░Я«┐
Я«фЯ«ЙЯ«ЪЯ«џЯ»ЇЯ«џЯ»ЂЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї
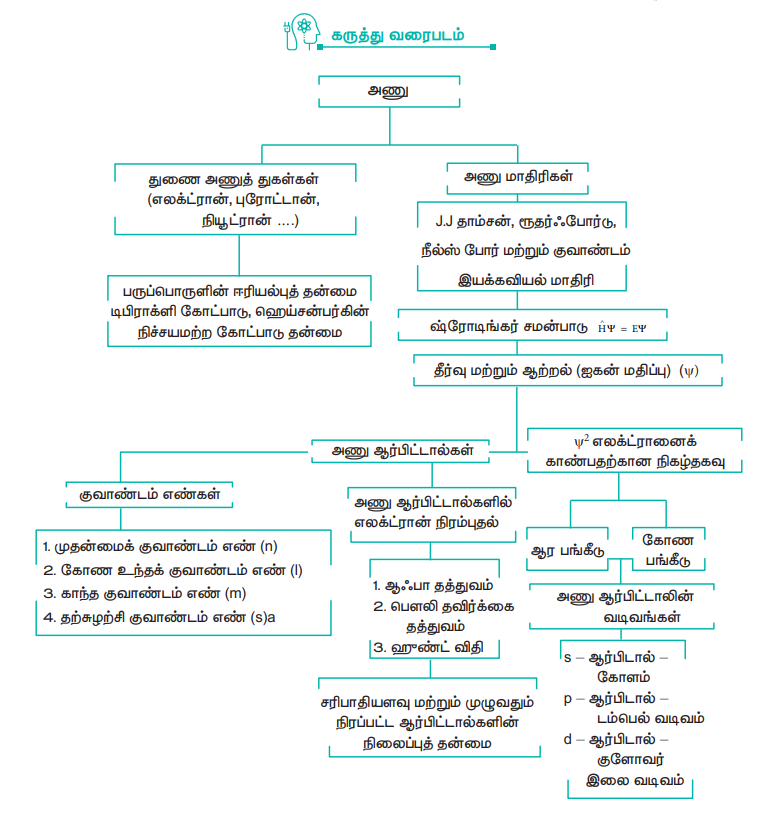
Я«цЯ»ЂЯ«БЯ»ѕ Я«ЁЯ«БЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ«БЯ»ЇЯ«ЪЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«хЯ«░Я»ѕ Я«ЁЯ«БЯ»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ЇЯ«Ћ Я««Я»ЂЯ«ЪЯ«┐Я«»Я«ЙЯ«ц Я«цЯ»ЂЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЋЯ«░Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«хЯ«еЯ»ЇЯ«цЯ«цЯ»Ђ. J.J. Я«цЯ«ЙЯ««Я»ЇЯ«џЯ«ЕЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«хЯ«░Я»Ї, Я«ЁЯ«БЯ»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«» Я«ЋЯ»ІЯ«│Я«хЯ«ЪЯ«┐Я«хЯ«┐Я«ЕЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»іЯ«цЯ«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е Я«јЯ«ЕЯ«хЯ»ЂЯ««Я»Ї Я«ЋЯ»ѓЯ«▒Я«┐Я«ЕЯ«ЙЯ«░Я»Ї Я«јЯ«ЕЯ«┐Я«ЕЯ»ЂЯ««Я»Ї Я«ЄЯ«хЯ«░Я«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я«┐Я«ЕЯ»ѕ Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ. Я«░Я»ѓЯ«цЯ«░Я»ЇЯ«фЯ»ІЯ«░Я»ЇЯ«ЪЯ»Ђ Я«цЯ«ЕЯ«цЯ»Ђ ╬▒ Я«ЋЯ«цЯ«┐Я«░Я»Ї Я«џЯ«┐Я«цЯ«▒Я«▓Я»Ї Я«єЯ«»Я»ЇЯ«хЯ«┐Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї, Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»Ђ Я«јЯ«ЕЯ»ЇЯ«▒ Я«њЯ«ЕЯ»ЇЯ«▒Я»ѕ Я«ЁЯ«▒Я«┐Я««Я»ЂЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ«ЙЯ«░Я»Ї. Я«ЄЯ«хЯ«░Я«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ«┐ Я«ЁЯ«БЯ»ЂЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«ЕЯ»ѕ Я«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐ Я«хЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»Ї Я«фЯ«ЙЯ«цЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐ Я«хЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«цЯ»ЇЯ«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ѕ Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ. Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ«┐Я«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«ЕЯ«цЯ»Ђ Я«хЯ«░Я»ѕЯ«»Я«▒Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»Ї Я«фЯ«ЪЯ»ЇЯ«Ъ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Я««Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»Є Я«фЯ»єЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«ЋЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«░Я»ѓЯ«цЯ«░Я»ЇЯ«ЃЯ«фЯ»ІЯ«░Я»ЇЯ«ЪЯ»Ђ Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я»ѕ Я«фЯ»ІЯ«░Я»Ї Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«┐Я«»Я««Я»ѕЯ«цЯ»ЇЯ«цЯ»Ђ Я«еЯ«┐Я«▓Я»ѕ Я«хЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»Ї Я«фЯ«ЙЯ«цЯ»ѕЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒ Я«ЋЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕ Я«ЁЯ«▒Я«┐Я««Я»ЂЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ«ЙЯ«░Я»Ї. Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«фЯ»Ї Я«фЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ѕЯ«░Я«┐Я«»Я«▓Я»ЇЯ«фЯ»ЂЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я«┐Я«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«Е Я«јЯ«Е Я«▓Я»ѓЯ«»Я«┐Я«ИЯ»Ї Я«ЪЯ«┐Я«фЯ«┐Я«░Я«ЙЯ«ЋЯ»ЇЯ«│Я«┐ Я««Я»ЂЯ«ЕЯ»Ї Я««Я»іЯ«┤Я«┐Я«еЯ»ЇЯ«цЯ«ЙЯ«░Я»Ї. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«ЁЯ«хЯ»ѕЯ«ЋЯ«│Я»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«▓Я»ѕ Я«єЯ«ЋЯ«┐Я«» Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«Е. Я«ЪЯ«┐Я«фЯ«┐Я«░Я«ЋЯ»ЇЯ«│Я«┐ Я«ЁЯ«▓Я»ѕ Я«еЯ»ђЯ«│Я««Я»Ї ╬╗ = h / mv = h / Рѕџ2mev Я«єЯ«ЕЯ«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«еЯ»ЂЯ«БЯ»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я«цЯ»ЇЯ«цЯ»ЂЯ«хЯ««Я»Ї Я«ЅЯ«ЪЯ»ѕЯ«»Я«цЯ»Ђ. Я«ЪЯ»ЄЯ«хЯ«┐Я«џЯ«ЕЯ»Ї Я«юЯ»єЯ«░Я»ЇЯ««Я«░Я»Ї Я«џЯ»ІЯ«цЯ«ЕЯ»ѕ Я««Я»ѓЯ«▓Я««Я»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ«▓Я»ѕЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я«┐Я«ЕЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ Я«ЅЯ«▒Я»ЂЯ«цЯ«┐Я«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«еЯ»ЂЯ«БЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЄЯ«БЯ»ѕ Я««Я«ЙЯ«▒Я«┐Я«ЋЯ«│Я«ЙЯ«Е Я«еЯ«┐Я«▓Я»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЅЯ«еЯ»ЇЯ«цЯ««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«њЯ«░Я»Є Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я««Я«┐Я«ЋЯ«хЯ»ЂЯ««Я»Ї Я«цЯ»ЂЯ«▓Я»ЇЯ«▓Я«┐Я«»Я««Я«ЙЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ«БЯ»ЇЯ«ЪЯ«▒Я«┐Я«» Я«ЄЯ«»Я«▓Я«ЙЯ«цЯ»Ђ. Я«ЁЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«ЁЯ«│Я«хЯ«┐Я«ЪЯ»ЂЯ«хЯ«цЯ«┐Я«▓Я»Ї Я«еЯ«┐Я«џЯ»ЇЯ«џЯ«»Я««Я«▒Я»ЇЯ«▒ Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕ Я«╣Я»єЯ«»Я»ЇЯ«џЯ«ЕЯ»ЇЯ«фЯ«░Я»ЇЯ«ЋЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«џЯ»ЇЯ«џЯ«»Я««Я«▒Я»ЇЯ«▒ Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ»ІЯ«ЪЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ Я«јЯ«Е Я«ЁЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»ѕ ╬ћx . ╬ћp РЅЦ h / 4¤ђ. Я«јЯ«ЕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«▓Я«ЙЯ««Я»Ї.
Я«ЪЯ«┐Я«фЯ«┐Я«░Я«ЙЯ«ЋЯ»ЇЯ«│Я«┐ Я«ЋЯ»ІЯ«ЪЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«╣Я»єЯ«»Я»ЇЯ«џЯ«ЕЯ»ЇЯ«фЯ«░Я»ЇЯ«ЋЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«џЯ»ЇЯ«џЯ«»Я««Я«▒Я»ЇЯ«▒ Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«єЯ«ЋЯ«┐Я«»Я«хЯ»ѕ, Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я«ЙЯ«Е Я«ЁЯ«БЯ»ЂЯ««Я«ЙЯ«цЯ«┐Я«░Я«┐ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«хЯ«┐Я«цЯ»ЇЯ«цЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«Е. Я«јЯ«░Я»ЇЯ«хЯ«┐Я«ЕЯ»Ї Я«иЯ»ЇЯ«░Я»ІЯ«ЪЯ«┐Я«ЎЯ»ЇЯ«ЋЯ«░Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«Е Я«њЯ«░Я»Ђ Я«ЁЯ«▓Я»ѕЯ«џЯ»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ«ЙЯ«░Я»Ї. Я«ЁЯ«џЯ»ЇЯ«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ ─ц╬е = E╬е Я«јЯ«ЕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ.
Я«ЄЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«ЙЯ««Я»Ї Я«фЯ«ЪЯ«┐Я«»Я»ЂЯ«ЪЯ»ѕЯ«» Я«хЯ«ЋЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»єЯ«┤Я»ЂЯ«џЯ»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. H, He+ Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«њЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ, Я«ЄЯ«џЯ»ЇЯ«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ Я«ЋЯ«ЙЯ«БЯ»ЇЯ«фЯ«цЯ»Ђ Я«ЋЯ«ЪЯ«┐Я«ЕЯ««Я«ЙЯ«ЕЯ«цЯ«▓Я»ЇЯ«▓. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«фЯ«▓ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЄЯ«џЯ»ЇЯ«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ Я«ЋЯ«ЙЯ«БЯ»ЇЯ«фЯ«цЯ»Ђ Я«џЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«▓Я»Ї Я«еЯ«┐Я«▒Я»ѕЯ«еЯ»ЇЯ«цЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«иЯ»ЇЯ«░Я»ІЯ«ЪЯ«┐Я«ЎЯ»ЇЯ«ЋЯ«░Я»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ, Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«џЯ«┐Я«▓ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ Я«ЋЯ«ЙЯ«БЯ«цЯ»ЇЯ«цЯ«ЋЯ»ЇЯ«ЋЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«љЯ«ЋЯ«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«еЯ»ЇЯ«ц Я«љЯ«ЋЯ«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ІЯ«ЪЯ»Ђ Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ»ЂЯ«ЪЯ»ѕЯ«» Я«ЁЯ«▓Я»ѕЯ«џЯ»ЇЯ«џЯ«ЙЯ«░Я»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«БЯ»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«Е Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ«▓Я»ѕЯ«џЯ»ЇЯ«џЯ«ЙЯ«░Я»ЇЯ«фЯ»Ђ ╬е Я«єЯ«ЕЯ«цЯ»Ђ Я«јЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я«ЄЯ«»Я«▒Я»Ї Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я«цЯ»ЇЯ«цЯ»ЂЯ«хЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я«┐Я«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ Я«јЯ«ЕЯ«┐Я«ЕЯ»ЂЯ««Я»Ї, |╬е|2 Я«єЯ«ЕЯ«цЯ»Ђ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«ЕЯ»ѕ Я«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЋЯ«ЙЯ«БЯ»ЇЯ«фЯ«цЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«Е Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«цЯ«ЋЯ«хЯ»ІЯ«ЪЯ»Ђ Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ»ЂЯ«ЪЯ»ѕЯ«»Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є, Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї Я«еЯ««Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«ЁЯ«▒Я«┐Я««Я»ЂЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ, Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«ЕЯ»ѕЯ«џЯ»Ї Я«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐ Я««Я»ЂЯ«фЯ»ЇЯ«фЯ«░Я«┐Я««Я«ЙЯ«Е Я«хЯ»єЯ«│Я«┐Я«»Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЋЯ«ЙЯ«БЯ»ЇЯ«фЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«ЁЯ«цЯ«┐Я«Ћ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«цЯ«ЋЯ«хЯ«┐Я«ЕЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я«┐Я«▓Я»Ї Я«ЄЯ«ЪЯ««Я»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ, Я««Я»ЂЯ«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«јЯ«БЯ»Ї (n) Я«цЯ»ЂЯ«БЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»ѕ Я«ЋЯ»ЂЯ«▒Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЋЯ»ІЯ«Б Я«ЅЯ«еЯ»ЇЯ«цЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«јЯ«БЯ»Ї (l) Я«фЯ»ЂЯ«▒Я«хЯ»єЯ«│Я«┐Я«»Я«┐Я«▓Я»Ї Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«┐Я«џЯ»ѕЯ«»Я««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«еЯ»ЇЯ«цЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«јЯ«БЯ»Ї (m) Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«▒Я»ЇЯ«џЯ»ЂЯ«┤Я«▒Я»ЇЯ«џЯ«┐Я«»Я»ѕ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ««Я»Ї Я«цЯ«▒Я»ЇЯ«џЯ»ЂЯ«┤Я«▒Я»ЇЯ«џЯ«┐Я«ЋЯ»Ї Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«јЯ«БЯ»Ї (s) Я«єЯ«ЋЯ«┐Я«» Я«еЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ»ЂЯ«хЯ«ЙЯ«БЯ»ЇЯ«ЪЯ««Я»Ї Я«јЯ«БЯ»ЇЯ«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«Ъ Я«ЄЯ«»Я«▓Я»ЂЯ««Я»Ї. Я«њЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▒Я»ЇЯ«ЋЯ«ЙЯ«Е, Я«иЯ»ЇЯ«░Я»ІЯ«ЪЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«░Я»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«цЯ»ђЯ«░Я»ЇЯ«хЯ«┐Я«ЕЯ»ѕ Я«ЋЯ»ІЯ«│Я«Ћ Я«цЯ»ЂЯ«░Я»ЂЯ«х Я«єЯ«»Я«ЁЯ«џЯ»ЇЯ«џЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї (r, ╬И, ¤Ћ) Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«▓Я«ЙЯ««Я»Ї ╬е (r, ╬И, ¤Ћ) = R (r) . f (╬И). g (¤Ћ) Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ђ R (r) Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«єЯ«░ Я«ЁЯ«▓Я»ѕЯ«џЯ»ЇЯ«џЯ«ЙЯ«░Я»ЇЯ«фЯ»Ђ, Я««Я«▒Я»ЇЯ«▒ Я«ЄЯ«░Я»Ђ Я«џЯ«ЙЯ«░Я»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЋЯ»ІЯ«Б Я«ЁЯ«▓Я»ѕЯ«џЯ»ЇЯ«џЯ«ЙЯ«░Я»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«јЯ«Е Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. 4¤ђr2. R(r)2 V s r Я«ЕЯ»Ї Я«хЯ«░Я»ѕЯ«фЯ«ЪЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«єЯ«░ Я«фЯ«ЋЯ«┐Я«░Я»ЇЯ«хЯ»Ђ Я«хЯ«│Я»ѕЯ«ЋЯ»ІЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«░Я«ЋЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї (radial node) Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я«┐Я«ЕЯ»ѕ (n РђЊ l - 1)Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»ЂЯ««Я»Ї Я«ЋЯ»ІЯ«БЯ«ЋЯ»Ї Я«ЋЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я«┐Я«ЕЯ»ѕ l Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»ЂЯ««Я»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«▓Я«ЙЯ««Я»Ї Я«ЋЯ»ІЯ«БЯ«фЯ»ЇЯ«фЯ«ЎЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«хЯ«│Я»ѕЯ«ЋЯ»ІЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї, Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»Ђ Я«јЯ«▓Я»ЇЯ«▓Я»ѕ (boundary surface) Я«хЯ«░Я»ѕЯ«фЯ«ЪЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕ Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
S Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«џЯ»ђЯ«░Я«ЙЯ«Е Я«ЋЯ»ІЯ«│Я«хЯ«ЪЯ«┐Я«хЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ««Я»Ї, d Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«хЯ«░Я»Ї Я«ЄЯ«▓Я»ѕ Я«хЯ«ЪЯ«┐Я«хЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я«┐Я«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«еЯ«┐Я«░Я««Я»ЇЯ«фЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«ЕЯ»Ї Я«ЈЯ«▒Я»ЂЯ«хЯ«░Я«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«░Я««Я»ЇЯ«фЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ»Ђ Я«єЯ«ЃЯ«фЯ«ЙЯ«цЯ«цЯ»ЇЯ«цЯ»ЂЯ«хЯ««Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«фЯ«▓Я»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«ЕЯ»Ї Я«ЈЯ«▒Я»ЂЯ«хЯ«░Я«┐Я«џЯ»ѕ (n + l) Я«хЯ«┐Я«цЯ«┐ Я««Я»ѓЯ«▓Я««Я»Ї Я«цЯ«░Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«хЯ»ЇЯ«хЯ«┐Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ«┐, Я«њЯ«░Я»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я«┐Я«ЕЯ»Ї (n + l) Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«ЁЯ«цЯ«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«░Я»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї (n + l) Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«џЯ««Я««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї, Я«ЁЯ«хЯ»ЇЯ«хЯ«┐Я«░Я»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я»ЂЯ«│Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Е n Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я«┐Я«ЕЯ»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«фЯ»єЯ«│Я«▓Я«┐ Я«цЯ«хЯ«┐Я«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ѕ Я«цЯ«цЯ»ЇЯ«цЯ»ЂЯ«хЯ«фЯ»ЇЯ«фЯ«ЪЯ«┐, Я«њЯ«░Я»Ђ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я«┐Я«▓Я»Ї Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«фЯ«ЪЯ»ЇЯ«џ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«џЯ«« Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЂЯ«ЪЯ»ѕЯ«» Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«хЯ«ЙЯ«»Я»ЇЯ«фЯ»ЇЯ«фЯ»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ«ЕЯ»ѕЯ«цЯ»ЇЯ«цЯ»Ђ Я«џЯ««Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЂЯ«ЪЯ»ѕЯ«» Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«њЯ«▒Я»ЇЯ«▒Я»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ«ЙЯ«▓Я»Ї Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«фЯ«┐Я«ЕЯ»ЇЯ«ЕЯ«░Я»Є, Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЄЯ«░Я«ЪЯ»ЇЯ«ЪЯ»ѕЯ«»Я«ЙЯ«цЯ«▓Я»Ї (electron paring) Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«╣Я»ЂЯ«БЯ»ЇЯ«ЪЯ»ЇЯ«хЯ«┐Я«цЯ«┐ Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«ЄЯ«хЯ»ЇЯ«хЯ«┐Я«цЯ«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї, Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕ Я«јЯ«┤Я»ЂЯ«цЯ««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї. Я«џЯ««Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЂЯ«ЪЯ»ѕЯ«» Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї, Я«џЯ«░Я«┐Я«фЯ«ЙЯ«цЯ«┐Я«»Я«│Я«хЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я»ЂЯ«┤Я»ЂЯ«хЯ«цЯ»ЂЯ««Я»Ї Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«фЯ«┐Я«▒ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«│Я«хЯ»Ђ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я«┐Я«ЕЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»Ђ Я«хЯ«┐Я«│Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«џЯ««Я«џЯ»ЇЯ«џЯ»ђЯ«░Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ«░Я«┐Я««Я«ЙЯ«▒Я»ЇЯ«▒ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«єЯ«ЋЯ«┐Я«»Я«Е Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Ћ Я«ЁЯ««Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«ЋЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я«хЯ«░Я»ѕЯ«фЯ«ЪЯ««Я»Ї