11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
போர் அணுமாதிரி
1. போர் அணுமாதிரி:
பிளாங்க் மற்றும் ஐன்ஸ்டீனின் ஆய்வுகளின் மூலம் மின்காந்த அலையின் ஆற்றலானது hv என்ற அலகில் வரையறுக்கப்பட்ட மதிப்புகளை மட்டும் கொண்டுள்ளது என கண்டறியப்பட்டது. (இங்கு v என்பது கதிர்வீச்சின் அதிர்வெண், h என்பது பிளாங் மாறிலி. இதன் மதிப்பு 6.626 × 10-34 Js) பிளாங்கின் குவாண்டம் கருதுகோளினை அணுக்களின் ஆற்றலுக்கு விரிவுபடுத்தி நீல்ஸ்போர் ஹைட்ரஜன் அணுவிற்கான ஒரு புதிய அணு மாதிரியினை முன்மொழிந்தார். இந்த அணு மாதிரி பின்வரும் கருது கோள்களின் அடிப்படையில் அமைந்தது.
1. எலக்ட்ரானின் ஆற்றல் வரையறுக்கப்பட்ட மதிப்புகளைப் பெற்றிருக்கும்.
2. எலக்ட்ரான்கள் அணுக்கருவினைச் சுற்றி சில குறிப்பிட்ட ஆற்றலுடைய ஆர்பிட் எனும் வட்டப்பாதையில் மட்டும் சுற்றி வருகின்றன. இவ்வட்டப்பாதைகள் நிலை வட்டப்பாதைகள் (Stationary orbits) என அழைக்கப்படுகின்றன.
3. ஒரு குறிப்பிட்ட வட்டப்பாதையில் சுற்றி வரும் எலக்ட்ரானின் கோண உந்தமதிப்பு (mvr) ஆனது, h/2π ன் முழு எண் மடங்காக இருக்கும் அதாவது
mvr = nh / 2π ----------- (2.1)
இங்கு n = 1, 2, 3 . . . . முதலியன
4. எலக்ட்ரானானது ஒரு குறிப்பிட்ட நிலை வட்டப் பாதையில் சுற்றி வரும் வரையில் அதன் ஆற்றலை இழப்பதில்லை. ஆனால், ஒரு எலக்ட்ரான் உயர் ஆற்றலுடைய (E2) வட்டப் பாதையிலிருந்து, தாழ்ந்த ஆற்றலுடைய (E1) வட்டப் பாதைக்குத் தாவும் போது, அதிகப்படியான ஆற்றல் கதிர் வீச்சாக வெளியிடப்படுகிறது. வெளியிடப்பட்ட கதிர்வீச்சின் அதிர்வெண்
E2 - E1 = hv
மற்றும்
v = (E2 – E1) / h ---------- (2.2)
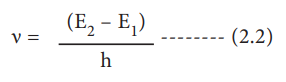
மாறாக, தகுந்த ஆற்றல் ஒரு எலக்ட்ரானுக்குத் தரப்படும் போது, அது தாழ்ந்த ஆற்றலுடைய வட்டப் பாதையிலிருந்து, அதிக ஆற்றலுடைய வட்டப் பாதைக்குத் தாவுகின்றது. ஹைட்ரஜன் மற்றும் ஹைட்ரஜனை ஒத்த (ஒரு எலக்ட்ரானைக் கொண்ட H, He+ மற்றும் Li2+ போன்றவை) அணுக்களுக்கு போர் கருதுகோளை பயன்படுத்தி, 'n' ஆவது வட்டப் பாதையில் சுற்றி வரும் எலக்ட்ரானின் ஆற்றல் மற்றும் அவ்வட்டப்பாதையின் ஆரம் ஆகியவற்றை வருவித்ததன் முடிவுகள் பின்வருமாறு
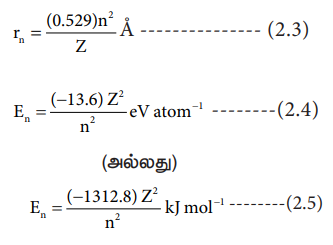
rn மற்றும் En மதிப்புகளை வருவிக்கும் முறையினை, 12ஆம் வகுப்பில் அணு இயற்பியல் பாடத்தில் விரிவாக கற்கலாம்.