11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
ஹெய்சன்பர்க்கின் நிச்சயமற்றத் தன்மை கோட்பாடு
ஹெய்சன்பர்க்கின் நிச்சயமற்றத் தன்மை கோட்பாடு
பருப்பொருட்களின் ஈரியல்புத் தன்மையானது, நுண்துகள் ஒன்றின் நிலை மற்றும் உந்தத்தை ஒரே நேரத்தில் கண்டறிவதில் வரம்பினை ஏற்படுத்துகிறது. இதனடிப்படையில், ஹெய்சன்பர்க் தனது நிச்சயமற்றத் தன்மைக் கோட்பாட்டினை உருவாக்கினார். இக்கோட்பாட்டின் படி நுண்துகள் ஒன்றின் நிலை மற்றும் உந்தம் ஆகிய இரண்டினையும் ஒரே நேரத்தில், மிகத் துல்லியமாகக் கண்டறிய இயலாது. அவைகளை அளவிடுவதில் ஏற்படும் நிச்சயமற்றத் தன்மையின் (பிழை) பெருக்குத் தொகையினை பின்வருமாறு குறிப்பிடலாம்.
Δx.Δp ≥ h / 4π ---------- (2.11)
இங்கு Δx மற்றும் Δp ஆகியவை முறையே நிலை மற்றும் உந்தம் ஆகியவற்றினை அளவிடுவதில் உள்ள நிச்சயமற்றத் தன்மைகளாகும்
எலக்ட்ரானைப் போன்ற நுண்துகளிற்கு, நிச்சயமற்றக் கொள்கை முக்கியத்துவம் வாய்ந்ததாகும். அதிக நிறையுடைய பெரிய துகளிற்கு இதன் விளைவு புறக்கணிக்கத் தக்கதாகும்.
ஹைட்ரஜன் அணுவில் உள்ள எலக்ட்ரான் ஒன்றின் திசைவேகத்தினை அளவிடுவதில் ஏற்படும் நிச்சயமற்றத் தன்மையினை கணக்கிடுவதன் மூலம் இதனை நாம் புரிந்து கொள்ளலாம். முதல் வட்டப்பாதையில் போர் அணு ஆரம் 0.529 Å. இந்த வட்டப் பாதையில் உள்ள எலக்ட்ரானின் நிலையினை அவ்வட்டப்பாதை ஆரத்தில் 0.5% துல்லியமாக, கண்டறிய இயலும் எனக் கருதுவோம்.
நிலையை அளவிடுவதில் உள்ள நிச்சயமற்றத் தன்மை
= (0.5% / 100%) × 0.529 A
= (0.5 / 100) × 0.529 × 10-10 m
Δx = 2.645 × 10-13 m
ஹெய்சன்பர்க்கின் நிச்சயமற்றத் தன்மை கோட்பாட்டின் படி
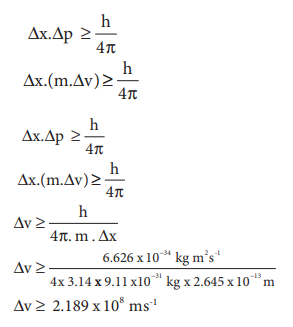
Δx.Δp ≥ h / 4π
Δx.(m.Δv) ≥ h / 4π
Δx. Δp ≥ h / 4π
Δx. (m.Δv) ≥ h / 4π
Δv ≥ h / (4π.m.Δx)
Δv ≥ (6.626 × 10-34 kg m2s-1) / (4 × 3.14 × 9.11 × 10-31 kg × 2.645 × 10-13 m)
Δv ≥ 2.189 × 108 ms-1
எனவே, திசைவேகத்தில் ஏற்படும் நிச்சயமற்றத் தன்மை, ஒளியின் திசைவேகத்தோடு ஒப்பிடத்தக்க வகையில் உள்ளது. இவ்வாறு நிச்சயமற்றத் தன்மை அதிகமாக உள்ள நிலையில் அதன் மிகச்சரியான திசைவேகத்தினை கண்டறிவது கடினமாகும்.
தன் மதிப்பீடு
2. ஒரு எலக்ட்ரானின் திசை வேகத்தை அளவிடுவதில் நிச்சயமற்றத் தன்மை 5.7 × 105 ms-1, எனில் அதன் நிலையில் காணப்படும் நிச்சயமற்றத் தன்மையைக் கணக்கிடுக.
தீர்வு
∆v = 5.7 × 105 ms−1
me = 9.1 × 10−31 kg
∆P . ∆x ≥ h/4π
∆x ≥ h/(4π. ∆P)
≥ h/4π. ∆vm
அணுவின் குவாண்டம் இயக்கவியல் மாதிரி

∆x ≥ 1.017 × 10−10 m