11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
ஆர்பிட்டால்களின் வடிவங்கள்
1. ஆர்பிட்டால்களின் வடிவங்கள்
ஷ்ரோடிங்கர் அலைச் சமன்பாட்டின் தீர்வுகள் ஐகன் மதிப்புகள் என்றழைக்கப்படும். அனுமதிக்கப்பட்ட ஆற்றல் மதிப்புகளைத் தருகின்றன. ஐகன் மதிப்போடு தொடர்புடைய ஐகன் சார்புகள் அணு ஆர்பிட்டால்கள் என அழைக்கப்படுகின்றன. ஹைட்ரஜனை ஒத்த ஒரு எலக்ட்ரான் அமைப்பிற்கான ஷ்ரோடிங்கர் அலைச் சமன்பட்டின் தீர்வை (Ψ) கோளக துருவ ஆய அச்சில் (r, θ, ϕ) (spherical polar co-ordinates) பின்வருமாறு குறிப்பிடலாம்.
Ψ (r, θ, ϕ) = R (r). f (θ). g (ϕ) ---------- (2.15)
இங்கு R(r) என்பது ஆர அலைச் சார்பு (Radial wave function) என அழைக்கப்படுகிறது. மற்ற இருசார்புகளும் கோண அலைச் சார்புகள் (angular wave function) என அழைக்கப்படுகின்றன.
Ψ க்கு என இயற் முக்கியத்துவம் ஏதும் இல்லை எனவும், அலைச் சார்பின் இருமடி |Ψ|2 ஆனது புறவெளியில் (space) கொடுக்கப்பட்ட கனஅளவிற்குள் எலக்ட்ரானை காண்பதற்கான நிகழ்தகவோடு தொடர்புடையது எனவும் நாம் அறிவோம்.
அணுக்கருவிலிருந்து உள்ள, தொலைவினைப் பொருத்து |Ψ|2 மதிப்பானது எவ்வாறு மாறுபடுகிறது - (நிகழ்தகவின் ஆரபங்கீடு - Radial distribution of the probability) என்பதனையும் அணுக்கருவிலிருந்து திசையினைப் பொருத்து (நிகழ்தகவின் கோணப்பங்கீடு - angular distribution of the probability |Ψ|2 எவ்வாறு மாறுபடுகிறது என்பதனையும் நாம் ஆய்ந்தறிவோம்.
ஆரப் பங்கீட்டுச் சார்பு
அடிஆற்றல் நிலையில் (ground state) உள்ள ஹைட்ரஜன் அணுவின் ஒற்றை எலக்ட்ரானைக் கருதுக. இந்த எலக்ட்ரானுக்கான குவாண்டம் எண்கள் n = 1 மற்றும் l = 0 அதாவது இந்த எலக்ட்ரான் 1s ஆர்பிட்டாலில் உள்ளது. 1s ஆர்பிட்டாலுக்கான, R (r2) Vs r வரைபடம் படம் (23)ல் கொடுக்கப்பட்டுள்ளது.
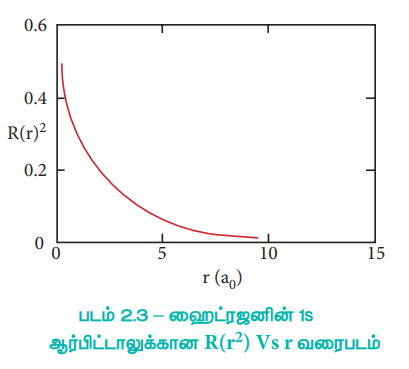
படம் 2.3 – ஹைட்ரஜனின் 1s ஆர்பிட்டாலுக்கான R (r2) Vs r வரைபடம்
மேற்கண்டுள்ள வரைபடத்திலிருந்து, எலக்ட்ரானுக்கும் அணுக்கருவிற்கும் இடையேயான தூரம் குறையும்போது, எலக்ட்ரானைக் காண்பதற்கான நிகழ்த்தகவும் அதிகரிக்கின்றது என அறிய முடிகிறது, r = 0, எனும் போது R (r2) - ன் மதிப்பானது பெருமமாகிறது. அதாவது |Ψ|2 - ன் அதிக பட்ச மதிப்பானது அணுக்கருவினுள் அமைகிறது. எனினும் அணுக்கருவினைச் சுற்றி கொடுக்கப்பட்ட கோளகக் கூட்டில் எலக்ட்ரானைக் காண்பதற்கான நிகழ்தகவே முக்கியமானதாகும். r மற்றும் r + dr ஆகிய ஆரங்களுடைய இரு ஒரு மைய கோளங்களுக்கு இடைப்பட்ட கன அளவு (dV) - யைக் கருதுவோம்.
கோளத்தின் கன அளவு V = 4 / 3 (πr3)
dV / dr = 4 / 3 [π (3r2)]
dV = 4 πr2 dr
Ψ2dV = 4 πr2 Ψ2 dr ----------- (2.16)
r மதிப்பிற்கு எதிரான 4πr2 . R(r)2 – ன் வரைபடம் கீழே கொடுக்கப்பட்டுள்ளது.
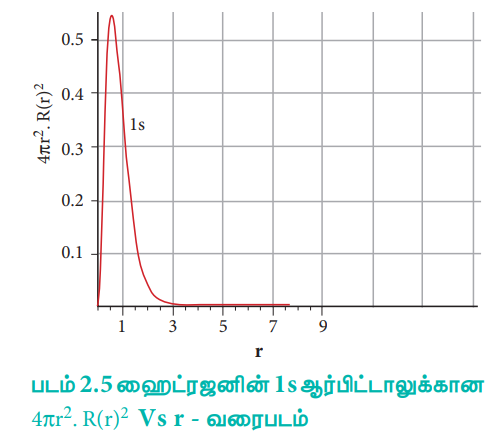
படம் 2.5 ஹைட்ரஜனின் 1s ஆர்பிட்டாலுக்கான 4πr2 . R(r)2 Vs r - வரைபடம்
மேற்கண்டுள்ள வரைபடத்தின் மூலம் அணுக்கருவிலிருந்து 0.52 Å தொலைவில் அதிகபட்ச நிகழ்த்தகவு அமைந்துள்ளது என அறிய முடிகிறது. இத்தொலைவு போர் ஆரத்திற்குச் சமம். இத்தொலைவில் அணுக்கருவினை சுற்றி, எலக்ட்ரானைக் காண்பதற்கான அதிகபட்ச நிகழ்தகவு உள்ளதை இது குறிப்பிட்டாலும், இத்தொலைவினை தவிர்த்த பிற தொலைவுகளிலும் எலக்ட்ரானை காண்பதற்கான வாய்ப்பு (நிகழ்தகவு) உண்டு. ஹைட்ரஜன் அணுவில் 2s, 3s, 3p மற்றும் 3d ஆர்பிட்டால்களுக்கான ஆர பகிர்வு சார்பினை பின்வருமாறு வரைபடத்தில் குறிப்பிடலாம்.
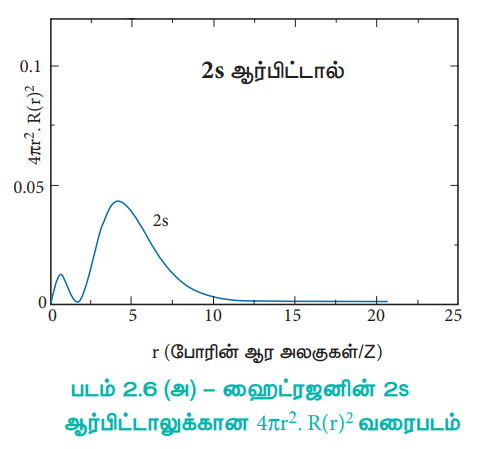
படம் 2.6 (அ) - ஹைட்ரஜனின் 2s ஆர்பிட்டாலுக்கான 4πr2 . R(r)2 வரைபடம்
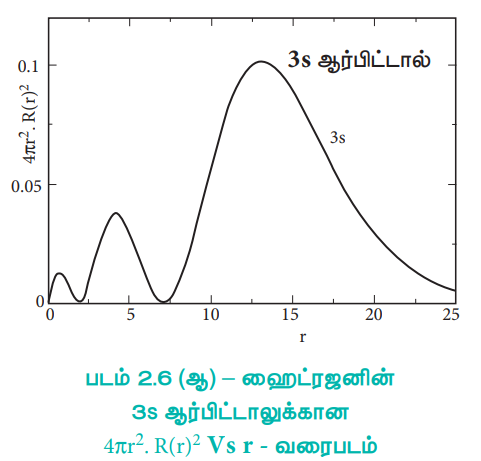
படம் 2.6 (ஆ) - ஹைட்ரஜனின் 3s ஆர்பிட்டாலுக்கான 4πr2 . R(r)2 Vs r - வரைபடம்
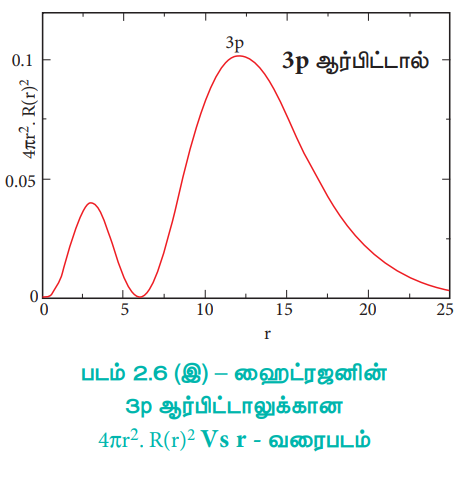
படம் 2.6 (இ) – ஹைட்ரஜனின் 3p ஆர்பிட்டாலுக்கான 4πr2 . R(r)2 Vs r - வரைபடம்
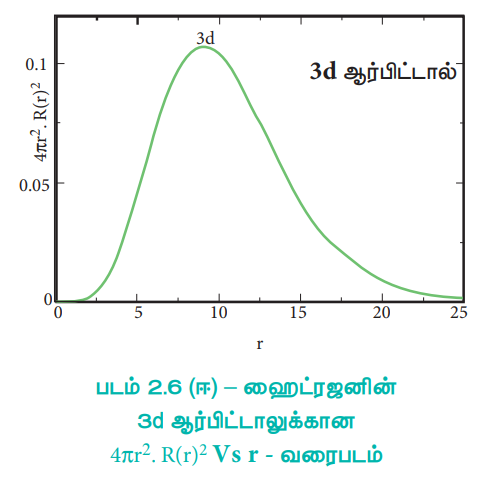
படம் 2.6 (ஈ) – ஹைட்ரஜனின் 3d ஆர்பிட்டாலுக்கான 4πr2 . R(r)2 Vs r - வரைபடம்
2s ஆர்பிட்டாலுக்கு, அணுக்கருவிலிருந்து தொலைவு (r) அதிகரிக்கும்போது, நிகழ்தகவு அடர்த்தி முதலில் அதிகரித்து, ஒரு சிறிய பெரும மதிப்பை அடைகிறது. அதன் பின்னர் பூஜ்ஜியத்திற்கு குறைந்து மீண்டும் மற்றுமொரு பெரும மதிப்பினை அடைந்து பின் பூஜ்ய மதிப்பினையடைகிறது. இவ்வாறு நிகழ்தகவு அடர்த்தி சார்பின் மதிப்பு எப்பகுதியில் பூஜ்யமாகிறதோ அப்பகுதி, கணு புறப்பரப்பு (nodal surface) அல்லது ஆரக்கணு (radial node) என அழைக்கப்படுகிறது. பொதுவாக, ns – ஆர்பிட்டாலானது (n – 1) கணுக்களைப் பெற்றுள்ளன. என கண்டறியப்பட்டுள்ளது. அதாவது 2s ஆர்பிட்டால் ஒரு கணுவையும், 3s ஆர்பிட்டால் இருகணுக்களையும் கொண்டுள்ளது. இது பிற ஆர்பிட்டால்களுக்கும் பொருந்தும். 3p மற்றும் 3d ஆர்பிட்டால்களுக்கான, 4πr2 R(r)2ன் வரைபடமானது, இதனைப் போலவே உள்ளது. ஆனால் இந்நேர்வில் ஆர கணுக்களின் எண்ணிக்கை (n – l - 1) க்குச் சமம். இங்கு 'n' என்பது முதன்மைக் குவாண்டம் எண்ணையும், l என்பது கோண உந்த குவாண்டம் எண்ணையும் குறிப்பிடுகின்றது.
கோணப் பகிர்வு சார்பு (Angular distribution function)
அணுக்கருவை மையத்தில் கொண்டுள்ள ஒரு கோளத்தில் உள்ள, எலக்ட்ரானைக் கண்டறியும் நிகழ்தகவில் ஏற்படும் மாறுபாடு ஆனது கோண உந்தக் குவாண்டம் எண்ணை பொருத்து அமைகிறது. 1s ஆர்பிட்டாலுக்கு l = 0 மற்றும் m = 0. மேலும் f(θ) = 1 / √2 மற்றும் g(ϕ) = 1 / √2π எனவே, கோண பகிர்வு சார்பு f(θ). g(ϕ) ஆனது 1/2 √π - க்குச் சமம். இது கோணம் θ மற்றும் ϕ -ஐச் சார்ந்து அமைவதில்லை. எனவே, எலக்ட்ரானைக் காண்பதற்கான நிகழ்தகவு அணுக்கருவிலிருந்து உள்ள திசையினைப் பொருத்து அமைவதில்லை. எனவே S ஆர்பிட்டாலின் வடிவம் படம் 2.7ல் கொடுக்கப்பட்டுள்ளவாறு ஒரு சீர்மைக் கோளமாகும்.
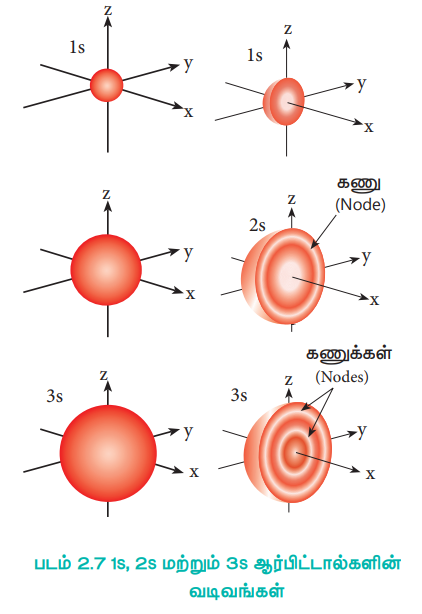
படம் 2.7 1s, 2s மற்றும் 3s ஆர்பிட்டால்களின் வடிவங்கள்
p - ஆர்பிட்டாலுக்கு l = 1, மற்றும் இதற்கு இணையான m மதிப்புகள் முறையே -1, 0 மற்றும் +1 ஆகும். இதற்கான கோண பகிர்வு சார்புகள் சிக்கலானவை, மேலும் இங்கு விவரிக்கப்படவில்லை. 'p’ ஆர்பிட்டாலின்டம்பல் வடிவம் படம் (2.8)ல் கொடுக்கப்பட்டுள்ளது. 'm'ன் மூன்று மதிப்புகளிலிருந்து மூன்று திசையமைப்புடைய ‘p' ஆர்பிட்டால்கள் உள்ளன என அறியமுடிகிறது. இந்த ஆர்பிட்டால்கள் px, py, மற்றும் pz குறியிடப்படுகின்றன. ஆர்பிட்டால்களின் கோணப்பகிர்வின் மூலம் px, py, மற்றும் pz, ஆர்பிட்டால்களின் மடல்கள் (Iobes) முறையே x, y மற்றும் z அச்சுகளின் வழியே அமைந்துள்ளது என அறியலாம்.
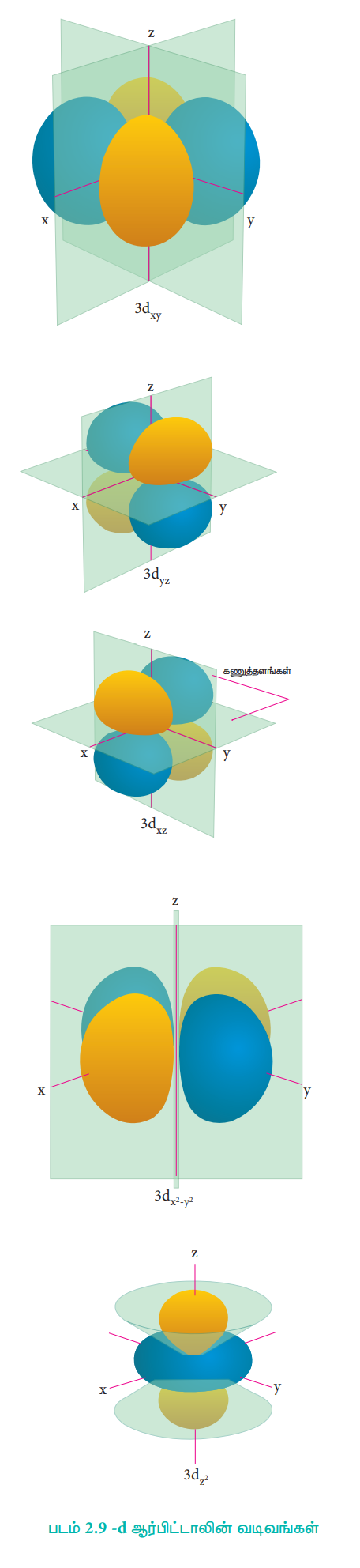
படம் 2.8ல் காட்டப்பட்டுள்ளவாறு 2P ஆர்பிட்டால் ஒரு கணுத்தளத்தினை (nodal plane) பெற்றுள்ளது. d ஆர்பிட்டாலுக்கு l = 2, இதற்கு இணையான m மதிப்புகள் முறையே -2, -1, 0, +1, +2. d ஆர்பிட்டாலானது குளோவர் இலையின் வடிவமைப்பினை ஒத்துள்ளது. m-ன் இந்த ஐந்து மதிப்புகளானது, dx2 – y2, dxy, dz2, dyz, dzx ஆகிய ஐந்து ஆர்பிட்டால்கள் உள்ளதைக் காட்டுகிறது. படம் (2.9)ல் காணப்பட்டுள்ளவாறு, 3d ஆர்பிட்டால் இரு கணுத்தளங்களை(nodal planes)பெற்றுள்ளன.
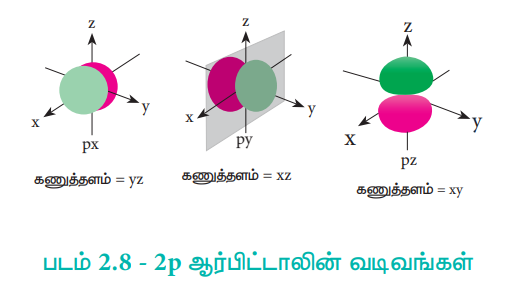
படம் 2.8 - 2p ஆர்பிட்டாலின் வடிவங்கள்
f ஆர்பிட்டாலுக்கு, l = 3 மற்றும் m மதிப்புகள் முறையே -3, -2, -1, 0, +1, +2, +3 ஆகும். இந்த m மதிப்புகளுக்கு இணையாக ஏழு f ஆர்பிட்டால்கள் fy(3x2-y2), fz(x2- y2), fyz2, fz3, fxz2, fxyz, fx(x2- 3y2) காணப்படுகின்றன.
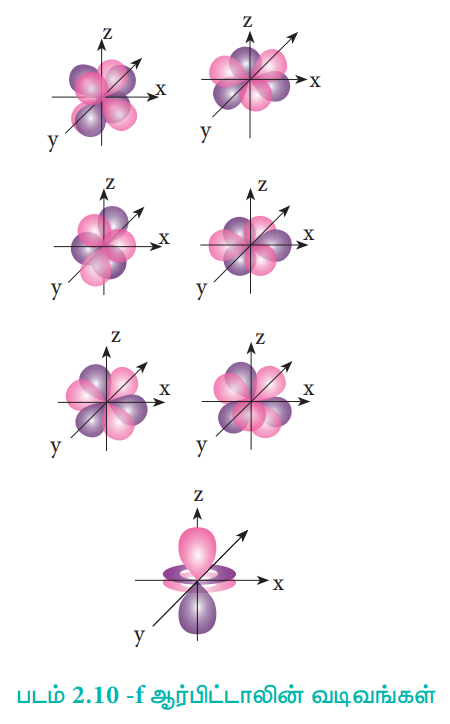
படம் 2.10 - f ஆர்பிட்டாலின் வடிவங்கள்
தன் மதிப்பீடு
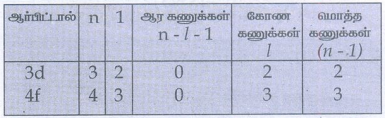
4) 3d மற்றும் 4f ஆர்பிட்டால்களில் காணப்படும் ஆர மற்றும் கோண கணுக்களின் எண்ணிக்கையினைக் கணக்கிடுக.