11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
ஆர்பிட்டால்கள் நிரப்பப்படுதல்
ஆர்பிட்டால்கள் நிரப்பப்படுதல்
ஆஃபா தத்துவம், பௌலி தவிர்க்கைத் தத்துவம் மற்றும் ஹுண்ட்விதி ஆகிய விதிகளுக்கிணங்க ஒரு அணுவின் பல்வேறு ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுகின்றன.
1. ஆஃபாதத்துவம்
ஜெர்மன் மொழியில் ஆஃபா என்ற சொல்லுக்கு கட்டமைத்தல் (building up) என்பது பொருளாகும். இயல்பு ஆற்றல் நிலையில் உள்ள அணுவின், ஆர்பிட்டால்கள் அவற்றின் ஆற்றலின் ஏறுவரிசையில் நிரப்பப்படுகின்றன. அதாவது, எலக்ட்ரான்கள், அவை நிரப்பப்படுவதற்கு வாய்ப்புள்ள ஆர்பிட்டால்களில், எந்த ஆர்பிட்டால் குறைந்த ஆற்றலுடையதோ அந்த ஆர்பிட்டாலில் முதலில் நிரம்பும். குறைவான ஆற்றலுடைய ஆர்பிட்டால் முழுமையாக நிரப்பப்பட்ட பின்னரே எலக்ட்ரானானது அடுத்த உயர் ஆற்றலுடைய ஆர்பிட்டாலினுள் நுழையும். படம் 2.12ல் ஆஃபா தத்துவத்தின் அடிப்படையில், பல்வேறு ஆர்பிட்டால்களின் நிரப்பப்படும் வரிசை தரப்பட்டுள்ளது. இவ்வரிசை (n+l) விதிப்படி அமைந்துள்ளது.

படம் 2.12 ஆஃபாதத்துவம்
2. பெளலி தவிர்க்கை தத்துவம்
ஒரு அணுவில் உள்ள எந்த இரு எலக்ட்ரான்களுக்கும், அவற்றின் நான்கு குவாண்டம் எண்களின் மதிப்பின் தொகுப்பும் ஒன்றாக இருக்காது என்ற தவிர்க்கைத் தத்துவத்தினை பௌலி கூறினார். அதாவது ஒவ்வொரு எலக்ட்ரானும் அதற்கென தனித்த நான்கு குவாண்டம் எண்களின் (n, l, m மற்றும் s) மதிப்பினை பெற்றிருக்க வேண்டும் என்பதே இதன் பொருளாகும்
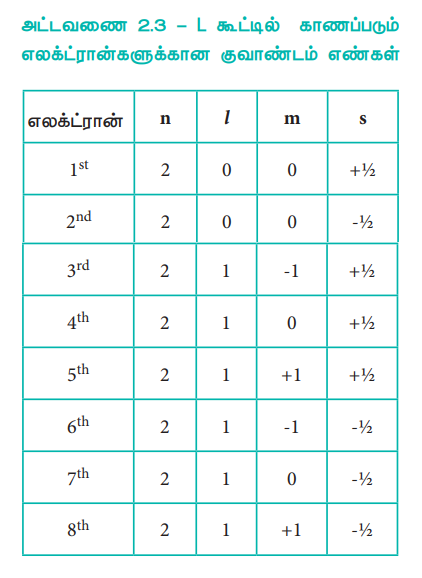
ஹைட்ரஜனில் உள்ள ஒரு தனித்த எலக்ட்ரானிற்கு, நான்கு குவாண்டம் எண்களின் மதிப்புகள், n = 1; l = 0; m = 0 மற்றும் s = +1/2. ஹீலியத்தின் உள்ள இரு எலக்ட்ரான்களில் ஒரு எலக்ட்ரான் ஹைட்ரஜனைப் போலவே, n = 1, l = 0, m = 0 மற்றும் s = +1/2. மதிப்பினையும், மற்றொரு எலக்ட்ரானைப் பொருத்த வரையில், நான்காவது குவாண்டம் எண் மட்டும் மாறுபட்டு காணப்படுகிறது. அதாவது n = 1, l = 0, m = 0 மற்றும் s = -1/2. தற்சுழற்சி குவாண்டம் எண் +1/2 மற்றும் -1/2 ஆகிய இருமதிப்புகளை மட்டுமே பெற இயலும் எனநாம் அறிவோம். எனவே, பெளலி தத்துவப்படி, கொடுக்கப்பட்ட ஒரு ஆர்பிட்டாலில் அதிகபட்சமாக இரு எலக்ட்ரான்களை மட்டுமே நிரப்ப முடியும். L கூட்டில் அதிக பட்சமாக காணப்படும் எட்டு எலக்ட்ரான்களுக்கும், நான்கு குவாண்டம் எண்களையும் எழுதுவதன் மூலம் இதனை நாம் புரிந்து கொள்ளமுடியும்.
அட்டவணை 2.3 -L கூட்டில் காணப்படும் எலக்ட்ரான்களுக்கான குவாண்டம் எண்கள்
3. ஹுண்ட்விதி
ஆஃபாதத்துவமானது, பல்வேறு ஆர்பிட்டால்களில் எலக்ட்ரான்கள் எவ்வாறு நிரப்பப்படுகின்றன என்பதனை விளக்குகிறது. ஆனால் px, py, pz போன்ற சம ஆற்றலுடைய (degenerate) ஆர்ப்பிட்டல்களில் எலக்ட்ரான்கள் நிரப்பப்படுவது பற்றி அவ்விதியில் ஏதும் குறிப்பிடப்படவில்லை. இந்த ஆர்பிட்டால்கள் எவ்வரிசையில் நிரப்பப்பட வேண்டும்? என்ற வினாவிற்கு உரிய விடையினை ஹுண்ட்விதி தருகிறது.
ஹுண்ட் விதிப்படி,
சம ஆற்றலுடைய ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படும் போது, நிரப்பப்படுவதற்கு வாய்ப்புள்ள அனைத்து சமஆற்றலுடைய ஆர்பிட்டால்களும் ஒற்றை எலக்ட்ரானால் நிரப்பப்பட்ட பின்னரே எலக்ட்ரான் இரட்டையாதல் (electron pairing) நிகழும். மூன்று p ஆர்பிட்டால்கள், ஐந்து d ஆர்பிட்டால்கள் மற்றும் ஏழு f ஆர்பிட்டால்கள் உள்ளன என நாம் அறிவோம். இந்த ஆர்பிட்டால்களில் முறையே, நான்காவது ஆறாவது மற்றும் எட்டாவது எலக்ட்ரான்கள் நுழையும் போது மட்டுமே எலக்ட்ரான் இரட்டையாதல் துவங்கும்.
உதாரணமாக ஆறு எலக்ட்ரான்களைக் கொண்டுள்ள கார்பன் அணுவினைக் கருதுவோம். ஆஃபாதத்துவத்தின் படி, இதன் எலக்ட்ரான் அமைப்பு 1s2, 2s2, 2p2. இதனை பின்வருமாறு குறிப்பிடலாம்.

இந்நிகழ்வில், எலக்ட்ரான் - எலக்ட்ரான் விலக்கு விசையினை குறைத்திட (சிறுமமாக்கிட) ஹுண்ட் விதிப்படி, ஆறாவது எலக்ட்ரானானது, ஐந்தாவது எலக்ட்ரான் இடம் கொண்டுள்ள px ஆர்பிட்டாலில் சென்று இரட்டையாகாமல், py ஆர்பிட்டாலுக்குச் செல்கிறது.
தன்மதிப்பீடு
6. Fe3+ (Z = 26), Mn2+ (Z = 25) மற்றும் ஆர்கான் (Z = 18) ஆகியவற்றின் சிறும ஆற்றல் நிலையில் காணப்படும் தனித்த எலக்ட்ரான்களின் எண்ணிக்கையினைக் கணக்கிடுக.
தீர்வு :

4. அணுக்களின் எலக்ட்ரான் அமைப்பு
ஒரு அணுவில் உள்ள, வெவ்வேறு ஆர்பிட்டால்களில் அந்த அணுவின் எலக்ட்ரான்கள் பங்கிடப்பட்டுள்ளதை குறிப்பிடுவது எலக்ட்ரான் அமைப்பு எனப்படும். ஆஃபாதத்துவம், ஹுண்ட்விதி, பௌலிதத்துவம் ஆகியவற்றின் அடிப்படையில் எலக்ட்ரான் அமைப்பினை எழுதமுடியும். எலக்ட்ரான் அமைப்பானது nlx என்ற குறியீட்டால் எழுதப்படுகிறது. இங்கு n என்பது முதன்மைக் குவாண்டம் எண். l என்பது ஆர்பிட்டால்களின் எழுத்து வடிவினை குறிப்பிடுகிறது [ s (l = 0), p (l = 1), d (l = 2) மற்றும் f (l = 3) ] மற்றும் x குறிப்பிட்ட ஆர்ப்பிட்டாலில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கையினைக் குறிப்பிடுகிறது.
ஒரே ஒரு எலக்ட்ரானைக் கொண்டுள்ள ஹைட்ரஜன் அணுவினை நாம் கருதுவோம். ஆஃபா தத்துவத்தின்படி, குறைவான ஆற்றலுடைய 1s ஆர்பிட்டாலில் இந்த எலக்ட்ரான் இடம் கொள்கிறது. இந்நேர்வில் n = 1; l = s; x = 1. எனவே, எலக்ட்ரான் அமைப்பு 1s1 (one – ess - one என கூற வேண்டும்). இந்த அமைப்பிற்கான ஆர்பிட்டால் வரைபடம்.
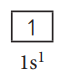
ஒன்று முதல் 10 வரையிலான அணு எண்களை கொண்டுள்ள அணுக்களுக்கான எலக்ட்ரான் அமைப்பு மற்றும் ஆர்பிட்டால் வரைபடம் பின்வருமாறு :-
அட்டவணை 2.4 - முதல் 10 தனிமங்களுக்கு எலக்ட்ரான் அமைப்பு மற்றும் ஆர்பிட்டால் வரைபடம்
குரோமியம், காப்பர் போன்ற சிலஅணுக்களின் எலக்ட்ரான் அமைப்பானது, ஆஃபாதத்துவத்தின் படி எதிர்பார்க்கப்படும் எலக்ட்ரான் அமைப்பிலிருந்து சிறிது வேறுபட்டு காணப்படுகிறது.
குரோமியம் ( Z = 24) அணுவிற்கு எதிர்பார்க்கப்படும் எலக்ட்ரான் அமைப்பு.
1s2 2s2 2p6 3s2 3p6 3d4 4s2
உண்மையான எலக்ட்ரான் அமைப்பு
1s2 2s2 2p6 3s2 3p6 3d5 4s1
காப்பர்- (Z = 29) அணுவிற்கு எதிர்பார்க்கப்படும் எலக்ட்ரான் அமைப்பு
1s2 2s2 2p6 3s2 3p6 3d9 4s2
உண்மையான எலக்ட்ரான் அமைப்பு
1s2 2s2 2p6 3s2 3p6 3d10 4s1
மேற்கண்டுள்ளவாறு எலக்ட்ரான் அமைப்பு காணப்படுவதற்கு பகுதியளவு நிரப்பப்பட்ட ஆர்ப்பிட்டால்கள் மற்றும் முழுமையாக நிரப்பப்பட்ட ஆர்பிட்டால்கள் அதிக நிலைப்புத் தன்மையினை பெற்று விளங்கும் தன்மை காரணமாக அமைகிறது. அதாவது p2, p5, d4, d9, f6, மற்றும் f13 அமைப்புகளைக் காட்டிலும் p3, p6, d5, d10, f7, மற்றும் f14 அமைப்புகள் அதிகநிலைப்புத் தன்மையினைக் கொண்டுள்ளன. இந்த நிலைப்புத் தன்மையின் காரணமாக, ஆஃபா தத்துவப்படி 4s ஆர்பிட்டாலில் இடம் பெறவேண்டிய ஒரு எலக்ட்ரான் குரோமியத்தில் 3d ஆர்பிட்டாலில் இடம் பெறுவதன் மூலம் அதிக நிலைப்புத் தன்மையினை பெறுகிறது. இதைப் போலவே காப்பரும் d ஆர்பிட்டாலில் முழுமையாக நிரப்ப பட்ட எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளது.
தன்மதிப்பீடு
7. 4f2 என்ற குறியீடு உணர்த்தும் பொருள் யாது? இதில் உள்ள எலக்ட்ரான்களுக்கு, நான்கு குவாண்டம் எண்களின் மதிப்புகளையும் எழுதுக.
தீர்வு
4f2 எனும் குறியீட்டில் உள்ள எண் 4 முதன்மை குவாண்டம் எண்ணை குறிக்கிறது. முதன்மை குவாண்டம் எண் ஆற்றல் மட்டத்தினை குறிப்பிட பயன்படுகிறது. f எனும் எழுத்து துணை ஆற்றல் மட்டத்தினை குறிப்பிடுகிறது. உயர்த்தப்பட்ட எண் 2 துணைக்கூடு fல் உள்ள எலக்ட்ரான்களை குறிப்பிடுகிறது. இவ்விரண்டு எலக்ட்ரான்களின் குவாண்டம் எண்கள் முறையே n = 4, l = 3, m = −3, s = + ½ மற்றும் n = 4, l = 3, m = −2, s = + ½
5. சரிபாதியளவு மற்றும் முழுவதும் நிரப்பப்பட்ட ஆர்பிட்டால்களின் நிலைப்புத் தன்மை
சம ஆற்றலுடைய ஆர்பிட்டால்களில், சரிபாதியளவு மற்றும் முழுவதும் நிரப்பப்பட்ட ஆர்பிட்டால்களின் நிலைப்புத் தன்மையானது. பிற பகுதியளவு நிரப்பப்பட்ட ஆர்பிட்டால்களைக் காட்டிலும் அதிகம். இதனை சமச்சீர்தன்மை (symmetry) மற்றும் பரிமாற்ற ஆற்றல் (exchange energy) ஆகியவற்றின் அடிப்படையில் விளக்கலாம். எடுத்துக்காட்டாக குரோமியம் [Ar] 3d4 4s2 என்ற எலக்ட்ரான் அமைப்பினை பெற்றிருக்காமல், [Ar] 3d5 4s1 என்ற எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளது. இதற்கு எலக்ட்ரான்களின் சமச்சீரான பங்கீடு மற்றும் d எலக்ட்ரான்களின் பரிமாற்ற ஆற்றல் ஆகியன காரணமாக அமைகின்றன.
எலக்ட்ரான்களின் சமச்சீரான பங்கீடு
சமச்சீர்த் தன்மையானது, நிலைப்புத் தன்மையினைத் தருகிறது. படம் 2.13ல் கொடுக்கப்பட்டள்ளவாறு சரிபாதியளவு மற்றும் முழுமையாக நிரப்பப்பட்ட அமைப்புகளில், எலக்ட்ரான்கள் சமச்சீராக பங்கிடப்பட்டுள்ளன. எனவே, அவைகள், சமச்சீர்த் தன்மையற்ற அமைப்புகளைக் காட்டிலும் அதிக நிலைப்புத் தன்மையினை பெற்றுள்ளன.

படம் 2.13 சரிபாதியளவு மற்றும் முழுமையாக நிரப்பப்பட்ட p, d, f ஆர்பிட்டால்கள்
px, py மற்றும் pz போன்ற ஆர்பிட்டால்கள் சமஆற்றலைப் பெற்றிருக்கின்றன. மேலும் அவற்றின் புறவெளி திசையமைப்பு (படம் 2.14) ல் காட்டியவாறு வெவ்வேறு திசைகளில் அமைகின்றன. சமச்சீரான பங்கீட்டினால் ஒரு எலக்ட்ரான் மற்றொரு எலக்ட்ரானை மறைக்கும் (shielding) விளைவு, ஒப்பீட்டு அளவில் குறைவாகும் எனவே, எலக்ட்ரான்கள் அணுக்கருவால் அதிக கவர்ச்சி விசையுடன் ஈர்க்கப்படுகின்றன. இதனால் நிலைப்புத் தன்மை அதிகரிக்கின்றது.

படம் 2.14 சம ஆற்றலுடைய P ஆர்பிட்டாலின் வடிவங்கள்
பரிமாற்ற ஆற்றல் (Exchange energy)
சம ஆற்றலுடைய ஆர்பிட்டால்களில், இரண்டு அல்லது அதற்கு மேற்பட்ட ஒரே தற்சுழற்சி உடைய எலக்ட்ரான்கள் இருக்குமாயின், அவைகளினுடைய இடங்களை பரிமாற்றிக் கொள்வதற்கு வாய்ப்பு உள்ளது. பரிமாற்றம் அடையும் நிகழ்வின் போது ஆற்றலானது வெளியிடப்படுகிறது. மேலும் வெளியிடப்படும் ஆற்றல் பரிமாற்ற ஆற்றல் (exchange energy) என அழைக்கப்படுகிறது. பரிமாற்றங்களின் எண்ணிக்கை அதிகமாக இருப்பதற்கு வாய்ப்பு இருப்பின், வெளியிடப்படும் ஆற்றலின் மதிப்பும் அதிகமாக இருக்கும். அதிக எண்ணிக்கையில் பரிமாற்றங்கள் நிகழ்வதற்கு சரிபாதியளவு மற்றும் முழுமையாக நிரப்பப்பட்டுள்ள நேர்வுகளில் மட்டுமே, வாய்ப்புகள் அதிகம்.
எடுத்துக்காட்டாக, குரோமியத்தின் [Ar] 3d5 4s1 ஆகும். இதில் 3d ஆர்பிட்டாலானது சரிபாதியளவு நிரப்பப்பட்டுள்ளது. மேலும் படம் (2.15) ல் கொடுக்கப்பட்டுள்ளவாறு பத்து பரிமாற்றங்கள் நிகழ்வதற்கு வாய்ப்புகள் உள்ளன. மாறாக, [Ar] 3d4 4s2 அமைப்பிற்கு ஆறு பரிமாற்றங்கள் மட்டுமே நிகழ்வதற்கு வாய்ப்புகள் உள்ளன. எனவே சரிபாதியளவு நிரப்பப்பட்ட அமைப்பிற்கு பரிமாற்ற ஆற்றல் அதிகம் இது சரி பாதியளவு நிரப்பப்பட்ட 3d ஆர்பிட்டால்களின் நிலைப்புத் தன்மையினை அதிகரிக்கிறது. சம ஆற்றலுடைய ஆர்பிட்டால்களில் ஒற்றை எலக்ட்ரான் நிரப்பப்படுவதற்கு ஏதுவாக காலியான ஆர்பிட்டால்கள் இருக்கும் வரை எலக்ட்ரான் இரட்டையாதல் நிகழாது என்ற ஹுண்ட்விதிக்கு அடிப்படையாக பரிமாற்ற ஆற்றலானது அமைகிறது.


தன் மதிப்பீடு
8) Ni2+ அல்லது Fe3+ அதிக நிலைப்புத் தன்மையுடைய எலக்ட்ரான் அமைப்பினை பெற்றுள்ளது எது?
தீர்வு
Ni2+ ன் எலக்ட்ரான் அமைப்பு ( Z = 28)
1s2, 2s2, 2p6, 3s2, 3p6, 3d8
Fe3+ ன் எலக்ட்ரான் அமைப்பு ( Z = 26)
1s2, 2s2, 2p6, 3s2, 3p6, 3d5
Fe2+ ஆனது Ni2+ ஐ விட அதிக நிலைப்புத் தன்மையை பெற்றுள்ளது. ஏனெனில் Fe2+ பாதி நிரவல் நிரம்பியே 3d ஆர்பிட்டாலை பெற்றுள்ளது.