11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
ஹைட்ரஜன் பிணைப்பு
ஹைட்ரஜன் பிணைப்பு
வேதியியல் மற்றும் உயிரியல் நிகழ்வுகளில் இயற்கையில் நிகழும் ஒரு முக்கியமான நிகழ்வு ஹைட்ரஜன் பிணைப்பாகும். DNA மற்றும் புரதங்களின் வடிவமைப்பில், ஹைட்ரஜன் பிணைப்பு மிக முக்கிய பங்கு வகிக்கிறது. ஒரு ஹைட்ரஜன் அணுவானது (H), அதிக எலக்ட்ரான் கவர்தன்மை உடைய புளூரின் (F) அல்லது ஆக்ஸிஜன் (O) அல்லது நைட்ரஜன் (N) போன்ற அணுக்கள் ஒன்றுடன் பிணைக்கப்பட்டிருக்கும் போது, அப்பிணைப்பு முனைவுறு பிணைப்பாகிறது. இவ்விளைவின் காரணமாக முனைவுற்ற ஹைட்ரஜன் அணுவானது அதன் சூழலில் உள்ள மற்றொரு எலக்ட்ரான் கவர்தன்மை அதிகமுடைய அணுவுடன் ஒரு வலிமை குறைந்த நிலை மின்னியல் கவர்ச்சி விசையை ஏற்படுத்தும் இயல்பினைப் பெற்றுள்ளது. இக்கவர்ச்சி விசையே ஹைட்ரஜன் பிணைப்பு (20 - 50 kJ mol-1) என்று அழைக்கப்படுகிறது. இப்பிணைப்பு விடுபட்ட கோடுகளால் (.............) குறிக்கப்படுகிறது.
இப்பிணைப்பு சகப்பிணைப்பை விட வலிமை குறைவானது (<100 kJ mol-1) ஆனால் வாண்டர்வால்ஸ் கவர்ச்சி விசையைவிட வலிமையானது (>20 kJ mol−1) ஹைட்ரஜன் பிணைப்பானது ஆவி அழுத்தம் (H2O மற்றும் H2S) கொதிநிலை, திரவங்கள் ஒன்றோடு ஒன்று கலக்கும் தன்மை (H2O மற்றும் C2H5OH), பரப்பு இழுவிசை, அடர்த்தி, பாகுநிலைதன்மை, ஆவியாதல் மற்றும் உருகுதலின் வெப்பம் போன்ற பல்வேறு இயற்பண்புகளில் முக்கிய விளைவுகளை ஏற்படுத்துகிறது.
மூலக்கூறினுள் நிகழும் ஹைட்ரஜன் பிணைப்பு
மூலக்கூறினுள் நிகழும் ஹைட்ரஜன் பிணைப்பானது ஒரு தனித்த மூலக்கூறுக்கு உள்ளாகவே நிகழ்கிறது.
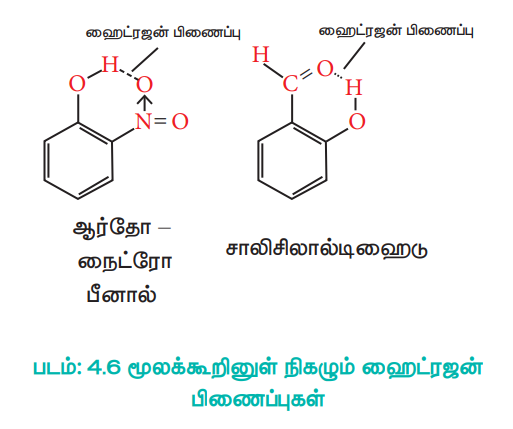
படம்: 4.6 மூலக்கூறினுள் நிகழும் ஹைட்ரஜன் பிணைப்புகள்
மூலக்கூறுகளுக்கிடைப்பட்ட ஹைட்ரஜன் பிணைப்பு
மூலக்கூறுகளுக்கிடைப்பட்ட ஹைட்ரஜன் பிணைப்பானது இரண்டு வேறுபட்ட மூலக்கூறுகளுக்கிடையே நிகழ்கிறது. ஹைட்ரஜன் பிணைப்பு இடைவினையை ஏற்படுத்துவதற்கு ஏதுவாக ஹைட்ரஜன் வழங்கி மற்றும் ஹைட்ரஜன் ஏற்பியினை தகுந்த இடத்தில் பெற்றுள்ள ஒரே மாதிரியான மூலக்கூறுகள் அல்லது வெவ்வேறு மூலக்கூறுகளுக்கிடையே இத்தகைய ஹைட்ரஜன் பிணைப்பு உருவாகிறது. எடுத்துக்காட்டாக: மூலக்கூறுகளுக்கு இடைப்பட்ட ஹைட்ரஜன் பிணைப்பானது, அம்மோனியா மூலக்கூறுகளுக்கிடையே நிகழலாம். அல்லது நீர் மூலக்கூறுகளுக்கிடையேயோ அல்லது அம்மோனியா மற்றும் நீர் மூலக்கூறுகளுக்கிடையேயோ உருவாகலாம்.
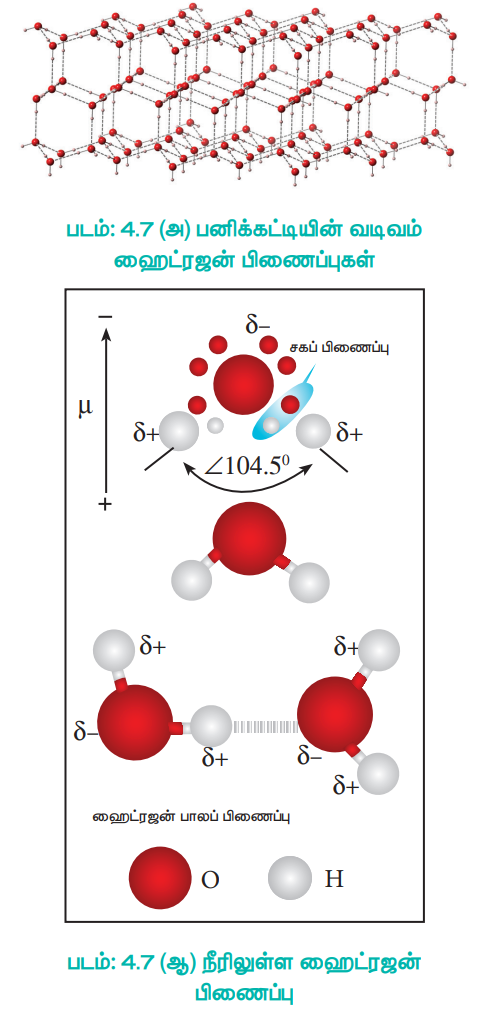
நீர் மூலக்கூறுகள் அவைகளுக்கிடையே வலிமையான ஹைட்ரஜன் பிணைப்பை உருவாக்குகிறது. எடுத்துக்காட்டாக ஒவ்வொரு நீர் மூலக்கூறும், மற்ற நான்கு நீர் மூலக்கூறுகளுடன் ஹைட்ரஜன் பிணைப்பால் பிணைக்கப்பட்டுள்ளது. குறைந்த தூரம் (100 pm) சகப்பிணைப்பையும் (திடக் கோடுகள்) மற்றும் அதிக தூரம் (180 pm) ஹைட்ரஜன் பிணைப்பையும் (விடுபட்ட கோடுகள்) குறிக்கின்றன.
பனிக்கட்டியில் உள்ள ஒவ்வொரு ஆக்ஸிஜன் அணுவும், நான்முகி வடிவில் நான்கு நீர் மூலக்கூறுகளுடன் ஹைட்ரஜன் பிணைப்பின் மூலம் சூழப்பட்டுள்ளன. ஒவ்வொரு நீர் மூலக்கூறிலும் உள்ள இரண்டு ஹைட்ரஜன் அணுக்கள் மற்றும் ஆக்சிஜன் அணுவின் மீது இரண்டு ஜோடி தனித்த எலக்ட்ரான்கள், மேற்கண்டுள்ள முப்பரிமாண வடிவமைப்பு ஏற்பட வழிவகை செய்கிறது. இவ்வாறான அமைப்பு ஒரு திறந்த வடிவமைப்பினை உருவாக்குகிறது. 0°Cல் நீருடன் ஒப்பிடும்போது, பனிக்கட்டியானது குறைவான அடர்த்தியினைக் கொண்டுள்ளதற்கு இவ்வமைப்பே காரணமாக அமைகிறது. பனிக்கட்டியில் ஹைட்ரஜன் பிணைப்பு நீண்ட எல்லைவரை காணப்படுகிறது. ஆனால், திரவ நிலையில் உள்ள நீரில் ஹைட்ரஜன் பிணைப்பு குறைவான எல்லையில் மட்டும் காணப்படுகிறது. எனவே திரவ நிலையில் உள்ள நீரின் அடர்த்தி அதிகம்.
ஹைட்ரஜன் பிணைப்பானது, எளிய மூலக்கூறுகளில் காணப்படுவது மட்டும் அல்லாமல், புரதம் போன்ற சிக்கலான உயிரி மூலக்கூறுகளிலும் காணப்படுகின்றன. மேலும் அவை உயிரியல் செயல்முறைகளுக்கு மிக முக்கியமானதாகும். எடுத்துக்காட்டாக டி ஆக்ஸி ரிபோ நியூக்ளிக் அமிலத்தின் (DNA) சுருள் வடிவிலான இரு இழைகள் ஒன்றோடொன்று இணைந்திருக்க ஹைட்ரஜன் பிணைப்பு முக்கிய பங்கு வகிக்கிறது.
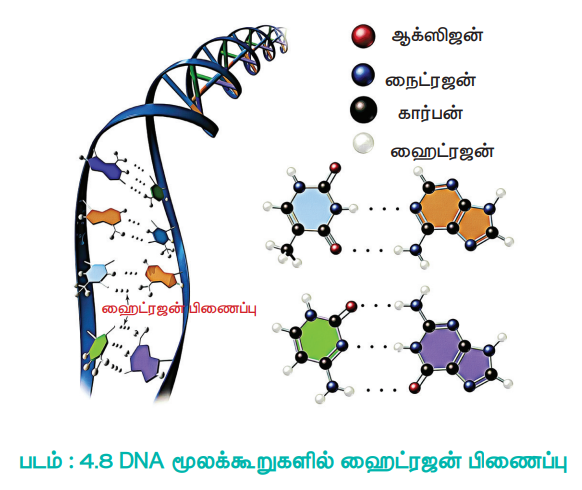
படம் :4.8 DNA மூலக்கூறுகளில் ஹைட்ரஜன் பிணைப்பு
உங்களுக்குத் தெரியுமா?
ஹைட்ரஜன் சார்ந்த முக்கியமான நிகழ்வுகள்
1670 - ராபர்ட் பாயில் உலோகங்களை அமிலங்களுடன் வினைபுரியச் செய்து தீப்பற்றும் வாயுவை உருவாக்கினார்.
1700 - நிக்கோலஸ் லெமரி சல்பியூரிக் அமிலம் / இரும்பு வினையில் வெளிவரும் வாயு காரத்தில் வெடிக்கும் தன்மையுடையதை நிரூப்பித்தார்.
1766 - ஹென்றி கேவென்டிஸ் ஜிங்க் உலோகம் ஹைட்ரோ குளோரிக் அமிலத்துடன் வினைபுரிந்து ஹைட்ரஜன் வாயு வெளிவருதலைக் கண்டறிந்து வாயுவை தனியே பிரித்தார்.
1780 - ஃபெலிஸ் ஃபன்டான நீர்வாயு மாற்று நிலையைக் கண்டறிந்தார்
1783 - ஆண்டனி லவாய்சியர் தனிமத்தை ஹைட்ரஜன் எனப் பெயரிட்டார். (கிரேக்க மொழியில் நீர் உருவாக்கி எனப்பொருள்)
1800 - வில்லியம் நிக்கல்சன் மற்றும் ஆண்டனி கார்லிசில் நீரினை மின்னாற் பகுத்து ஹைட்ரஜன் மற்றும் ஆக்ஸிஜன் ஆகச் சிதைவுறச் செய்தார்.
1801 - ஹம்ஃப்ரி டேவி எரிதல் மின்கலம் என்ற கருத்தைக் (concept) கண்டறிந்தார்.
1806 – ஃபிரான்காயிஸ் I. டி ரிவாஸ் ஹைட்ரஜன் மற்றும் ஆக்ஸிஜனைக் கொண்டு முதன் முதலில் உள் எரி எந்திரத்தை வடிவமைத்தார்.
1811 - ஹம்ஃப்ரி டேவி வாயு ஹைட்ரேட்டுகளைக் கண்டறிந்தார்.
1818 - J.L.தெனார்டு BaO2ல் இருந்து ஹைட்ரஜன் பெராக்சைடை உருவாவதை கண்டறிந்து தயாரித்தார்.
1834 - மைக்கேல் ஃபாரடே மின்னாற்பகுப்பு விதிகளை வெளியிட்டார்.
1866 - T. கிரஹாம் ஹைட்ரஜன் பெலேடியத்தால் உறிஞ்சப்படுவதைக் கண்டறிந்தார்.
1897 - பால் செபாடியர் ஹைட்ரஜன் ஏற்றத்தை செபாடியர் வினையில் பயன்படுத்தினார்.
1898 - ஜேம்ஸ் தீவார் ஹைட்ரஜனை திரவமாக்கினார்.
1909 - S. P. L. சாரன்சன் ஹைட்ரஜன் அயனிச் செறிவைக் குறிக்கும் PH அளவீட்டு முறையை அறிமுகப்படுத்தினார்.
1910 - ஃபிரிட்ஸ் ஹேபர், ஹேபர் முறைக்கு காப்புரிமைப் பெற்றார்.
1913 - நீல்ஸ் ஃபோர் ரிட்பெர்க் வாய்பாடு கொண்டும் ஹைட்ரஜன் நிறமாலை கொண்டும், குவாண்டம் நிலையில் ஹைட்ரஜனின் ஆர்பிட்டால்களில் உள்ள எலக்ட்ரானின் அமைவிடத்தை தெளிவுற விவரித்தார்.
1924 - R. மெக்கே – ஆர்த்தோ மற்றும் பாரா ஹைட்ரஜனைக் கண்டறிந்தார்.
1931 - ஹரால்டு C. யுரே டியூட்ரியத்தைக் கண்டறிந்தார்.
1932 - ஹரால்டு C. யுரே கனநீரைக் கண்டறிந்தார்.
1932 - L. P. ஹேமட் மிக வலிமையுள்ள அமிலங்களின் அமிலச் சார்பினை முன் மொழிந்தார்.
1934 - எர்ன்ஸ்ட் ரூதர்போர்டு, மார்க் ஒலிபண்ட் மற்றும் பால் ஹர்டெக் டிரிட்டியத்தைக் கண்டறிந்தார்.
1935 - யூஜின் விக்னர் மற்றும் H. B. ஹன்டிங்க்டன் உலோக ஹைட்ரஜனைக் கண்டறிந்தார்.
1947 - A. E. பின்ஹோல்ட், A. C. பாண்ட், H. I. ஷேலிங்ஷர் LiAIH4 -ஐக் கண்டறிந்தனர். மேலும் அதனை மிகச் சிறந்த ஒடுக்கும் வினைபொருளாக நிரூபித்தனர்.
1950 - V. பால்ஃட்டிங்ஸ் மற்றும் P. ஹர்டெக் முதன் முதலில் காற்றிலுள்ள டிரிட்யத்தைக் கண்டறிந்தனர்.
1967 - அஹிரா ஃபியுஜிஸ்மா ஒளியால் தூண்டப்பட்ட நீரின் சிதைவு நிகழ்வினைக் கண்டறிந்தார்.
1971 - அலெக்ஸாண்டர் I. கிளாஸ் மற்றும் போரிஸ் I. சென்டர் நிக்கல் ஹைட்ரஜன் மின்கலத்திற்கு காப்புரிமைப் பெற்றார். (patented)
1990 - சோலார் வாஸர்டோப் பேயர்ன் முதன் முதலில் சூரிய ஒளி கொண்டு ஹைட்ரஜன் தயாரிப்பு நிலையத்தைத் துவக்கினார்
2000 - பீட்டர் டோன்னிஸ் ஹைட்ரஜன் 0.15K-ல் மிக அதிபாயும் செயல் திறனைக் (Super fluidity) காட்டினார்.
உங்களுக்குத் தெரியுமா?
உலோக ஹைட்ரைடு (Hydrogen Sponge)
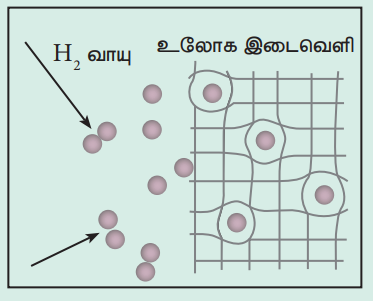
பெலேடியம் - ஹைட்ரஜன் அமைப்பு ஒரு நன்கு ஆய்ந்தறியப்பட்ட இருமை ஹைட்ரைடு ஆகும். ஹைட்ரஜன் ஆனது பெலேடியத்துடன் தனித்த ஒருமைத் தன்மையுடைய வழியில் இடைவினைப் புரிந்து ஒரு கட்டுப்படுத்தப்பட்ட மோனோ ஹைட்ரைடை (PdH) உருவாக்குகிறது. இதனை வெப்பப்படுத்தும்போது ஹைட்ரஜன் அணுக்கள் உலோகத்தின் வழியே விரவி, புறப்பரப்பினை அடைகின்றன மேலும் மீள இணைந்து மூலக்கூறு ஹைட்ரஜனை உருவாக்குகின்றன. வேறெந்த வாயுக்களும், பெலேடியத்துடன் இத்தகைய வழியில் இடைவினைப் புரியும் பண்பினை பெற்றிருப்பதில்லை. எனவே, இச்செயல்முறையானது ஹைட்ரஜன் வாயுவை பிறவாயுக்களிலிருந்து பிரித்தெடுக்கப் பயன்படுகிறது.
2 Pd (s) + H2 (g) → 2 PdH (s).
ஹைட்ரஜன் ஆனது பெலேடியத்தின் புறப்பரப்பில் எளிதில் பரப்பு கவரப்படுவதுடன் அங்கே அணுநிலை ஹைட்ரஜனாக பிரிகையுறுகின்றன. பிரிகையுற்ற அணுக்கள் படிக அணிக்கோவையின் இடைவெளிகளில் அல்லது வெற்றிடங்களில் (எண்முகி / நான்முகி) உட்புகுகின்றன.
நுட்பரீதியாக உலோக ஹைட்ரைடு உருவாதல் ஒரு வேதிவினையின் காரணமாக உருவாகிறது. ஆனால் இது இயற் சேமிப்பு முறை போன்று செயல்படுகிறது. அதாவது நீர் பஞ்சை (water sponge) போன்று இது உறிஞ்சுதல் மற்றும் வெளியிடுதலை நிகழ்த்துகிறது. இவ்வாறு உலோகங்கள் மற்றும் உலோகக் கலவைகளினால் ஹைட்ரஜனின் மீள் முறையில் ஏற்கப்படுதல் என்பது ஹைட்ரஜன் சேமிப்பு மற்றும் மீள்மின்னூட்டம் பெறச்செய்ய இயலும் உலோக ஹைட்ரைடு மின்கலன் ஆகியப் பயன்பாடுகளுக்கு ஏற்றதாக உள்ளது.
உங்களுக்குத் தெரியுமா?
ஹைட்ரஜன் - எதிர்கால எரிபொருள் (Future Fuel)
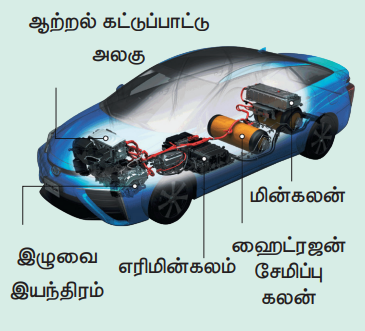
புவி வெப்பமடைதலின் விளைவுகள் மற்றும் குறைவான புதை படிம எரிபொருள் கையிருப்பானது புதிய மாற்று எரிபொருள்களுக்கானத் தேடலை நோக்கி உலகின் பார்வையினைத் திருப்பியுள்ளது. இந்த மாற்று எரிபொருளுக்கு ஹைட்ரஜன் ஒரு முக்கியமான பொருளாக உள்ளது ஏனெனில் ஹைட்ரஜனை எரிக்கும் போது முழுவதுமாக எரிகின்றது மேலும் சுற்றுச்சூழல் மாசுபடுத்திகள் ஏதும் உருவாவதில்லை எனவே ஹைட்ரஜனை நேரடியாக எரிபொருளாகப் பயன்படுத்தலாம். மேலும் நடைமுறையில் உள்ள கேசோலின் (பெட்ரோல்) / டீசல் / மண்ணெண்ணெய் மூலம் இயங்கும் இயந்திரங்களை மாற்றியமைக்க முடியும் அல்லது இதனை ஆக்சிஜனுடன் எரிமின்கலன்களில் (fuel cells) மறைமுகமாக பயன்படுத்தி மின்னாற்றலை உற்பத்தி செய்ய முடியும். ஆனால் இப்பயன்பாட்டில் வரக்கூடிய சில சிக்கல்களை நாம் சரிசெய்ய வேண்டும். இதனை உருவாக்கும் செலவு அதிகமாக உள்ளது. மேலும் அதிக புதைவடிவ எரிபொருட்களைப் பயன்படுத்தும் தேவை உள்ளது. இது இயற்கையில் கிடைக்கும்போது எளிதில் ஆவியடையக் கூடியதாகவும் மற்றும் தீப்பற்றி எரியும் தன்மையும் கொண்டுள்ளதால் இதன் சேகரிப்பும் ஓரிடத்திலிருந்து மற்றொரு இடத்திற்கு எடுத்துச்செல்வதும் கடினமானதாகும். மிகச் சிறிய மூலக் கூறாகவும் இருப்பதால் எளிதில் கசியும் (கசிவடையும்) பண்பினையும் கொண்டுள்ளது.