11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
அணு மாதிரிகளைப் பற்றிய அறிமுகம்
அலகு 2
அணுவின் குவாண்டம் இயக்கவியல் மாதிரி


எர்வின் ஷ்ரோடிங்கர் (1887-1961)
அணு பற்றிய புதிய பயன் தரும் கொள்கையை உருவாக்கியமைக்காக, 1933 ஆம் ஆண்டின் இயற்பியலுக்கான நோபல்பரிசு எர்வின் ஷ்ரோடிங்கருக்கு வழங்கப்பட்டது. இவர் கணிதம், இயற்பியல், வேதியியல், தாவரவியல் ஆகிய பாடங்களில் ஈடுபாடு கொண்டிருந்தார். குவாண்டம் கட்டுப்பாட்டின் அடிப்படையிலான போரின் ஆர்பிட் கொள்கையானது இவருக்கு திருப்தியளிப்பதாக இல்லை. அணுநிறமாலையானது ஐகன் மதிப்பு தீர்வு காண்பது போன்ற ஒரு செயலின் மூலம் தீர்மானிக்கப்பட வேண்டியது என இவர் நம்பினார். அதனடிப்படையில் ஒரு அலைச் சமன்பாட்டினை முன்மொழிந்தார். தற்போது அச்சமன்பாடு அவரது பெயரால் ஷ்ரோடிங்கர் அலைச்சமன்பாடு என அழைக்கப்படுகிறது.
கற்றலின் நோக்கங்கள்
இப்பாடப் பகுதியைக் கற்றறிந்த பின்னர்
• பல்வேறு அணுமாதிரிகளை மீட்டறிதல்
• பருப்பொருட்களின் ஈரியல்புத் தன்மையினை விளக்குதல்,
• டிபிராக்ளியின் சமன்பாட்டினை வருவித்தல் மற்றும் தொடர்புடைய எண்ணியல் கணக்குகளைத் தீர்த்தல்.
• ஹெய்சன்பர்க் நிச்சயமற்றதன்மை கோட்பாட்டை விளக்குதல் மற்றும் கணக்குகளை தீர்த்தல்.
• குவாண்டம் எண்களின் முக்கியத்துவத்தினை உணர்ந்து கொள்ளுதல்.
• குவாண்டம் இயக்கவியலின் அடிப்படையிலான அணுமாதிரியின் முக்கியக் கூறுகளைத் தொகுத்துரைத்தல்.
• பல்வேறு அணு ஆர்பிட்டால்களின் வடிவமைப்பினை வரைதல்.
• ஆஃபா தத்துவத்தினை விளக்குதல்
• ஹூண்ட்விதி மற்றும் பௌலி தவிர்க்கைத் தத்துவத்தினை விவரித்தல்.
• அணுக்களில் எலக்ட்ரான்கள் நிரப்பப்படுவதற்கு தொடர்புடைய விதிகளைப் பயன்படுத்துதல் மற்றும் பல்வேறு அணுக்களுக்கு எலக்ட்ரான் அமைப்பினை எழுதுதல்.
ஆகிய திறன்களை மாணவர்கள் பெற இயலும்.
அணு மாதிரிகளைப் பற்றிய அறிமுகம்
முந்தைய வகுப்புகளில் கற்றறிந்த, பல்வேறு அணுமாதிரி கோட்பாடுகளை நாம் நினைவுகூர்வோம். அனைத்துப்பொருட்களும் பருப்பொருளால் ஆக்கப்பட்டுள்ளன என்பதனை நாம் அறிவோம். அனைத்து பருப்பொருட்களுக்கும் அடிப்படை அலகாக இருப்பது அணுவாகும். கிரேக்கச் சொல்லான 'a-tomio' என்ற வார்த்தைக்கு பிரிக்க முடியாது என்பது பொருள். இவ்வார்த்தையிலிருந்து அணு (atom) என்ற சொல் உருவானது. அணுத்துகள்களான புரோட்டான், எலக்ட்ரான் மற்றும் நியூட்ரான் ஆகியவை கண்டறியப்படும் வரை அணுவானது மேலும் பிரிக்க முடியாத துகள் என கருதப்பட்டு வந்தது. J.J தாம்சனின் கேதோடுகதிர் சோதனை மூலம் அணுவில் எதிர்மின் தன்மையுடைய எலக்ட்ரான் உள்ளது எனக் கண்டறியப்பட்டது. அணுவானது நேர்மின்சுமையுடைய கோளம் போன்ற அமைப்பில் உள்ளது எனவும், அக்கோளத்தில் எதிர்மின்சுமையுடைய எலக்ட்ரான்கள், தர்பூசணியில் விதைகள் பொதிந்திருப்பதைப் போல, பொதித்து வைக்கப்பட்டுள்ளது என J.J.தாம்சன் தனது அணுமாதிரியினை முன்மொழிந்தார். பின்னாளில், ரூதர்ஃபோர்டின் α- கதிர் சிதறல் ஆய்வின் முடிவுகள் தாம்சனின் அணு மாதிரி தவறானது என நிரூபித்தது.
ரூதர்போர்டு ஒரு மெல்லிய தங்கத் தகட்டின் மீது α - கதிர்களை விழுமாறுச் செய்தார்.
இச்சோதனையில்
i) பெரும்பாலான α - கதிர்கள் தங்கத் தகட்டின் வழியே ஊடுருவி சென்றன.
ii) சில α - கதிர்கள் சிறிய கோணத்தில் விலகல் அடைந்தன
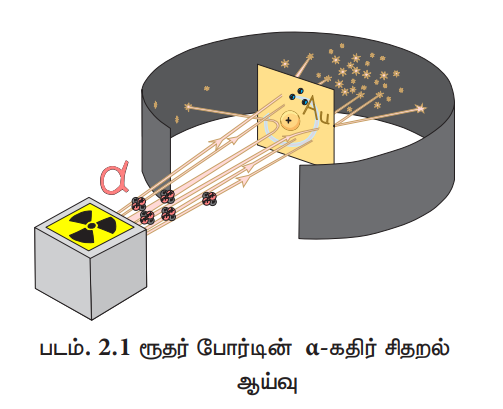
iii) மிகச் சில α - கதிர்கள் 180° கோணத்தில் மீள் விலகலடைந்தன.
மேற்கண்டுள்ள இச்சோதனையின் உற்றுநோக்கலின் அடிப்படையில், ரூதர்போர்டு பின்வரும் அணுமாதிரியினை முன்மொழிந்தார். அணுவானது ஒரு மிகச்சிறிய நேர்மின் தன்மையுடைய அணுக்கருவினைக் கொண்டுள்ளது, இந்த அணுக்கருவினைச் சுற்றி எலக்ட்ரான்கள் அதிகவேகத்தில் சுற்றி வருகின்றன.
மின்காந்த அலைக்கோட்பாட்டின் அடிப்படையில், இயங்கும் மின்சுமையுடைய துகளானது தொடர்ச்சியாக ஆற்றலை இழந்து இறுதியில் அணுக்கருவுடன் மோதவேண்டும். இதன் விளைவாக அணுவானது அழியும் நிலைக்கு உட்படும். ஆனால் நடைமுறையில் இவ்வாறு நிகழாமல், அணுக்கள் நிலைப்புத்தன்மை பெற்று விளங்குகின்றன. மேலும் அணுக்கருவினைச் சுற்றி எலக்ட்ரான்கள் எவ்வாறு விரவியுள்ளது என்பதனையும் எலக்ட்ரானின் ஆற்றலையும் இம்மாதிரி விளக்கவில்லை.
1. போர் அணுமாதிரி:
பிளாங்க் மற்றும் ஐன்ஸ்டீனின் ஆய்வுகளின் மூலம் மின்காந்த அலையின் ஆற்றலானது hv என்ற அலகில் வரையறுக்கப்பட்ட மதிப்புகளை மட்டும் கொண்டுள்ளது என கண்டறியப்பட்டது. (இங்கு v என்பது கதிர்வீச்சின் அதிர்வெண், h என்பது பிளாங் மாறிலி. இதன் மதிப்பு 6.626 × 10-34 Js) பிளாங்கின் குவாண்டம் கருதுகோளினை அணுக்களின் ஆற்றலுக்கு விரிவுபடுத்தி நீல்ஸ்போர் ஹைட்ரஜன் அணுவிற்கான ஒரு புதிய அணு மாதிரியினை முன்மொழிந்தார். இந்த அணு மாதிரி பின்வரும் கருது கோள்களின் அடிப்படையில் அமைந்தது.
1. எலக்ட்ரானின் ஆற்றல் வரையறுக்கப்பட்ட மதிப்புகளைப் பெற்றிருக்கும்.
2. எலக்ட்ரான்கள் அணுக்கருவினைச் சுற்றி சில குறிப்பிட்ட ஆற்றலுடைய ஆர்பிட் எனும் வட்டப்பாதையில் மட்டும் சுற்றி வருகின்றன. இவ்வட்டப்பாதைகள் நிலை வட்டப்பாதைகள் (Stationary orbits) என அழைக்கப்படுகின்றன.
3. ஒரு குறிப்பிட்ட வட்டப்பாதையில் சுற்றி வரும் எலக்ட்ரானின் கோண உந்தமதிப்பு (mvr) ஆனது, h/2π ன் முழு எண் மடங்காக இருக்கும் அதாவது
mvr = nh / 2π ----------- (2.1)
இங்கு n = 1, 2, 3 . . . . முதலியன
4. எலக்ட்ரானானது ஒரு குறிப்பிட்ட நிலை வட்டப் பாதையில் சுற்றி வரும் வரையில் அதன் ஆற்றலை இழப்பதில்லை. ஆனால், ஒரு எலக்ட்ரான் உயர் ஆற்றலுடைய (E2) வட்டப் பாதையிலிருந்து, தாழ்ந்த ஆற்றலுடைய (E1) வட்டப் பாதைக்குத் தாவும் போது, அதிகப்படியான ஆற்றல் கதிர் வீச்சாக வெளியிடப்படுகிறது. வெளியிடப்பட்ட கதிர்வீச்சின் அதிர்வெண்
E2 - E1 = hv
மற்றும்
v = (E2 – E1) / h ---------- (2.2)
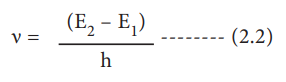
மாறாக, தகுந்த ஆற்றல் ஒரு எலக்ட்ரானுக்குத் தரப்படும் போது, அது தாழ்ந்த ஆற்றலுடைய வட்டப் பாதையிலிருந்து, அதிக ஆற்றலுடைய வட்டப் பாதைக்குத் தாவுகின்றது. ஹைட்ரஜன் மற்றும் ஹைட்ரஜனை ஒத்த (ஒரு எலக்ட்ரானைக் கொண்ட H, He+ மற்றும் Li2+ போன்றவை) அணுக்களுக்கு போர் கருதுகோளை பயன்படுத்தி, 'n' ஆவது வட்டப் பாதையில் சுற்றி வரும் எலக்ட்ரானின் ஆற்றல் மற்றும் அவ்வட்டப்பாதையின் ஆரம் ஆகியவற்றை வருவித்ததன் முடிவுகள் பின்வருமாறு
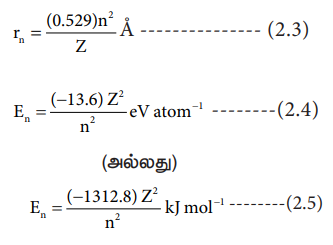
rn மற்றும் En மதிப்புகளை வருவிக்கும் முறையினை, 12ஆம் வகுப்பில் அணு இயற்பியல் பாடத்தில் விரிவாக கற்கலாம்.
2. போர் அணு மாதிரியின் வரம்புகள்
(i) ஹைட்ரஜன், Li2+ போன்ற ஒற்றை எலக்ட்ரான்களைக் கொண்ட இனங்களுக்கு மட்டுமே இக்கொள்கையினைப் பயன்படுத்த இயலும் பல எலக்ட்ரான்களைக் கொண்ட அணுக்களுக்கு இக்கொள்கையினைப் பயன்படுத்த இயலாது.
காந்தப்புலத்தில் நிறமாலைக் கோடுகள் பிரிகையடைதல் (சீமன் விளைவு) மற்றும் மின்புலத்தில் நிறமாலைக்கோடுகள் பிரிகையடைதல் (ஸ்டார்க் விளைவு) ஆகியவற்றை இக்கொள்கை விளக்கவில்லை.
அணுக்கருவினைச் சுற்றி எலக்ட்ரான்கள் அவற்றின் கோண உந்தத்தின் (mvr) மதிப்பு nh/2π க்கு சமமாக இருக்குமாறு உள்ள சில குறிப்பிட்ட வட்டப்பாதைகளில் மட்டுமே சுழல்வதற்கு அடிப்படையாக அமையும் காரணத்தினை போர் கொள்கையால் விளக்க இயலவில்லை. லூயிஸ் டீபிராக்ளி என்பவர் இதற்கான தர்க்கரீதியான விளக்கத்தினை அளித்தார்.