10வது அறிவியல் : அலகு 8 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
நவீன ஆவர்த்தன அட்டவணை
நவீன ஆவர்த்தன
அட்டவணை
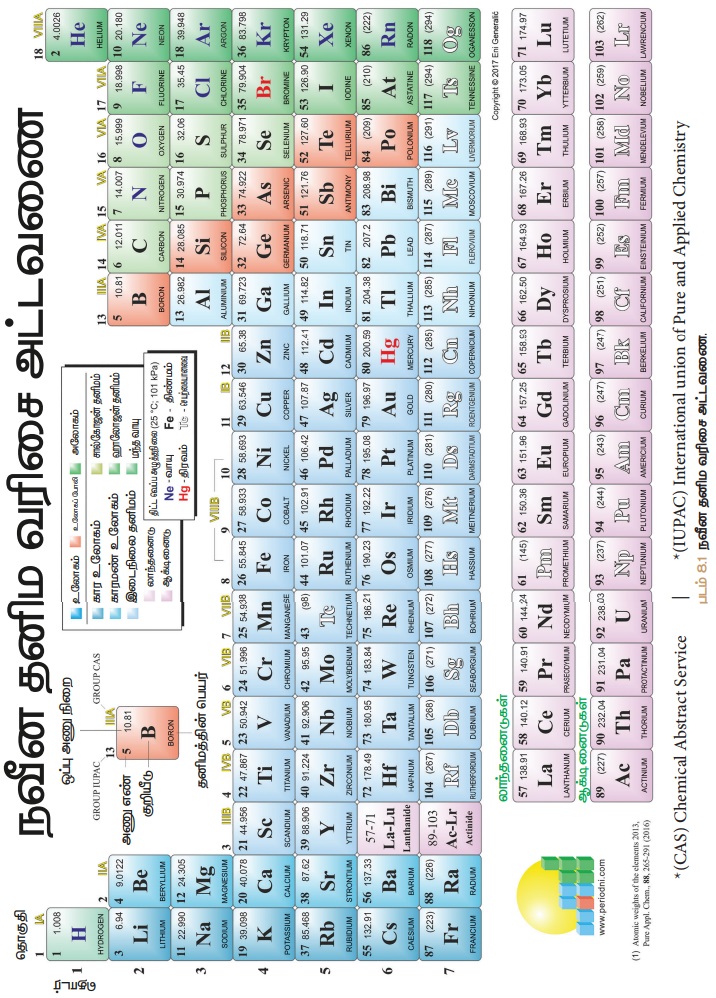
நவீன ஆவர்த்தன விதியின் படி, தனிமங்கள், அணு எண் அதிகரிப்பிற்கு ஏற்றாற்போல் நவீன அட்டவணையில்
வரிசைப்படுத்தப்பட்டுள்ளன. வேதியியல் தனிமங்கள், தங்கள்
பண்புகளை முறையே உணர்த்தும் வகையில், தொடர்களாகவும், தொகுதிகளாகவும், நவீன ஆவர்த்தன அட்டவணையில்
வரிசைப்படுத்தப்பட்டுள்ளன. படம் 8.1 ஆனது 118 தனிமங்கள் கொண்ட நவீன ஆவர்த்தன
அட்டவணையைக் காட்டுகின்றது.
கடந்த ஒன்பதாம் வகுப்பில் கற்ற
ஆவர்த்தன அட்டவணையின் சிறப்பம்சங்களின் தொடர்ச்சியாக, தொகுதி மற்றும்
தொடர்களின் சிறப்பம்சங்களை அறிய விழைவோம்.
1. தொடர்களின் சிறப்பம்சங்கள்
• தனிமங்களின் கிடைமட்ட வரிசைகள்
தொடர்களாகும். ஆவர்த்தன அட்டவணையில் மொத்தம் 7 தொடர்கள் உள்ளன.
• முதலாம் தொடர் (அணு எண் 1 மற்றும் 2) இத்தொடர் மிகச்சிறிய
தொடராகும். இதில் ஹைட்ரஜன் மற்றும் ஹீலியம் எனும் 2
தனிமங்களே உள்ளன.
• இரண்டாம் தொடர் (அணு எண் 3 லிருந்து 10 வரை) இது சிறிய தொடராகும். இதில் ‘Li’ யிலிருந்து ‘Ne’ வரை 8 தனிமங்கள் உள்ளன.
• மூன்றாம்
தொடர்
இதுவும் ஒரு சிறிய தொடராகும். (அணு எண் 11 லிருந்து 18 வரை) இதில் 'Na’
யிலிருந்து ‘Ar’ வரை 8
தனிமங்கள் உள்ளன.
• நான்காம்
தொடர் (அணு எண் 19 லிருந்து 36 வரை) இது ஒரு நீண்ட தொடராகும். இதில்
"K" யிலிருந்து,
“Kr” வரை, 18 தனிமங்கள் உள்ளன. இவற்றில் 8 பிரதிநிதித்துவ தனிமங்களும், 10 இடைநிலைத்
தனிமங்களும் உள்ளன.
• ஐந்தாம் தொடர்
(அணு எண் 37 லிருந்து, 54 வரை) இதுவும் ஒரு நீண்ட தொடராகும்.
இதில் Rb யிலிருந்து Xe
வரை 18 தனிமங்கள் உள்ளன. இவற்றில் 8 பிரதிநிதித்துவ தனிமங்களும், 10 இடைநிலைத்
தனிமங்களும் உள்ளன.
• ஆறாம் தொடர் (அணு எண் 55 லிருந்து 86 வரை) இது மிக நீண்ட தொடராகும். இதில் ‘Cs’ லிருந்து, ‘Rn’ வரை
32 தனிமங்கள் உள்ளன. இவற்றுள் 8
பிரதிநிதித்துவ தனிமங்கள், 10 இடைநிலைத் தனிமங்கள் மற்றும் 14 உள் இடைநிலைத் தனிமங்கள் (லாந்தனைடுகள்) என ஆகும்.
• ஏழாம் தொடர் (அணு எண் 87 லிருந்து,
118 வரை) ஆறாம் தொடரைப் போல, இதுவும் 32 தனிமங்கள்
கொண்டது. சமீபத்தில், நான்கு தனிமங்கள் அட்டவணையில் IUPAC
ஆல் உட்படுத்தப்பட்டன.
2. தொகுதிகளின் சிறப்பம்சங்கள்
• ஆவர்த்தன அட்டவணையில் மேலிருந்து
கீழாக வரிசைப்படுத்தப்பட்ட தனிமங்கள், தொகுதிகள் எனப்படும். அட்டவணையில் மொத்தம் 18 தொகுதிகள் உள்ளன.
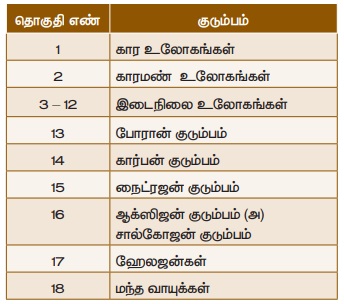
• தனிமங்களின் பொதுவான
சிறப்பியல்புகளை வைத்து வெவ்வேறு குடும்பங்களாகத் தொகுக்கப்பட்டுள்ளன.
• தொகுதி 3ன் அங்கமாகத்
திகழும், லாந்தனைடு மற்றும் ஆக்டிணைடுகள் உள் இடைநிலைத்
தனிமங்கள் என அழைக்கப்படும்.
• 18வது தொகுதியைத் தவிர, மற்ற
தொகுதிகளில் உள்ள தனிமங்களின் வெளிக்கூட்டில், ஒத்த
எண்ணிக்கை உள்ள எலக்ட்ரான்களும், ஒத்த இணைதிறனும்
பெற்றிருக்கும். எடுத்துக்காட்டாக, தொகுதி 1 ல் உள்ள தனிமங்கள் வெளி ஆற்றல் மட்டத்தில் ஒரு எலக்ட்ரான் மட்டும் 1S1
பெற்றிருப்பதால், கார உலோகத் தனிமங்களின்
இணைதிறன் 1 ஆகும்.
• ஒத்த தொகுதியில் உள்ள தனிமங்கள்
ஒத்த எலக்ட்ரான் அமைப்புகளைப் பெற்று, ஒத்த வேதிப்பண்புகளோடு திகழும்.
• இயல் பண்புகளான, உருகுநிலை, கொதிநிலை மற்றும் அடர்த்தி ஆகியன சீராக மாறுபடும்.
• 18வது தொகுதித் தனிமங்கள், நிலையான எலக்ட்ரான் அமைப்பை வெளிக்கூட்டில் பெற்றிருப்பதால், வினையுறா தன்மையைப் பெற்றிருக்கும்.