10வது அறிவியல் : அலகு 8 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
உலோக அரிமானம்
உலோக அரிமானம்
வேதிவினைகள் அல்லது மின் வேதி
வினைகள் மூலம் சுற்றுச் சூழலோடு வினைபுரிந்து படிப்படியாக நடக்கும் உலோகத்தின்
சிதைவே, உலோக அரிமானம்
ஆகும். இது ஒரு இயற்கை நிகழ்வு. இதில் உலோகமானது, ஆக்சைடு,
ஹைட்ராக்சைடு அல்லது சல்பைடாக மாறி தன் உலோகத் தன்மையை இழக்கிறது.
துரு
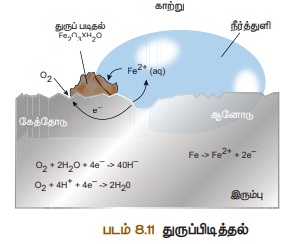
துரு என்பது நீரேறிய ஃபெரிக்
ஆக்சைடு Fe2O3.xH2O
என வேதியியல் முறையில்
அழைக்கப்படும். துருப்பிடித்தல் ஆனது, இரும்பின் புறப்பரப்பில், செம்பழுப்பு
நிற நீரேறிய ஃபெரிக் ஆக்சைடை உருவாக்குகின்றது.
1. உலோக அரிமானத்தின் வகைகள்
1. உலர் அரிமானம்
(அல்லது) வேதிமுறை அரிமானம்
ஈரப்பதம் இல்லா நிலையில், நடைபெறும் அரிமானச்
செயல் உலர் அரிமானம் ஆகும். இந்நிகழ்வில் அரிக்கும் திரவங்கள் அல்லது வாயுக்களான O2,
N2, SO2, H2S ஆகியவை அதிக
வெப்பநிலையில் உலோகத்தின் மேல் வேதிவினைபுரிந்து மாற்றம் நடைபெறுகின்றது. இவை
அனைத்திலும் O2 வானது வேதியியல் முறைப்படி அதிக
அளவில் வினைபுரியும் வாயுவாக செயல்படுகிறது.
2. ஈரநிலை அரிமானம்
(அல்லது) மின்வேதியியல் நிலை அரிமானம்
ஈரப்பதத்தால் நடைபெறும் அரிமான
நிகழ்வு, ஈரநிலை அரிமானம்
ஆகும். உலோகமானது, நீருடன் அல்லது உப்புக்கரைசலுடன் அல்லது
அமில, காரங்களுடன் மின் வேதிவினை புரிந்து அரிமானத்தை
உருவாக்கும்.
2. அரிமானத்தைத் தடுக்கும் முறைகள்
1. உலோகக்
கலவையாக்கல்
உலோகங்களை ஒன்றோடொன்று கலந்து
கலவையாக்கள் மூலம், அரிமானத்தை தடுக்கலாம். எ.கா துருப்பிடிக்காத இரும்பு.
2. புறப்பரப்பை
பூசுதல்
உலோகத்தின் மீது பாதுகாப்புக் கலவை
பூசுதல் அரிமானத்தை தடுக்கும். இதன் வகைகளாவன
அ. நாகமுலாம் பூசுதல்: இரும்பின் மீது துத்தநாக மின் முலாம் பூசுவதற்கு நாகமுலாம்
பூசுதல் என்று பெயர்.
ஆ. மின்முலாம் பூசுதல் : ஒரு உலோகத்தை மற்றொரு உலோகத்தின் மேல், மினசாரத்தின் மூலம்
பூசுதல் மின்முலாம் பூசுதல் ஆகும்.
இ. ஆனோட்டாக்கல்: உலோகத்தின் புறப்பரப்பை, மின் வேதிவினைகளின் மூலம், அரிமான
எதிர்புள்ளதாய் மாற்றும் நிகழ்வு ஆனோடாக்கல் ஆகும். அலுமினியம் இந்த முறைக்கு
பயன்படுகிறது.
ஈ. கேத்தோடு பாதுகாப்பு: எளிதில் அரிமானம் அடையும் உலோகத்தை ஆனோடாகவும், பாதுகாக்க வேண்டிய
உலோகத்தைக் கேத்தோடாகவும் கொண்டு, மின் வேதி வினைக்கு
உட்படுத்தும் நிகழ்வு கேத்தோடு பாதுகாத்தல் ஆகும். இவ்வினையில் எளிதில் அரிபடும்
உலோகம் தியாக உலோகம் எனப்படும்.