10வது அறிவியல் : அலகு 8 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
ஆவர்த்தன பண்புகளில் ஏற்படும் நிகழ்வுகள்
ஆவர்த்தன
பண்புகளில் ஏற்படும் நிகழ்வுகள்
தனிமங்களின் எலக்ட்ரான் அமைப்பு, சீராக நிகழும் இயல்
மற்றும் வேதியியல் பண்புகளை விளக்க உதவுகின்றன. தனிம வரிசை அட்டவணையில் உள்ள
தனிமங்களின் பண்புகள், குறிப்பிட்ட சீரான இடைவெளிக்குப்
பிறகு மீண்டும் ஒரே மாதிரியிருக்கும் நிகழ்வு ஆவர்த்தன பண்பு எனப்படும்.
பண்புகளான, அணு ஆரம், அயனி ஆரம், அயனியாக்கும் ஆற்றல், எலக்ட்ரான், கவர்தன்மை, எலக்ட்ரான்
நாட்டம் ஆகியன ஆவர்த்தனத் பண்பை காட்டுகின்றன. நவீன அட்டவணையானது தனி மங்களின்
பொதுப்பண்புகளையும், தொகுதி மற்றும் தொடர்களில் ஏற்படும்
தனிமங்களின் சீரான மாற்றங்களையும் அறிமுகமாகாத தனிமங்களுக்கும் மிகத் தெளிவாகத்
தருகின்றது. இப்பகுதியில் பின்வரும் ஆவர்த்தன பண்புகளைப் பற்றி அறியலாம்.
1. அணு ஆரம்
ஒரு அணுவின் ஆரம் என்பது அதன்
அணுக்கருவின் மையத்திற்கும்,
இணைதிற எலக்ட்ரான் உள்ள வெளிக்கூட்டிற்கும் இடையேயான தூரம் என
வரையறுக்கப்படும். ஒரு தனித்த அணுவின் ஆரத்தை , நேரடியாக
அளவிட முடியாது. மந்த வாயுக்கள் தவிர, வழக்கமாக அணு ஆரம்
என்பது தொடர்புடைய அணுக்களுக்ககிடையே உள்ள பிணைப்பின் தன்மையை பொறுத்து, சகப்பிணைப்பு ஆரம் அல்லது உலோக ஆரம்
என்றழைக்கப்படும். அருகருகே உள்ள இரண்டு உலோக அணுக்களின் உட்கருக்களுக்கு இடையே
உள்ள தூரத்தின் பாதியே உலோக ஆரம் எனப்படும். படம் 8.2
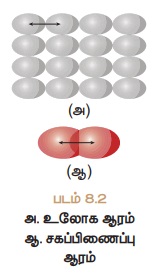
அ) உலோகமற்ற தனிமங்களில், உள்ள அணு ஆரம் சகப்பிணைப்பு
ஆரம் என்றழைக்கப்படும். ஒற்றை சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள இரண்டு ஒத்த
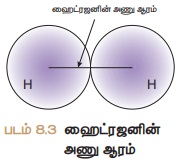
அணுக்களின் அணுக்கருக்களுக்கு ஆன தொலைவின் பாதியளவு சகப்பிணைப்பு ஆரம் எனப்படும். எடுத்துக்காட்டாக, H2 மூலக்கூறில்,
இரண்டு ஹைட்ரஜன் அணுக்கருகளுக்கு இடையில் உள்ள தூரம் 0.74A°.
இதன் சகப்பிணைப்பு ஆரமானது. 0.74/2 = 0.37A° என்று
கணக்கிடலாம்
தனிம வரிசை அட்டவணையில் உள்ள
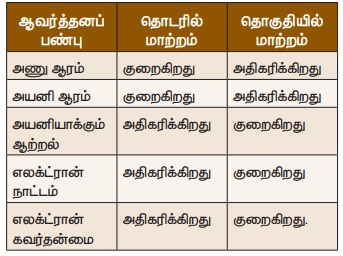
தனிமங்களின் அணு ஆரங்களைப் பார்க்கும் போது, இருவேறு நிகழ்வுகள் தெளிவாகும். தொடரில், இடது புறத்திலிருந்து வலது புறமாக செல்கையில், தனிமங்களின்
அணு ஆரங்கள் குறையும். ஆனால் தொகுதியில் மேலிருந்து கீழாக இறங்கும்போது அணு
ஆரங்கள் அதிகரிக்கும். இதன் காரணத்தை கீழ்க்கண்டவாறு அறியலாம். தொகுதியில்
மேலிருந்து கீழாக இறங்கும்போது, வெளிக்கூடு எண் அதிகரிக்கும்
இதனால், வெளிக்கூட்டிற்கும் ஆற்றல் மட்டத்திற்கும்
அணுக்கருவிற்கும் இடைப்பட்ட தூரம் அதிகரித்து கவர்ச்சி விசை குறைந்து, உருவளவு பெரிதாகக் காணப்படும்.
மாறாக தொடரில் இடது புறத்திலிருந்து
வலது புறமாக செல்கையில், ஆற்றல் மட்டம் மாறுவதில்லை. ஆனால் புரோட்டானின் எண்ணிக்கை அதிகரித்து
செல்லும். அதிகரிக்கும் நேர்மின் சுமைக்கு ஏற்ப எலக்ட்ரான்கள் மீதுள்ள கவர்ச்சி
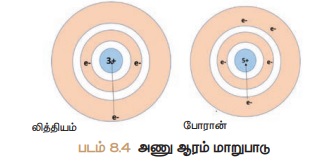
விசை அதிகரிப்பதால் அணுவின் உருவஅளவு குறைகிறது. அணு ஆரமானது லித்தியத்திலிருந்து
போரானுக்கு செல்லும் போது எவ்வாறு குறைகிறது என்பதை படம் 8.4
காட்டுகின்றது
2. அயனி ஆரம்
ஒரு அயனியின் கருமையத்திற்கும், அவ்வயனியின்
எலக்ட்ரான் திரள் முகில் மீது அதன் கருவால் கவர்ச்சி விசை செலுத்த இயலும்
தூரத்திற்கும் இடையேயான தொலைவு அயனி ஆரம் என வரையறுக்கப்படும் ஒரு அணுவானது
எலக்ட்ரான்களை இழந்தோ, ஏற்றோ அயனியாக மாறும். எலக்ட்ரான்
இழக்கும் அணு, நேர்மின் சுமை பெற்று, நேர்மின்
அயனி என்றழைக்கப்படும் எலக்ட்ரானை ஏற்கும் ‘அணு, எதிர் மின்சுமை பெற்று, எதிர்மின் அயனி
என்றழைக்கப்படும். கரைசல்களின் இயல்புகளையும், அயனித்திண்மங்களின்
வடிவமைப்புகளையும், தீர்மானிக்க, அயனிகளின்
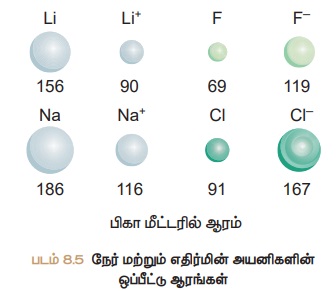
உருவளவு முக்கியமாகும். நேர்மின் அயனியானது அதன் தொடர்புடைய அணுவைவிட உருவளவில்
சிறிதாகவும், எதிர்மின் அயனியானது அதன் தொடர்புடைய அணுவைவிட
உருவளவில் பெரிதாகவும் காணப்படும்.
குறிப்பு
• நேர்மின் சுமை அதிகரிக்கும் போது
நேர்மின் அயனியின் உருவளவு குறையும்.
• எதிர் மின்சுமை அதிகரிக்கும் போது எதிர்மின் அயனியின் உருவளவு அதிகரிக்கும்.
உதாரணமாக லித்தியம் மற்றும் சோடியம்
தங்களது வெளி ஆற்றல் மட்டத்தில் உள்ள ஓர் எலக்ட்ரானை இழந்து நேர்மின்
அயனிகளாகின்றன. இவ்வயனிகள், தம் தொடர்புடைய அணுக்களைவிட உருவில் சிறிதாக இருக்கக் காரணம், உட்கருவிற்கும், மீதமுள்ள உள் ஆற்றல் மட்ட
எலக்ட்ரான்களுக்கும் இடையே உள்ள அதிக கவர்ச்சி விசையே காரணம் ஆகும். ப்ளூரின்
மற்றும் குளோரின் தங்களது வெளிக்கூட்டில் ஒரு எலக்ட்ரானை ஏற்று எதிர்மின்
சுமையுடைய அயனிகளாகின்றன. உட்கருவானது எதிர்மின் சுமையுடைய அயனிகளில் உள்ள
வெளிக்கூட்டு எலக்ட்ரான்களில் காட்டும் ஈர்ப்பு விசையானது அதே தனிமத்தின் நடுநிலை
அணுவில் காட்டுவதை விட குறைவு. ஆகவே அணு ஆரத்தில் கண்டது போல, அயனி ஆரங்களும் தொடரில் இடப்புறத்திலிருந்து வலப்புறமாக குறைந்தும்,
தொகுதியில், மேலிருந்து கீழாக அதிகரித்தும்
காணப்படும்.
3. அயனியாக்கும் ஆற்றல்
அடி ஆற்றல் நிலையில் (ground state) உள்ள
நடுநிலைத் தன்மை உடைய தனித்த வாயு நிலை அணு ஒன்றின் இணைதிறன் கூட்டிலிருந்து
இலகுவாகப் பிணைக்கப்பட்டுள்ள ஒரு எலக்ட்ரானை நீக்கி நேர்மின் அயனியாக மாற்றுவதற்கு
தேவைப்படும் குறைந்த பட்ச ஆற்றல், அயனியாக்கும் ஆற்றல்
எனப்படும். இதை அயனியாக்கும் என்தால்பி என்றும் அழைக்கலாம். இதன் அலகு KJ/mol.
அயனியாக்கும் ஆற்றல் அதிகரிக்கும் போது, எலக்ட்ரானை
நீக்குவது கடினமாகின்றது.
தொடரில் அணு ஆரம் இடது
புறத்திலிருந்து வலது புறமாக செல்கையில் குறைவதால், எலக்ட்ரானை நீக்க, அதிக
ஆற்றல் தேவைப்படும். ஆகவே, தொடரில், இடது
புறத்திலிருந்து வலது புறம் செல்கையில், அயனி ஆக்கும் ஆற்றல்
அதிகரிக்கின்றது. ஆனால் தொகுதியில் மேலிருந்து கீழாக இறங்குகையில், அணுவின் உருவளவு அதிகரிப்பதாலும், இணைதிற
எலக்ட்ரான்கள் இலகுவாக பிணைக்கப் பட்டிருப்பதாலும், அயனியாக்கும்
ஆற்றல் மிகச் சிறிதளவே தேவைப்படும். ஆகவே, தொகுதியில்
மேலிருந்து கீழிறங்குகையில் அயனியாக்கும் ஆற்றல் குறையும் தன்மை பெற்றிருக்கும்.
4. எலக்ட்ரான் நாட்டம்
ஒரு தனித்த நடுநிலை உடைய வாயுநிலை
அணு ஒன்றின் இணைதிறன் கூட்டில்,
ஒரு எலக்ட்ரானை சேர்த்து, அதன் எதிர் மின்
சுமையுடைய அயனியை உருவாக்கும் போது வெளிப்படும் ஆற்றல் எலக்ட்ரான் நாட்டம்
எனப்படும். அயனியாக்கும் ஆற்றலைப் போல, எலக்ட்ரான் நாட்டமும்
தொடரில் இடப்புறத்திலிருந்து, வலப்புறமாக அதிகரித்தும்,
தொகுதியில் மேலிருந்து கீழாக குறைந்தும் காணப்படும்.
இதன் அலகு KJ/mol ஆகும்.
A(g) + e– → A–(g) +
ஆற்றல்
Cl(g) + e– → Cl–(g) +
ஆற்றல்
மேலும் அறிந்து கொள்க
மந்த
வாயுக்கள் எலக்ட்ரான்களை ஏற்கும் தன்மையற்றவை. ஏனெனில், அவற்றின் வெளிமட்டத்தில் உள்ள S மற்றும் p ஆர்பிட்டால்கள் முழுமையாக எலக்ட்ரான்களால் நிரம்பி உள்ளவை. அதனால் மேலும்
ஒரு எலக்ட்ரானை சேர்ப்பது இயலாது. எனவே இவற்றின் எலக்ட்ரான் நாட்டம் பூஜ்ஜிய
மதிப்பை பெறுகின்றன.
5. எலக்ட்ரான் கவர்தன்மை
சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள
மூலக்கூறில் உள்ள ஒரு அணுவானது,
சகப்பிணைப்பில் பங்கிடப்பட்டுள்ள எலக்ட்ரான் இணையினை தன்னை நோக்கி
கவரும் பண்பு, எலக்ட்ரான் கவர்திறன் எனப்படும். உதாரணமாக HCl
மூலக்கூறை எடுத்துக் கொள்வோம். ஹைட்ரஜன் மற்றும் குளோரின் அணுக்கள்
ஒரு எலக்ட்ரானை பங்கிட்டு சகப்பிணைப்பினை உருவாக்கும். குளோரின் அணுவிற்கு
எலக்ட்ரான் கவர்தன்மை அதிகம். அதனால், பங்கீட்டு
எலக்ட்ரான்களை ஹைட்ரஜன் விட, குளோரின் அணு தன்னை நோக்கி
இழுத்துக் கொள்ளும். பிணைப்பு உடையும்போது பிணை எலக்ட்ரான், குளோரினுடன்
சென்று H+ மற்றும் Cl- அயனிகள் உருவாகும். இதை கீழ்க்காணும் படங்களின் மூலம் அறியலாம்.
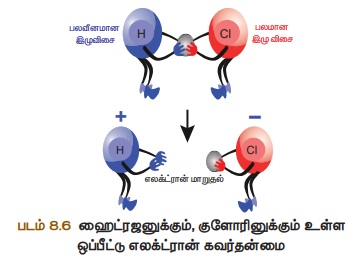
எலக்ட்ரான் கவர்தன்மையானது
கீழ்க்காணும் சோதனை முடிவுகளான,
பிணைப்பு ஆற்றல், அயனியாக்கும் ஆற்றல்,
எலக்ட்ரான் நாட்டம் ஆகியவற்றைச் சார்ந்து அமையும்.
எலக்ட்ரான் கவர்தன்மையை
கணக்கிடுவதில், பாலிங் அளவீடு பெரும் பங்களிக்கின்றது. இதன் மூலம், ஒர
மூலக்கூறின் அணுக்களுக்கு இடையில் உள்ள பிணைப்பின் தன்மையை (அயனிப்பிணைப்பு அல்லது
சகப்பிணைப்பு) அறியலாம்.
சில தனிமங்களின் கவர்தன்மையைக் கீழே
காண்க.
F = 4.0, Cl = 3.0, Br = 2.8, I = 2.5, H = 2.1, Na
= 1
இரு அணுக்களுக்கு
இடையே உள்ள எலக்ட்ரான் கவர்தன்மை வித்தியாசம் 17 என இருந்தால்,
அப்பிணைப்பு 50 % அயனித்தன்மையும், 50% சகப்பிணைப்புத் தன்மையையும் பெற்றிருக்கும்.
அவ்வித்தியாசம் 1.7 ஐ விட குறைவாயின் அப்பிணைப்பு அதிக சகப்பிணைப்பு தன்மையுடையது.
வித்தியாசமானது 1.7 ஐ விட அதிகமெனில் அப்பிணைப்பு அதிக அயனிப்பிணைப்பு தன்மையுடையது.
தொடரில், இடப்பக்கத்திலிருந்து
வலப்பக்கமாக செல்லும் போது எலக்ட்ரான் கவர்தன்மை அதிகரிக்கும். ஏனெனில் அணுக்கரு
மின்சுமை அதிகரிக்கும்போது, எலக்ட்ரான் கவர்ச்சி விசை
அதிகமாகும். தொகுதியில் மேலிருந்து கீழாக இறங்குகையில் எலக்ட்ரான் கவர்தன்மை
குறைகிறது. ஏனெனில், ஆற்றல் மட்டத்தின் எண்ணிக்கை அதிகமாகிறது.
சுயசோதனை
கீழ்க்காணும்
மூலக்கூறுகளில் உள்ள பிணைப்பின் தன்மையை கண்டறிக
(i) NaCl
(ii) NaBr (iii) Nal (iv) NaF (v) NaH