தாதுக்கள், இயற்பண்புகள், வேதிப்பண்புகள், பயன்கள் - அலுமினிய உலோகவியல் | 10th Science : Chapter 8 : Periodic Classification of Elements
10வது அறிவியல் : அலகு 8 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
அலுமினிய உலோகவியல்
அலுமினிய
உலோகவியல்
புவித்தோட்டில் மிகச் செறிந்து
காணப்படும் உலோகம் அலுமினியம் ஆகும். இதன் வினைபடும் திறன் அதிகம். அதனால் சேர்ந்த
நிலையில் இது காணப்படும். இதன் முக்கியத் தாதுக்கள் கீழ்க்கண்டவாறு எழுதலாம்.
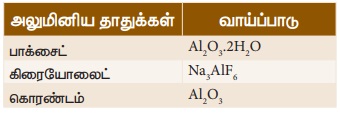
அலுமினியத்தின் முக்கியத் தாது
பாக்சைட் ஆகும். இத்தாதுவிலிருந்து அலுமினியம் பிரித்தெடுத்தல், 2 நிலைகளில்
நடைபெறுகின்றது.
1. பாக்சைட்டை
அலுமினாவாக மாற்றம் செய்தல் (பேயர் முறை)
பாக்சைட்டை அலுமினாவாக மாற்றுதல்
இரண்டு படிகளை உள்ளடக்கியது.
பாக்சைட் தாதுவினை, நன்கு தூளாக்கி,
எரி சோடாவுடன் 150°C வெப்பநிலையில், குறிப்பிட்ட அழுத்தத்தில் வினைப்படுத்தும் போது, சோடியம்
மெட்டா அலுமினேட் உருவாகிறது.
Al2O3 + 2
NaOH → 2 NaAIO2 + H2O
சோடியம் மெட்டா அலுமினேட்டை
நீரினால் நீர்க்கச் செய்வதால்,
அலுமினியம் ஹைட்ராக்சைடு வீழ்படிவு உருவாகிறது.
NaAIO2 + 2 H2O
→ AI(OH)3 + NaOH
இவ்வீழ்படிவை வடிகட்டி, நன்கு கழுவி பின் 1000°C
வெப்பநிலையில் உலர்த்திட, அலுமினா உருவாகிறது.
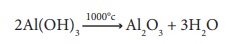
2. அலுமினாவை,
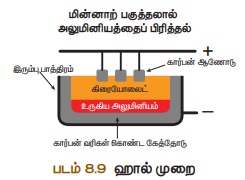
மின்னாற்பகுத்தல் மூலம் ஒடுக்கம் செய்தல் (ஹால் முறை)
மின்னாற்பகுப்பு கலனில் உருகிய
அலுமினாவை, மின்னாற் பகுப்பு முறையில் ஒடுக்கிட, அலுமினியம்
கிடைக்கிறது.
அலுமினியம் எதிர்மின்வாயிலும், ஆக்ஸிஜன்
நேர்மின்வாயிலும் வெளியாகிறது. வெளியாகும் ஆக்ஸிஜன், கிராபைட்டுடன்
சேர்ந்து CO2 வாக மாறுகிறது.
எதிர்மின்வாய்: கிராபைட் பூசப்பட்ட இரும்புத் தொட்டி
நேர்மின்வாய்: உருகிய மின்பகுளியில் தொங்கவிடப்பட்ட கிராபைட் துண்டுகள்
மின்பகுளி:
தூய அலுமினா + உருகிய கிரையோலைட் + ப்ளூர்ஸ்பார் (இது மின்படுளியின் உருக்கு
வெப்பநிலையைக் குறைக்கும்)
வெப்பநிலை : 900°C - 950°C
மின் அழுத்தம் : 5-6 V
ஒட்டு மொத்த
வினை : Al2O3 → 4 Al +3
O2↑
இயற்பண்புகள்
· இது வெள்ளியைப் போன்ற வெண்மையான உலோகம்
· இது லேசான, அடர்த்தி குறைந்த
உலோகம் (2.7)
· தகடாக அடிக்கலாம், கம்பியாக
நீட்டலாம்.
· இது வெப்பத்தையும், மின்சாரத்தையும்
நன்கு கடத்தும்.
· இதன் உருகுநிலை 660°C
· பளபளப்பான ஒளிரும் தோற்றம் கொண்டதாக மாற்ற இயலும்.
வேதிப்பண்புகள்
1. காற்றுடன் வினை: உலர்ந்த காற்றுடன் அலுமினியம் வினைபுரியாது. 800°C வெப்பநிலையில்
அலுமினியம் காற்றுடன் வினைபுரிந்து ஆக்சைடு மற்றும் நைட்ரைடுகளை உருவாக்கும்.
4 Al + 3 O2 → 2 Al2O3
(அலுமினியம் ஆக்சைடு)
2 Al + N2 → 2 AlN (அலுமினியம் நைட்ரைடு)
2. நீருடன் வினை: நீருடன் அலுமினியம் வினைபுரியாது. ஆனால் நீராவியுடன் செஞ்சூடேற்றிய அலுமினியம், வினைபுரிந்து அலுமினியம் ஆக்சைடுயும், ஹைட்ரஜனையும் உருவாக்குகிறது.
3. காரங்களுடன் வினை: காரங்களுடன் அலுமினியம் வினைபுரிந்து அலுமினேட்களை
உருவாக்குகிறது.
2 Al + 2 NaOH + 2 H2O → 2 NaAlO2 +
3 H2↑
4. அமிலங்களுடன் வினை: நீர்த்த மற்றும் அடர் HCI அமிலங்களுடன் அலுமினியம் வினைபுரிந்து H2
வாயுவை வெளியிடுகிறது.
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
அலுமினியம் குளோரைடு
அலுமினியம் நீர்த்த சல்ப்யூரிக்
அமிலத்துடன் ஹைட்ரஜன் வாயுவையும்,
அடர் சல்ப்யூரிக் அமிலத்துடன் சல்பர்-டை- ஆக்ஸைடு வாயுவையும்
வெளியிடுகிறது.

மேலும் அறிவோம்
நீர்த்த
மற்றும் அடர் நைட்ரிக் அமிலம் அலுமினியத்தோடு வினைபுரிவதில்லை. மாறாக
அலுமினியத்தின் மேல் ஆக்சைடு படலம் உருவாவதால், அதன் வினைபடும் திறன் தடுக்கப்படுகிறது.
5. அலுமினியம் ஒரு சிறந்த ஒடுக்கி
அலுமினியம் பவுடரும், இரும்பு ஆக்சைடும்
கொண்ட கலவையை சூடாக்கும் போது இரும்பு ஆக்சைடு இரும்பாக ஒடுக்கப்படுகின்றது.
இவ்வினை அலுமினிய வெப்ப ஒடுக்க வினை ஆகும்.
Fe2O3 + 2 Al → 2 Fe +
Al2O3 + வெப்ப ஆற்றல்
பயன்கள்
· வீட்டுப் பாத்திரங்கள் செய்யப்பயன்படுகிறது.
· மின்கம்பி
செய்யப் பயன்படுகிறது.
· விமானம்
மற்றும் தொழில் இயந்திரங்களின் பாகங்களைச் செய்யப் பயன்படுகிறது.