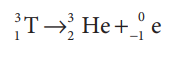11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
ஹைட்ரஜனின் பண்புகள்
ஹைட்ரஜனின் பண்புகள்
1. இயற்பண்புகள்:
ஹைட்ரஜன், நிறமற்ற, மணமற்ற சுவையற்ற மிகவும் இலேசான, எளிதில் தீப்பற்றக் கூடிய வாயு. இது ஒரு முனைவற்ற ஈரணு மூலக்கூறாகும். குறைந்த வெப்பநிலையில் அதிக அழுத்தத்திற்கு உட்படுத்தி இதனை நீர்மமாக்கலாம். ஹைட்ரஜன் மிகச் சிறந்த ஒடுக்க வினை பொருளாகும். ஹைட்ரஜன் மூலக்கூறின் பல்வேறு இயற் மாறிலிகளின் மதிப்பு அட்டவணை 4.1ல் கொடுக்கப்பட்டுள்ளன.
2. வேதிப் பண்புகள்
ஹைட்ரஜன், ஆக்சிஜனுடன் வினைபுரிந்து நீரைத் தருகிறது. இவ்வினை அதிக ஆற்றலை வெளிப்படுத்தும் ஒரு வெடித்தல் நிகழும் வினையாகும். இவ்வினை எரிமின்கலன்களில் மின் உற்பத்தி செய்வதில் பயன்படுகிறது.
2H2 + O2 → 2 H2O
இதைப் போலவே, ஹைட்ரஜன் ஹேலஜன்களுடன் வினைபுரிந்து, அவற்றின் ஹேலைடுகளைத்தருகிறது. ஒளி இல்லாத நிலையில் கூட, புளூரினுடன் வெடிக்கும் தன்மையுடைய வினை நிகழ்கிறது. ஒளி உள்ள நிலையில் குளோரினுடன் அறை வெப்பநிலையில் வினைபுரிகிறது. வெப்பப்படுத்தும் போது புரோமினுடன் இணைகிறது. அயோடினுடன் நிகழ்த்தும் வினையானது ஒரு ஒளி வேதி வினையாகும்.
H2 + X2 → 2 HX (X = F, Cl, Br & I)
மேற்கண்ட விளை பொருட்களில் ஹைட்ரஜனின் ஆக்சிஜனேற்ற எண் +1 ஆகும். அதிக வினைத்திறன் உடைய உலோகங்களான லித்தியம், சோடியம் மற்றும் கால்சியம் ஆகியவற்றுடன் வினைபுரிந்து அந்த உலோகங்களின் ஹைட்ரைடுகளைத் தருகின்றது. இந்த ஹைட்ரைடுகளில் ஹைட்ரஜனின் ஆக்ஸிஜனேற்ற நிலை −1 ஆகும்.
2 Li + H2 → 2 LiH
2 Na + H2 → 2 NaH
கரிம வேதியியலில், தொகுப்பு முறையில் சேர்மங்களைத் தயாரிக்கும் போது, ஹைட்ரைடுகள் ஒடுக்க வினைபொருளாகப் பயன்படுகிறது. லித்தியம் அலுமினியம் ஹைட்ரைடு மற்றும் சோடியம் போரோ ஹைட்ரைடு போன்ற மற்ற முக்கியமான ஒடுக்க வினைபொருட்களைத் தயாரிக்கவும் இவை பயன்படுகின்றன.
4 LiH + AlCl3 → Li [AlH4] + 3 LiCl
4 NaH + B(OCH3)3 → Na[BH4] + 3 CH3ONa
ஹைட்ரஜன் ஒரு சிறந்த ஒடுக்க வினைபொருளாகச் செயல்படும் தன்மை உடையது. நன்கு தூளாக்கப்பட்ட நிக்கலின் முன்னிலையில் ஹைட்ரஜன் நிறைவுறா கரிமச்சேர்மங்களுடன் சேர்க்கை வினைபுரிந்து நிறைவுற்ற சேர்மங்களைத் தருகிறது.
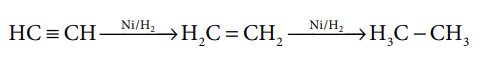
3. டியூட்டிரியத்தின் வேதிப் பண்புகள்
ஹைட்ரஜனைப் போன்றே டியூட்டிரியமும் ஆக்சிஜனுடன் வினைபுரிந்து டியூட்டிரியம் ஆக்சைடு என்ற கன நீரைத் தருகிறது. ஹேலஜன்களுடன் வினைபுரிந்து, அவற்றின் ஹேலைடுகளைத் தருகிறது.
2D2 + O2 → 2 D2O
D2 + X2 → 2 DX
(X = F, Cl, Br & I)
டியூட்டிரியத்தின் பதிலீட்டு வினைகள்
வினை நிகழும் சூழலைப் பொறுத்து, டியூட்டிரியமானது ஹைட்ரஜனின் சேர்மங்களிலுள்ள ஹைட்ரஜனை, பகுதியாகவோ அல்லது முழுவதுமாகவோ மீள் முறையில் பதிலீடு செய்கிறது. இவ்வினைகள் டியூட்டிரியம் அல்லது கன நீரைப் பயன்படுத்தி நிகழ்த்தப்படுகின்றன.
CH4 + 2 D2 → CD4 + 2H2
2 NH3 + 3D2 → 2 ND3 + 3H2
4. டிரிட்டியத்தின் பண்புகள்
டிரிட்டியம் β - துகளை உமிழும் கதிரியக்க தனிமமாகும். இதன் அரை ஆயுட்காலம் 12.3 ஆண்டுகள்.