11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
ஹைட்ரஜனின் சேர்மங்கள்
ஹைட்ரஜனின் சேர்மங்கள்
1. நீர்

ஹைட்ரஜனின் சேர்மங்களில் மிக அதிக அளவு இயற்கையில் கிடைப்பது நீராகும். பூமியின் மேற்பரப்பில் 70% கடல் நீரால் சூழப்பட்டுள்ளது. இதுவே நீரின் முதன்மையான ஆதாரமாகும். எனினும் கடல் நீரில் பல உப்புகள் கரைந்திருப்பதினால் நேரடியாகப் பயன்படுத்த முடிவதில்லை. அனைத்து உயிரினங்களின் வாழ்விற்கும் நீர் அடிப்படை ஆதாரமாக உள்ளது. நமது உடல் 65% நீரினைக் கொண்டுள்ளது
உங்களுக்குத் தெரியுமா?
ஆர்த்தோ மற்றும் பாரா நீர்.
வால்மீன்களின் புரோட்டோகோள் தட்டுகளின் நட்சத்திரக் கூட்டங்கள் மற்றும் சூரிய குடும்பத்தின் பல செயற்கைக் கோள்களில் நீர் காணப்படுகிறது. சமீபத்தில் விண்வெளியில், ஆர்த்தோ பாரா நீரின் விகிதம் கவனத்தை ஈர்த்துள்ளது. ஹைட்ரஜனைப் போலவே, நீரினையும் ஆர்த்தோ மற்றும் பாரா நீர் என வகைப்படுத்தலாம். ஆர்த்தோ நீரில் உள்ள இரு ஹைட்ரஜன் அணுக்களின் உட்கருக்கள் ஒரே திசையிலும் பாரா நீரில் உள்ள இரு ஹைட்ரஜன் அணுக்களின் உட்கருக்கள் வெவ்வேறு திசையிலும் சுழலுகின்றன. பூமியில் வெப்பநிலை 300K ல் நீரின் ஆர்த்தோ மற்றும் பாரா விகிதம் 3:1 நட்சத்திரக் கூட்டங்களில் அதிக பாரா நீர் காணப்படுகிறது நீரின் ஆர்த்தோ மற்றும் பாரா விகிதம் 2 : 5 : 1.

2. இயற்பண்புகள்
நீரானது நிறமற்ற எளிதில் ஆவியாகக் கூடிய நீர்மமாகும். மூலக்கூறுகளுக்கிடையேயான ஹைட்ரஜன் பிணைப்பினால், குறுக்கப்பட்ட நிலைமையில் (Condensed Phase) நீரானது தனித்த பண்புகளைப் பெற்றிருக்கிறது. நீரின் அதிக உறைநிலைக்கும், கொதிநிலைக்கும் நீரில் உள்ள ஹைட்ரஜன் பிணைப்பே காரணமாகும். நீரின் சில இயற்பண்புகள் அட்டவணை 4.2ல் குறிப்பிடப்பட்டுள்ளன.
அட்டவணை 4.2 – நீர், கனநீர், அதிகனநீர் ஆகியவற்றின் பண்புகள்

தனியே குறிப்பிட்டு காட்டப்படாத நிலையில் அனைத்து தரவுகளும் 298 K ல் கொடுக்கப்பட்டுள்ளன.
3. வேதிப்பண்புகள்
உலோகம், அலோகம் மற்றும் சேர்மங்களுடன் நீரானது வெவ்வேறு தன்மையுடன் வினைபுரியக்கூடியது. கார உலோகங்கள் அதிக வினைத்திறன் மிக்கவை. இவை நீர் குளிர்ந்த நிலையில் இருந்தாலும் கூட அதனை சிதைவடையச் செய்து ஹைட்ரஜனை வெளியேற்றுவதுடன், காரக் கரைசலைத் தருகின்றது.
2 Na + 2 H2O → 2 NaOH + H2 ↑
பெரிலியம் தவிர, ஏனைய இரண்டாம் தொகுதி உலோகங்கள், கார உலோகங்களைப் போன்றே நீருடன் வினைபுரிகின்றன. ஆனால் இவற்றின் வினைதிறன் கார உலோகங்களை விடக் குறைவாகும். இவற்றின் ஹைட்ராக்சைடுகள், கார உலோகங்களின் ஹைட்ராக்சைடுகளைவிட குறைந்த கரைதிறன் உடையவை.
Ba + 2 H2O → Ba(OH)2 + H2 ↑
சில இடைநிலைத் தனிம உலோகங்கள், சூடான நீருடனோ அல்லது நீராவியுடனோ வினைபுரிந்து அவற்றின் ஆக்சைடுகளைத் தருகின்றன. எடுத்துக்காட்டாக, செஞ்சூடான இரும்பு (iron) மீது நீராவியைச் செலுத்த இரும்பு [iron] ஆக்சைடு உருவாகிறது. இவ்விணையில் ஹைட்ரஜன் வெளியேறுகிறது.
3Fe + 4H2O → Fe3O4 + 4H2 ↑
லெட் மற்றும் காப்பர் வெஞ்சூட்டு வெப்ப நிலையில் மட்டுமே, நீரைச் சிதைக்கின்றன. சில்வர், கோல்டு, மெர்க்குரி மற்றும் பிளாட்டினம் போன்ற உலோகங்கள் நீருடன் எவ்வித வினையும் புரிவதில்லை. தனிம நிலையில் உள்ள கார்பன், சல்பர் மற்றும் பாஸ்பரஸ் போன்ற அலோகங்கள் நீருடன் சாதாரணமாக வினைபுரிவதில்லை. இருந்தபோதிலும் முன்னரே குறிப்பிட்டுள்ளவாறு கார்பன் செஞ்சூட்டு அல்லது வெஞ்சூட்டு வெப்ப நிலையில் நீராவியுடன் வினைபுரிந்து நீர் வாயுவைத் (CO + H2) தருகிறது.
மாறாக, ஹேலஜன்கள் நீருடன் வினைபுரிந்து அமிலக் கரைசலைத் தருகின்றன. எடுத்துக்காட்டாக, குளோரின் நீருடன் வினைபுரிந்து ஹைட்ரோகுளோரிக் அமிலத்தையும் ஹைப்போகுளோரஸ் அமிலத்தையும் தருகிறது. இவ்வினை குளோரின் நீரின் நுண்ணுயிர் எதிர்த்தன்மைக்கும் (Antibacteria) வெளுக்கும் பொருளாக பயன்படுவதற்கும் காரணமாக அமைகிறது.
Cl2 + H2O → HCl + HOCl
ஆனால் புளூரின் நீருடன் வேறு விதமாக வினைபுரிந்து ஆக்சிஜனை வெளிவிடுகிறது.
2F2 + 2 H2O → 4HF + O2
இதனைப் போலவே அலோகங்களின் சேர்மங்கள் நீருடன் வினைபுரிந்து அமிலக் கரைசல்களையோ அல்லது காரக் கரைசல்களையோ தருகின்றன. எடுத்துக்காட்டாக, கார்பனேட் உப்புகளின் நீர்க்கரைசல் சிறிதளவு காரத்தன்மையுடையது.
CO32- + H2O → HCO3- + OH-
நீர் ஈரியல்புத் தன்மை கொண்டது. இதனால் ஒரு புரோட்டானை வழங்கவும், ஏற்கவும் முடியும். எனவே இது அமிலமாகவும், காரமாகவும் செயல்படுகிறது. எடுத்துக்காட்டாக, HCl உடன் வினைபுரியும் போது நீரானது ஒரு புரோட்டானை ஏற்கிறது. ஆனால் வீரியம் குறைந்த காரமான NH3 உடன் வினைபுரியும் போது நீரானது ஒரு புரோட்டானை வழங்குகிறது.
NH3 + H2O → NH4+ + OH-
HCl + H2O → H3O+ + Cl-
நீரானது அயனிச் சேர்மங்களைக் கரைக்கிறது. மேலும் சில சகபிணைப்புச் சேர்மங்களும் நீராற்பகுப்படைகின்றன.
SiCl4 + 2 H2O → SiO2 + 4 HCl
P4O10 + 6 H2O → 4 H3PO4
பெரும்பாலான உப்புகளின் நீர்க் கரைசல்களை படிகமாக்குவதன் மூலம் பெறப்படும் படிகங்கள் நீரேறிய நிலையில் காணப்படுகின்றன. நீரேற்றமடைந்துள்ள உப்புகளில் உள்ள நீர் மூலக்கூறுகள், ஈதல் பிணைப்பின் மூலம் பிணைக்கப்பட்டிருக்கலாம் அல்லது படிக அணிக்கோவையின் இடைவெளியில் காணப்படலாம்.
எடுத்துக்காட்டாக,
[Cr (H2O)6] Cl3 – இச்சேர்மத்திலிலுள்ள அனைத்து ஆறு நீர் மூலக்கூறுகளும் ஈதல் பிணைப்பின் மூலம் பிணைக்கப்பட்டுள்ளன.
BaCl2.2H2O - இச்சேர்மத்தில் இரண்டு நீர் மூலக்கூறுகளும் அணிக்கோவையின் இடைவெளியில் அமைந்துள்ளன.
CuSO4.5H2O - இச்சேர்மத்தில் நான்கு நீர் மூலக்கூறுகள் ஈதல் பிணைப்பின் மூலம் இணைக்கப்பட்டுள்ளது. ஐந்தாவது நீர் மூலக்கூறு அணைவு கோளத்திற்கு வெளியே அமைந்துள்ளது. வெளியில் உள்ள நீர் மூலக்கூறு மற்றொரு [Cu (H2O) 4] SO4H2O மூலக்கூறுடன், மூலக்கூறுகளுக்கு இடையேயான ஹைட்ரஜன் பிணைப்பை ஏற்படுத்துகிறது.

படம் 4.4: காப்பர் சல்பேட் பென்ட்டா ஹைட்ரேட்டின் அமைப்பு
4. கடின நீர் மற்றும் மென்னீர்
கடின நீர் அதிக அளவு கனிம அயனிகளைக் கொண்டுள்ளது. நீரில் கரையக்கூடிய கால்சியம் மற்றும் மெக்னீசியம் ஆகிய உலோகங்களின் நேர் அயனிகளே பெரும்பாலும் கடின நீரில் காணப்படுகின்றன. ஒருசில இடங்களில் காணப்படும் கடின நீரில் இரும்பு (iron), அலுமினியம் மற்றும் மாங்கனீஸ் போன்ற உலோகங்களின் அயனிகளும் உள்ளன. இவ்வுலோகங்களின் பைகார்பனேட், குளோரைடு மற்றும் சல்பேட் உப்புகள் நீரில் காணப்படுவதால், நீர் கடினத் தன்மையடைகிறது. கடின நீரை கொதிக்க வைக்கும் போது, அதிலுள்ள மெக்னீசியம் மற்றும் கால்சியம் உலோகங்களின் கார்பனேட்டுகள் வீழ்படிவாகின்றன. கால்சியம் மற்றும் மெக்னீசியத்தின் நீரில் கரையும் உப்புகள் இல்லாத நீர் மென்னீர் என அழைக்கப்படுகிறது. நீரின் கடினத் தன்மை இரண்டு வகைப்படும். அவைகள் தற்காலிக கடினத்தன்மை மற்றும் நிரந்தர கடினத்தன்மை ஆகும்.
தற்காலிக கடினத்தன்மை மற்றும் அதனை நீக்குதல்
நீரில் கரையக்கூடிய, கால்சியம் மற்றும் மெக்னீசியம் ஆகியவற்றின் பைகார்பனேட் உப்புகள் காணப்படுதலே தற்காலிக கடினத் தன்மைக்கு முதன்மையான காரணமாகும். இவ்வகை நீரை கொதிக்க வைத்து பின் வடிகட்டுவதன் மூலம் கடினத் தன்மையை நீக்கலாம். கொதிக்க வைக்கும்போது, இந்த பைகார்பனேட் உப்புகள், கரையாத கார்பனேட் உப்புகளாகச் சிதைவடைந்து, வீழ்படிவாகின்றன. இவ்வாறு உருவான மெக்னீசியம் கார்பனேட் மேலும் நீராற்பகுப்பு அடைந்து கரையாத மெக்னீசியம் ஹைட்ராக்சைடைத் தருகிறது.
Ca (HCO3)2 → CaCO3 + H2O + CO2
Mg (HCO3)2 → MgCO3 + H2O + CO2
MgCO3 + H2O → Mg(OH)2 + CO2
வடிகட்டுதல் மூலமாக இவ்வீழ்படிவுகளை நீக்கலாம்.
நாம், கிளார்க் முறையினைப் பயன்படுத்தியும், தற்காலிக கடினத் தன்மையை நீக்கலாம். இம்முறையில் கணக்கிடப்பட்ட அளவு சுண்ணாம்பு நீரானது கால்சியம் மற்றும் மெக்னீசியம் அயனிகளைக் கொண்டுள்ள கடின நீருடன் சேர்க்கப்படுகிறது. இதனால் உருவாகும் ஹைட்ராக்சைடுகள் மற்றும் கார்பனேட்டுகள் வடிகட்டி நீக்கப்படுகின்றன.
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Mg (HCO3)2 + 2 Ca(OH)2
↓
2 CaCO3 + Mg(OH)2 + 2 H2O
நிரந்தர கடினத்தன்மை
மெக்னீசியம் மற்றும் கால்சியம் ஆகிய உலோகங்களின் நீரில் கரையக்கூடிய, குளோரைடு மற்றும் சல்பேட் உப்புகளினால் நிரந்தர கடினத் தன்மை ஏற்படுகிறது. சலவைச் சோடாவைச் சேர்த்து இதனை நீக்கலாம். சலவைச் சோடாவானது கடின நீரில் கரைந்துள்ள கால்சியம் மற்றும் மெக்னீசியத்தின் குளோரைடு மற்றும் சல்பேட்டுடன் வினைபுரிந்து அவற்றின் கரையாத கார்பனேட்டுகளைத் தருகிறது.
MCl2 + Na2CO3 → MCO3 + 2 NaCl
MSO4 + Na2CO3 → MCO3 + Na2SO4
(M = Ca, Mg)
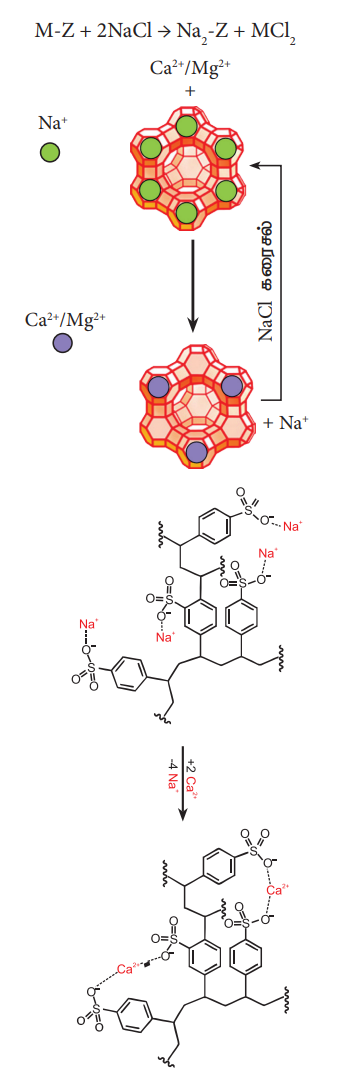
கடின நீரை மென்னீராக மாற்றப் பயன்படும் மற்றொரு முறை அயனிப் பரிமாற்ற முறையாகும். இம்முறையில், கடின நீரானது, சியோலைட் போன்ற அயனிப்பரிமாற்றப் பொருள் நிரப்பப்பட்ட குழாய் வழியே செலுத்தப்படுவதன் மூலம் கடினத்தன்மை நீக்கப்படுகிறது. சியோலைட்டுகள் என்பன நீரேற்றம் பெற்ற சோடியம் அலுமினோ சிலிக்கேட்டுகள் ஆகும். இவை Na2O.Al2O3.XSiO2YH2O (X = 2 முதல் 10, மற்றும் Y = 2 முதல் 6) என்ற பொதுவான வாய்பாட்டினைப் பெற்றுள்ளன. சியோலைட்கள் நுண்துளை வடிவமைப்பினைப் பெற்றுள்ளன. இவற்றிலுள்ள ஒற்றை இணை திறன் பெற்றுள்ள சோடியம் அயனிகள் எளிதாக பிணைக்கப்பட்டுள்ளன. இவ் அயனிகள், நீரின் கடினத் தன்மைக்குக் காரணமான உலோக அயனிகள் (M = Ca2+ அல்லது Mg2+) உடன் பரிமாற்றம் அடைகிறது. அணைவு வடிவத்தினை Na2 - Z எனக் குறிப்பிட இயலும். இதில் சோடியம் ஆனது பரிமாற்றமடையும் நேர் அயனியாகும்.
Na2 - Z + M2+ → M – Z + 2 Na+
அயனிப்பரிமாற்றம் முழுமையடைந்த பின்னர், நீர்த்த சோடியம் குளோரைடினைச் செலுத்துவதன் மூலம் மீண்டும் சியோலைட்டினைப் பெறலாம். இந்நிகழ்வில் சியோலைட்டினால் ஈர்த்துக் கொள்ளப்பட்ட Ca2+ மற்றும் Mg2+ அயனிகள், சோடியம் அயனிகளால் பரிமாற்றம் செய்யப்படுகிறது.
M - Z + 2 NaCl → Na2 - Z + MCl2