தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள் - கார்பன் மோனாக்சைடு (CO) | 12th Chemistry : UNIT 2 : p-Block Elements-I
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 2 : p-தொகுதி தனிமங்கள்-I
கார்பன் மோனாக்சைடு (CO)
கார்பன் மோனாக்சைடு (CO):
தயாரித்தல்:
கட்டுப்படுத்தப்பட்ட அளவு ஆக்ஸிஜன் உடன் கார்பனைவினைப்படுத்தி கார்பன் மோனாக்சைடை தயாரிக்க இயலும்.
2C + O2 → 2CO
தொழிற் முறையில், காற்றுடன் கார்பனை வினைப்படுத்தி கார்பன் மோனாக்சைடு தயாரிக்கப்படுகிறது. இவ்வாறு உருவாக்கப்பட்ட கார்பன் மோனாக்சைடில் நைட்ரஜன் வாயுவும் கலந்திருக்கும். நைட்ரஜன் மற்றும் கார்பன் மோனாக்சைடு சேர்ந்த கலவையானது உற்பத்தி வாயு (producer gas) என்றழைக்கப்படுகிறது.
2C + O2/N2 (காற்று) → 2CO + N2 (உற்பத்தி வாயு)
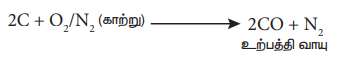
இந்த உற்பத்தி வாயுவானது, அதிக அழுத்தத்தில், காப்பர் (1) குளோரைடு கரைசலின் வழியே செலுத்தும் போது CuC1(CO).2H2O உருவாகிறது. குறைக்கப்பட்ட அழுத்தத்தில் இக்கரைசல் தூய கார்பன் மோனாக்சைடை வெளிவிடுகிறது.
மெத்தனாயிக் அமிலத்துடன் கந்தக அமிலத்தை சேர்த்து வெப்பப்படுத்தி தூய கார்பன் மோனாக்சைடு தயாரிக்கப்படுகிறது. இங்கு, கந்தக அமிலம் நீர்நீக்கும் காரணியாக செயல்படுகிறது.
HCOOH + H2SO4 → CO + H2SO4 H2O
பண்புகள்
இது நிறமற்ற , மணமற்ற , நச்சுத்தன்மை கொண்ட வாயுவாகும். இது நீரில் சிறிதளவு கரைகிறது. இது காற்றில் நீல நிற சுவாலையுடன் எரிந்து கார்பன் டையாக்சைடை உருவாக்குகிறது.
2CO + O2 → 2CO2
கார்பன் மோனாக்சைடை ஒளி அல்லது மரக்கரியின் முன்னிலையில் குளோரினுடன் வினைப்படுத்தும்போது, விஷத்தன்மை கொண்ட கார்பனைல் குளோரைடை வாயுவை உருவாக்குகிறது. இது பாஸ்ஜீன் எனவும் அறியப்படுகிறது. இது ஐசோசயனேட்டுகளை தொகுக்க பயன்படுகிறது.
CO + C12 → COC12
கார்பன் மோனாக்சைடு வலிமை மிகுந்த ஒடுக்கும் காரணியாக செயலாற்றுகிறது
3CO + Fe2O3 → 2Fe + 3CO2
உயர் வெப்ப, அழுத்த நிலையில் கார்பன் மோனாக்சைடு மற்றும் ஹைட்ரஜன் கலவையானது (தொகுப்பு வாயு) மெத்தனாலைத் தருகிறது.
CO + 2H2 → CH3OH
ஆக்சோ செயல்முறையில் ஈத்தேன் ஆனது கார்பன் மோனாக்சைடு மற்றும் ஹைட்ரஜன் வாயுவுடன் கலக்கப்பட்டு, புரப்பனல் (propanal) தயாரிக்கப்படுகிறது.
CO + C2H4 + H2 + → CH3CH2 CHO
பிஷ்ஷர் ட்ரோப்ஷ் தொகுப்பு:
கார்பன் மோனாக்சைடை, ஹைட்ரஜனுடன் சேர்த்து 50 atm க்கு குறைவான அழுத்தத்தில் உலோக வினைவேக மாற்றி முன்னிலையில் 500-700K வெப்பநிலையில் வினைப்படுத்தும்போது நிறைவுற்ற மற்றும் நிறைவுறா ஹைட்ரோகார்பன்கள் உருவாக்கப்படுகின்றன.
nCO + (2n+1)H2 → CnH2n+2 + nH2O
nCO + 2nH2 → CnH2n + nH2O
இடைநிலை உலோகத் தனிமங்களுடன் சேர்ந்து கார்பன் மோனாக்சைடு பல்வேறு அணைவுச் சேர்மங்களை உருவாக்குகின்றன. இவற்றில் உலோகம் பூஜ்ஜிய ஆக்ஸிஜனேற்ற நிலையில் உள்ளன. உலோகத்தை, கார்பன் மோனாக்சைடுடன் வெப்பப்படுத்துவதன் மூலம் இச்சேர்மங்கள் பெறப்படுகின்றன.எடுத்துக்காட்டு. நிக்கல் டெட்ராகார்பனைல் [Ni(CO)4)3 அயர்ன்பென்டாகார்பனைல் [Fe(CO)5], குரோமியம் ஹெக்சாகார்பனைல் [Cr(CO)6].
வடிவமைப்பு:
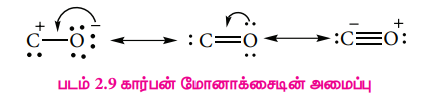
இது நேர்க்கோட்டு அமைப்பை பெற்றுள்ளது. கார்பன் மோனாக்சைடில், கார்பனுக்கும் ஆக்ஸிஜனுக்கும் இடையே மூன்று எலக்ட்ரான் இரட்டைகள் பங்கிடப்பட்டுள்ளன. XI வகுப்பில் கற்றறிந்தபடி மூலக்கூறு ஆர்பிட்டால் கொள்கையை பயன்படுத்தி கார்பன் மோனாக்சைடில் உள்ள பிணைப்பை விளக்க முடியும். C-O பிணைப்பு நீளம் 1.128A. பின்வரும் இரண்டு நியதி வடிவங்களின் உடனிசைவு வடிவமாக கருதப்படுகிறது.
கார்பன் மோனாக்சைடின் பயன்கள்:
1. ஹைட்ரஜன் மற்றும் கார்பன் மோனாக்சைடின் சமமோலார் கலவை (நீர் வாயு),கார்பன் மோனாக்சைடு மற்றும் நைட்ரஜன் ஆகியவற்றின் சமமோலார் கலவை (உற்பத்தி வாயு) ஆகியன முக்கியமான தொழிற்சாலை எரிபொருளாகும்.
2. கார்பன் மோனாக்சைடு ஒரு சிறந்த ஒடுக்கும் காரணியாகும், இதனால், உலோக ஆக்சைடுகளை உலோகங்களாக ஒடுக்க முடியும்.
3. கார்பன் மோனாக்சைடு ஒரு சிறந்த ஈனியாகும், இது இடைநிலை உலோகங்களுடன் இணைந்து உலோக கார்பனைல் சேர்மங்களை உருவாக்குகிறது.