தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள் - டைபோரேன் | 12th Chemistry : UNIT 2 : p-Block Elements-I
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 2 : p-தொகுதி தனிமங்கள்-I
டைபோரேன்
டைபோரேன்
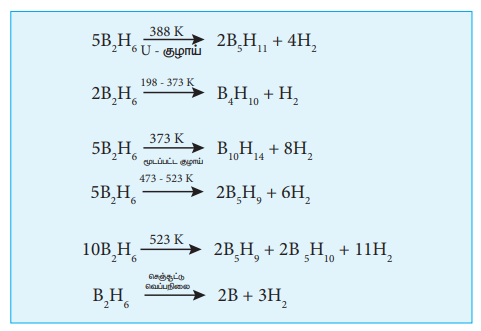
தயாரித்தல்:
உலோக ஹைட்ரைடை போரானுடன் வினைப்படுத்துவதன் மூலம் டைபோரேனை தயாரிக்க முடியும். இந்த முறையானது தொழிற்சாலை தயாரிப்பிற்காக பயன்படுத்தப்படுகிறது.
அயோடினை, டைக்லைமில் கரைந்துள்ள சோடியம் போரோஹைட்ரைடுடன் வினைப்படுத்துவதன் மூலமாகவும் சிறிதளவு டைபோரேனை தயாரிக்க முடியும்.
2NaBH4 + I2 → B2H6 + 2Nal + H2
மெக்னீஷியம் போரைடை HCI உடன் வெப்பப்படுத்தும்போது எளிதில் ஆவியாகும் போரேன்கள் பெறப்படுகின்றன.
2Mg3B2 + I2HC1 → 6MgC12 + B4H10 + H2
B4H10 + H2 → 2B2H6
பண்புகள்:
போரேன்கள் நிறமற்ற, டையா காந்தத் தன்மை கொண்ட சேர்மங்களாகும். இவை குறைந்த வெப்ப நிலைப்புத்தன்மை உடையவைகளாகும். அறை வெப்பநிலையில், டைபோரேன் நறுமணம் மிக்க, மிகவும் நச்சுத் தன்மை கொண்ட வாயுவாகும். மேலும் இது அதிக வினைத் திறன் கொண்டது. இது உயர் வெப்பநிலைகளில், ஹைட்ரஜன் வாயுவை வெளியேற்றி உயர் போரேன்களை தருகின்றது.
டைபோரேன், நீர் மற்றும் காரங்களுடன் வினைப்பட்டு முறையே போரிக் அமிலம் மற்றும் மெட்டா போரேட்டுகளை தருகின்றது.
B2H6 + 6H2O → 2H3BO3 + 6H2
B2H6 + 2NaOH +2H2O → 2NaBO2 + 6H2
காற்றுடன் வினை:
அறை வெப்பநிலையில், தூய நிலையிலுள்ள டைபோரேன் காற்று அல்லது ஆக்ஸிஜனுடன் வினைபுரிவதில்லை. ஆனால் மாசு கலந்த நிலையில் அதிகளவு வெப்பத்தை உமிழ்ந்து, B2O3ஐ உருவாக்குகிறது.
B2H6 + 3O2 → B2O3 + 3H2O
∆H = -2165 KJ mol -1
டைபோரேன் , மெத்தில் ஆல்கஹாலுடன் வினைப்பட்டு ட்ரைமெத்தில் போரேட்டை தருகிறது.
B2H6 + 6CH3 OH → 2B(OCH3)3+ 6H2
ஹைட்ரோபோரேனேற்றம்:
அறை வெப்பநிலையில், ஈதர் ஊடகத்தில், ஆல்கீன்கள் மற்றும் ஆல்கைன்களுடன் போரேன் சேர்க்கை (addition) வினைக்கு உட்படுகிறது. இவ்வினை ஹைட்ரோபோரோனேற்றம் என்றழைக்கப்படுகிறது. தொகுப்பு கரிமவேதியியலில், குறிப்பாக எதிர் மார்கோனிகாவ் சேர்க்கை வினைகளில் இது அதிகளவில் பயன்படுகிறது.
B2H6 + 6RCH = CHR → 2(RCH2-CHR)3B
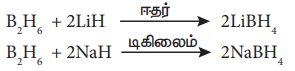
அயனி ஹைட்ரைடுகளுடன் வினை:
உலோக ஹைட்ரைடுகளுடன் வினைப்பட்டு உலோக போரோ ஹைட்ரைடுகளை தருகிறது.
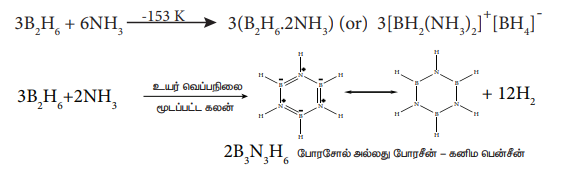
அம்மோனியாவுடன் வினை:
குறைந்த வெப்பநிலைகளில், டைபோரேன், அதிகளவு அம்மோனியாவுடன் வினைப்பட்டு டைபோரேன் டைஅம்மோனேட் உருவாகிறது. ஆனால் உயர் வெப்பநிலைகளில் வெப்பப்படுத்தும்போது, இது போரசோல் எனும் சேர்மத்தை தருகிறது.
டைபோரேன் வடிவமைப்பு:
டைபோரேனில், இரண்டு BH2 அலகுகள் இரண்டு ஹைட்ரஜன் பாலங்களால் பிணைக்கப்பட்டுள்ளன. எனவே இது எட்டு B-H பிணைப்புகளைக் கொண்டுள்ளது. எனினும், டைபோரேன் 12 இணைதிற எலக்ட்ரான்களை மட்டுமே கொண்டுள்ளது. இவை இயல்பான சகப்பிணைப்பிற்கு போதுமானதாக இல்லை . இதில் காணப்படும் நான்கு முனைய (terminal) B-H பிணைப்புகள் இயல்பான சகப்பிணைப்புகளாகும் (இரு மைய - இரு எலக்ட்ரான் பிணைப்பு அல்லது 2c-2e பிணைப்பு). எஞ்சியுள்ள நான்கு எலக்ட்ரான்கள் பால பிணைப்புகளுக்கு (bridged bonds) பயன்படுத்திக்கொள்ளப்பட வேண்டும். அதாவது, இரண்டு மூன்று மைய B-H-B பிணைப்புகள் ஒவ்வொன்றும் இரண்டு எலக்ட்ரான்களை பயன்படுத்திக்கொள்கின்றன.எனவே, இவைமூன்றுமைய இருஎலக்ட்ரான் (3c-2e)பிணைப்புகளாகும்.
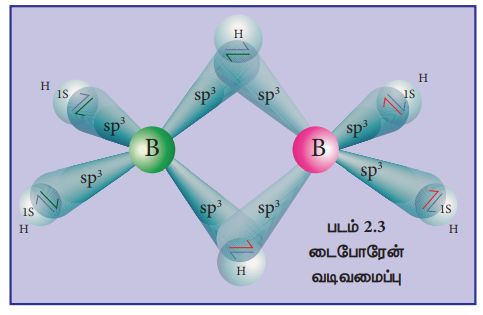
படம் 2.3 இல் காட்டியுள்ளவாறு பிணைப்புப் பாலங்களிலுள்ள ஹைட்ரஜன் அணுக்கள் ஒரே தளத்தில் அமைகின்றன. டைபோரேனில், போரான் அணுவானது sp' இனக்கலப்பிலுள்ளது. நான்கு sp' இனக்கலப்பு ஆர்பிட்டால்களில் மூன்று ஆர்பிட்டால்கள் ஒற்றை எலக்ட்ரானைக் கொண்டுள்ளன, நான்காம் ஆர்பிட்டால் காலியாக உள்ளது. ஒவ்வொரு போரான் அணுவிலிருந்தும், இரண்டு பாதி நிரம்பிய இனக்கலப்பு ஆர்பிட்டால்கள், இரண்டு ஹைட்ரஜன் அணுக்களின் 18 ஆர்பிட்டால்களுடன் மேற்பொருந்தி நான்கு 2c-2e முனைய பிணைப்புகளை உருவாக்குகின்றன. இந்நிலையில் ஒவ்வொரு போரான் அணுவிலும் ஒரு காலி ஆர்பிட்டாலும், ஒரு பாதி நிரம்பிய இனக்கலப்பு ஆர்பிட்டாலும் காணப்படுகின்றன. ஒரு போரான் அணுவின் பாதி நிரம்பிய இனக்கலப்பு ஆர்பிட்டாலும், மற்றொரு போரான் அணுவின் காலியாக உள்ள இனக்கலப்பு ஆர்பிட்டாலும், ஹைட்ரஜன் அணுவின் பாதி நிரம்பிய 18 ஆர்பிட்டாலும் ஒன்றோடொன்று மேற்பொருந்துவதால் B-H-B பிணைப்பு (மூமைய - இரு எலக்ட்ரான் பிணைப்பு ) உருவாகிறது.
டைபோரேனின் பயன்கள்:
1. உந்திகளில், உயர் ஆற்றல் எரிபொருளாக டைபோரேன் பயன்படுகிறது.
2. இது கரிம வேதியியலில் ஒடுக்கும் காரணியாக பயன்படுகிறது.
3. இது உலோகங்களை ஒட்டவைக்கும் சுடரில் (welding torch) பயன்படுகிறது.