11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
அணு ஆரம்
அணு ஆரம்
ஒரு அணுவின் அணு ஆரம் என்பது அதன் அணுக்கருவின் மையத்திற்கும், இணைதிற எலக்ட்ரான் உள்ள வெளிக்கூட்டிற்கும் இடையேயான தூரம் என வரையறுக்கப்படுகிறது.
ஒரு தனித்த அணுவின் ஆரத்தினை நேரடியாக அளவிட இயலாது. மந்த வாயுக்களைத் தவிர்த்து, வழக்கமாக அணு ஆரம் என்பது தொடர்புடைய அணுக்களுக்கிடையே காணப்படும் பிணைப்பின் தன்மையினைப் பொறுத்து, சகப்பிணைப்பு ஆரம் அல்லது உலோக ஆரத்தினைக் குறிப்பிடுகின்றது.
படம் 3.1 (அ) அணு ஆரம்
சகப்பிணைப்பு ஆரம்
ஒற்றை சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள இரண்டு ஒத்த அணுக்களின் அணுக்கருக்களுக்கு இடையேயான தொலைவின் பாதியளவு சகப்பிணைப்பு ஆரம் என்றழைக்கப்படுகிறது. அணுக்கருக்களுக்கு இடைப்பட்ட தொலைவு X - கதிர் விளிம்பு விளைவு ஆய்வின் மூலம் கண்டறியப்படுகிறது.
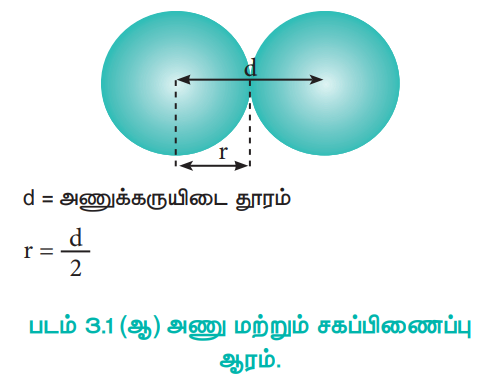
d = அணுக்கருயிடை தூரம்
r = d / 2
படம் 3.1 (ஆ) அணு மற்றும் சகப்பிணைப்பு ஆரம்
எடுத்துக்காட்டு
சோதனை மூலம் கண்டறியப்பட்ட Cl2 மூலக்கூறின் அணுக்கருயிடை தூரம், 1.98 Å.

படம் 3.1 (இ) குளோரினின் சகப்பிணைப்பு ஆரம்.
சகப்பிணைப்பு உருவாதலானது, அணு ஆர்பிட்டால்கள் மேற்பொருந்துதலை உள்ளடக்கியது. மேலும் இது அணுக்கருக்களுக்கு இடையேயானத் தொலைவினைக் குறைக்கிறது. எனவே சகப்பிணைப்பு ஆரம் என்பது, உண்மையான அணு ஆரத்தினை விட எப்போதும் குறைவான மதிப்பினைப் பெற்றிருக்கும்.
தனித்த ஒரு அணுவின் சகப்பிணைப்பு ஆரத்தினை, இரு வேறுபட்ட A மற்றும் B ஆகிய அணுக்களுக்கிடையே உள்ள அணுக்கருயிடை தூரத்திலிருந்தும் கணக்கிடலாம். இதற்கு ஷோமேக்கர் மற்றும் ஸ்டீவன்சன் முன்மொழிந்த எளிமையான முறை பின்வருமாறு
dA-B = rA + rB - 0.09 (XA − XB)
இங்கு XA மற்றும் XB என்பன முறையே ஃபாலிங் அளவீட்டில் A மற்றும் B ஆகியவற்றின் எலக்ட்ரான் கவர்தன்மை மதிப்புகளாகும். இங்கு XA > XB மற்றும் ஆரத்தின் அளவீடு Å.
சோதனை மூலம் கண்டறியப்பட்ட dH-Cl. மதிப்பான 1.28 Å -ல் இருந்து ஹைட்ரஜனின் சகப்பிணைப்பு ஆரத்தினை நாம் கணக்கிடுவோம். குளோரினின் சகப்பிணைப்பு ஆரம் 0.99 Å ஃபாலிங் அளவீட்டில், குளோரின் மற்றும் ஹைட்ரஜன் ஆகியவற்றின் எலக்ட்ரான் கவர்தன்மை மதிப்புகள் முறையே 3 மற்றும் 21 ஆகும்.
dн-Cl = rH + rCl - 0.09 (XCl – XH)
1.28 = rH + 0.99 – 0.09 (3 – 2.1)
1.28 = rH + 0.99 – 0.09 (0.9)
1.28 = rH + 0.99 – 0.081
1.28 = rH + 0.909
∴rH = 1.28 - 0.909 = 0.371 Å
உலோக ஆரம்
நெருங்கி பொதிந்து அமைந்துள்ள உலோகப் படிகத்தில், அருகருகே அமைந்துள்ள இரு உலோக அணுக்களுக்கு இடைப்பட்டத் தொலைவின் சரிபாதியளவு உலோக ஆரம் என வரையறுக்கப்படுகிறது.
எடுத்துக்காட்டாக, தாமிர (Copper) உலோகத்தில், அடுத்தடுத்து அருகே அமைந்துள்ள தாமிர (Copper) அணுக்களுக்கு இடைப்பட்டத் தொலைவு 2.56 Å. எனவே தாமிரத்தின் (Copper) உலோக ஆரம்
2.56 / 2 = 1.28 Å
உலோகப் படிகத்தின், அலகு கூட்டின் நீளத்தினைப் பயன்படுத்தி உலோக ஆரத்தினை கணக்கிட இயலும். Xll -ம் வகுப்பின் திட நிலைமை பாடத்தில் இது பற்றிய விரிவான கணக்கீட்டினை நீங்கள் கற்பீர்கள்.
அணு ஆரத்தில் காணப்படும் ஆவர்த்தனத் தொடர்பு
வரிசையில் ஏற்படும் மாறுபாடு (Variation in Periods)
ஒரு வரிசையில் செல்லும் போது அணு ஆரம் குறைகிறது. ஒரு வரிசையில் இடமிருந்து வலமாகச் செல்லும் போது, இணைதிற எலக்ட்ரான்கள் ஒரே கூட்டில் சேர்க்கப்படுகின்றன. அதே நேரத்தில் அணுக்கருவில் சேர்க்கப்படும் புரோட்டான், அணுக்கருவின் மின்சன்மையினை அதிகரிப்பதுடன் இணைதிற எலக்ட்ரான்களுக்கும், அணுக்கருவிற்கும் இடையேயான கவர்ச்சி விசையினையும் அதிகரிக்கின்றது. எனவே, ஒரு வரிசையில் செல்லும்போது அணு ஆரம் குறைகிறது.
செயலுறு அணுக்கரு மின்சுமை (effective nuclear charge)
எலக்ட்ரான்களுக்கும், அணுக்கருவிற்கும் இடையே நிலை மின்னியல் கவர்ச்சி விசைக் காணப்படுகிறது. இக்கவர்ச்சி விசை மட்டும் அல்லாமல், எலக்ட்ரான்களுக்கிடையே விலக்கு விசையும் காணப்படுகிறது. உள்கூட்டில் காணப்படும் எலக்ட்ரான்களுக்கும், இணைதிற கூட்டில் உள்ள எலக்ட்ரான்களுக்கும் இடையேயான இந்த விலக்கு விசையின் விளைவாக வெளிக்கூட்டில் உள்ள இணைதிற எலக்ட்ரான்கள் மீது, அணுக்கருவினால் செலுத்தப்படும் கவர்ச்சி விசை குறைக்கப் படுகின்றது. எனவே, உட்கூட்டில் உள்ள எலக்ட்ரான்கள், அணுக்கருவிற்கும், இணைதிற எலக்ட்ரான்களுக்கும் இடையே ஒரு திரை போல செயல்படுகிறது. இவ்விளைவு திரைமறைப்பு விளைவு (Screening effect) என்றழைக்கப்படுகிறது. வெளிக்கூட்டில் உள்ள இணைதிற எலக்ட்ரான்களால் உணரப்படும் நிகர அணுக்கரு மின்சுமை செயலுறு அணுக்கரு மின்சுமை (effective nuclear charge) என்றழைக்கப்படுகின்றது. செயலுறு அணுக்கரு மின்சுமையானது பின்வரும் சமன்பாட்டால் தோராயமாக கணக்கிடப்படுகிறது.
Zசெயலுறு = Z - S
இங்கு, Z என்பது அணு எண் மற்றும் S என்பது திரைமறைப்பு மாறிலி. இம்மாறிலியைக் கீழே விவரிக்கப்பட்டுள்ள, ஸ்லேட்டர் விதிகளைப் பயன்படுத்தி. கணக்கிடலாம்.
படி 1
முதலில் கொடுக்கப்பட்ட அணுவின் எலக்ட்ரான் அமைப்பினை எழுதவும். பிறகு ns மற்றும் np ஆர்பிட்டால்களை ஒரே தொகுதியாகவும், பிற ஆர்பிட்டால்களை தனி தொகுதிகளாகவும் பின்வரும் அமைப்பில் எழுதவும்.
(1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d) (4f) (5s, 5p)...
படி 2
செயலுறு அணுக்கரு மின்சுமை கண்டறிய வேண்டிய எலக்ட்ரான் அமைந்துள்ள தொகுதியினை இனம் கண்டறியவும். இதற்கு வலப்புறம் அமைந்துள்ள தொகுதிகளில் காணப்படும் எலக்ட்ரான்கள் திரைமறைப்பு விளைவிற்கு காரணமாக அமைவதில்லை.
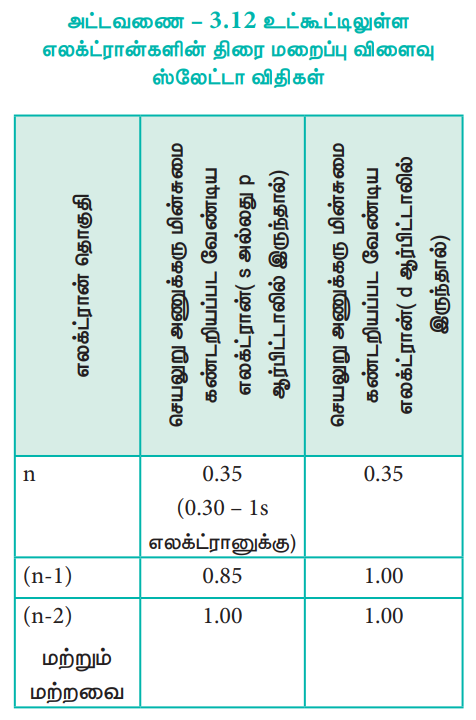
இனம் கண்டறியப்பட்ட தொகுதியில் (n என்ற எழுத்தால் குறிக்கப்படுகிறது) உள்ள எலக்ட்ரான்கள் ஒவ்வொன்றும் 0.35 அலகு அணுக்கரு மின்சுமையை மறைக்கின்றன. எனினும் 1s எலக்ட்ரான்களுக்கு இதன் மதிப்பு 0.30 அலகு ஆகும்.
படி 3
உட்கூட்டிலுள்ள எலக்ட்ரான்களின் மறைத்தல்
செயலுறு அணுக்கரு மின்சுமை கண்டறியப்பட வேண்டிய எலக்ட்ரான் s அல்லது p ஆர்பிட்டாலில் இருந்தால்,
i. (n - 1) தொகுதியில் உள்ள ஒவ்வொரு எலக்ட்ரான்களும் 0.85 அலகு அணுக்கரு மின்சுமையினை மறைக்கின்றன.
ii. (n - 2) தொகுதி அல்லது அதனை விடக்குறைவான (n - 3), (n - 4) போன்ற தொகுதிகளில் உள்ள ஒவ்வொரு எலக்ட்ரானும் முழுமையாக மறைக்கின்றன. அதாவது 1 அலகு அணுக்கரு மின் சுமையினை மறைக்கின்றன.
செயலுறு அணுக்கரு மின்சுமை கண்டறியப்பட வேண்டிய எலக்ட்ரான் d அல்லது f ஆர்பிட்டாலில் இருந்தால், அந்த எலக்ட்ரான் அமைந்துள்ள தொகுதிக்கு இடப்புறம் உள்ள தொகுதிகளில் காணப்படும் எலக்ட்ரான்கள் 1 அலகு அணுக்கரு மின்சுமையினை மறைக்கின்றன.
படி 4
அனைத்து எலக்ட்ரான்களின் திரைமறைப்பு விளைவு மதிப்புகளின் கூடுதல் திரைமறைப்பு மாறிலி 'S' ஐத் தருகின்றது.
அட்டவணை – 3.12 உட்கூட்டிலுள்ள எலக்ட்ரான்களின் திரை மறைப்பு விளைவு ஸ்லேட்டா விதிகள்
எடுத்துக்காட்டு
ஸ்கேன்டியத்தில் உள்ள 3d எலக்ட்ரான் மற்றும் 4s எலக்ட்ரானின் மீதான செயலுறு அணுக்கரு மின்சுமையின் மதிப்பினைக் கணக்கிடுதலை நாம் விளக்குவோம். ஸ்கேன்டியத்தின் எலக்ட்ரான் அமைப்பு 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1, இதனை பின்வருமாறு மாற்றியமைக்கலாம்.
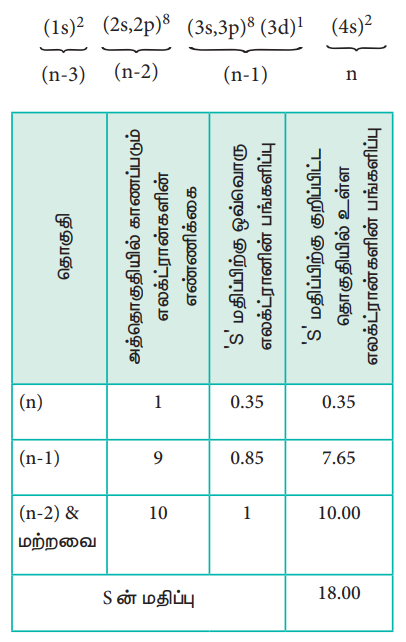
Zசெயலுறு = Z - S
Zசெயலுறு = 21 - 18
Zசெயலுறு = 3
3d1 எலக்ட்ரான் மீதான செயலுறு அணுக்கரு மின்சுமையினைக் கணக்கிடுதல்
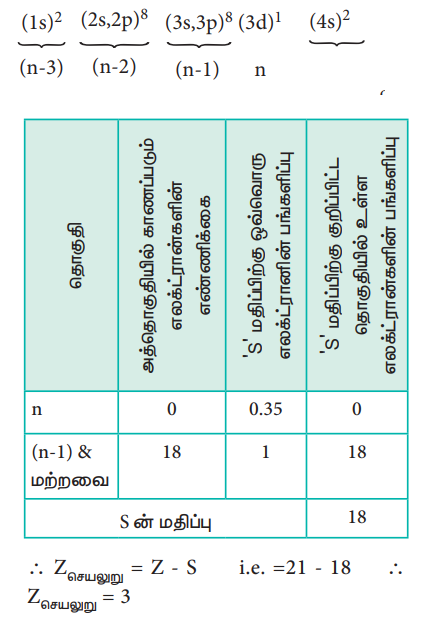
∴ Zசெயலுறு = Z – S
i.e. = 21 – 18
∴ Zசெயலுறு = 3
அட்டவணை 3.13 இரண்டாம் வரிசை தனிமங்களின் அணு ஆரம் (சகப்பிணைப்பு ஆரம்)
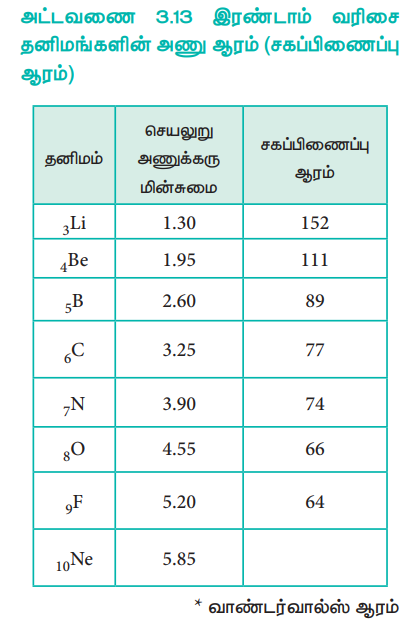
● வாண்டர்வால்ஸ் ஆரம்
தன்மதிப்பீடு
4) அலுமினியம் மற்றும் குளோரினின் 3p எலக்ட்ரான் மீதான செயலுறு அணுக்கரு மின்சுமையின் மதிப்பினை ஸ்லேட்டர் விதிகளைப் பயன்படுத்தி கண்டறிக. இதன் முடிவுகள் இவ்விரு அணுக்களின் அயனி ஆரங்களோடு எவ்விதத்தில் தொடர்பு கொண்டுள்ளன என்பதை விவரி.
தீர்வு
13A1 ன் எலக்ட்ரான் அமைப்பு
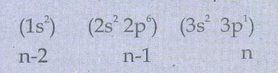
S = (2 × 0.35) + (8 × 0.85) + (2×1)
= 9.5
= Z−S
Zசெயலுறு = 13 − 9.5
= 3.5
17Cl ன் எலக்ட்ரான் அமைப்பு
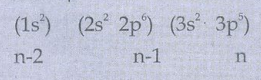
S = (6 × 0.35) + (8 × 0.85) + (2 × 1)
= 10.9
= 17 − 10.9.
Zசெயலுறு = 6.1
• குளோரின் Zசெயலுறு மதிப்பு அலுமினியத்தின் Zசெயலுறு மதிப்பை விட அதிகமாக உள்ளதால் குளோரினின் ஆரம் அலுமினியத்தின் ஆரத்தை விட குறைவாக காணப்படும்.
தொகுதியில் ஏற்படும் மாறுபாடுகள் (variation in group)
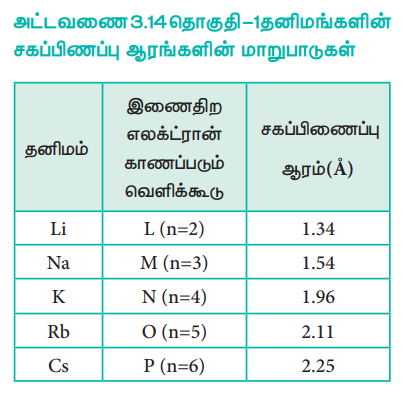
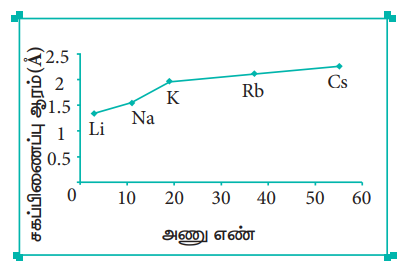
தனிம வரிசை அட்டவணையில், ஒரு தொகுதியில் மேலிருந்து கீழாக அணு ஆரம் அதிகரிக்கின்றது. ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும் போது, புதிதாகச் சேர்க்கப்படும் இணைதிற எலக்ட்ரான்கள் இடம்பெறும் பொருட்டு, புதிய கூடுகள் உருவாக்கப்படுகின்றன. இதன் காரணமாக, அணுக்கருவின் மையத்திற்கும், இணைதிற எலக்ட்ரான்கள் காணப்படும் வெளிக்கூட்டிற்கும் இடையேயான தொலைவு அதிகரிக்கின்றது. எனவே அணு ஆரம் அதிகரிக்கின்றது. ஒரு தொகுதியில் கார உலோகங்களின் அணு ஆரங்களின் மாறுபாடு பின்வருமாறு
அட்டவணை 3.14 தொகுதி – 1 தனிமங்களின் சகப்பிணப்பு ஆரங்களின் மாறுபாடுகள்
செயல்பாடு 3.1
பல்வேறு தொகுதிகள் மற்றும் வரிசைகளைச் சார்ந்த சில தனிமங்களின் சகப்பிணைப்பு ஆரம் (Å - ல்) பின்வருமாறு அட்டவணையிடப்பட்டுள்ளது. இம் மதிப்புகளை அவற்றின் அணு எண்ணிற்கு எதிராக வரைபடத்தில் குறிக்க. இவ்வரைபடத்தில் இருந்து ஒரு தொகுதி மற்றும் தொடரில் ஏற்படும் மாறுபாடுகளை விளக்குக.
2 ஆம் தொகுதி தனிமங்கள் Be (0.89), Mg (1.36), Ca (1.74), Sr (1.91) Ba (1.98)
17 ஆம் தொகுதி தனிமங்கள் F (0.72), Cl (0.99), Br (1.14), I (1.33)
3 ஆம் வரிசை தனிமங்கள் Na (1.57), Mg (1.36), Al (1.25), Si (1.17), P (1.10), S (1.04), Cl (0.99)
நான்காம் வரிசை தனிமங்கள் :
K (2.03), Ca (1.74), Sc (1.44), Ti (1.32), V (1.22), Cr (1.17), Mn (1.17), Fe (1.17), Co (1.16), Ni (1.15), Cu (1.17), Zn (1.25), Ga (1.25), Ge (1.22), As (1.21), Se (1.14), Br (1.14)