எடுத்துக்காட்டு கணக்குகள் - தன்மதிப்பீடு:தனிமங்களின் ஆவர்த்தன வகைப்பாடு | 11th Chemistry : UNIT 3 : Periodic Classification of Elements
11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
தன்மதிப்பீடு:தனிமங்களின் ஆவர்த்தன வகைப்பாடு
தன்மதிப்பீடு
1) மெண்டலீஃபின் தனிம வரிசை அட்டவணைக்கும் நவீன தனிம வரிசை அட்டவணைக்கும் அணுகுமுறையில் உள்ள அடிப்படை வேறுபாடு யாது?
மெண்டலீஃப் தனிமங்களை அவற்றின் அணு நிறைகளின் ஏறுவரிசையிலும், நவீன தனிம வரிசை அட்டவணையில் மோஸ்லே தனிமங்களை அணு எண்ணின் ஏறுவரிசையிலும் அட்டவணைப் படுத்தியுள்ளனர்.
தன்மதிப்பீடு
2) அணு எண் 120 உடைய தனிமம் இந்நாள் வரை கண்டறியப்படவில்லை. இத்தனிமத்திற்கு IUPAC வழிமுறையின் அடிப்படையில் வழங்கப்படும் பெயர் மற்றும் குறியீடு என்னவாக இருக்கும்? இத்தனிமம் பெற்றிருக்க வாய்ப்புள்ள எலக்ட்ரான் அமைப்பினையும் நிர்ணயிக்கவும்.
தீர்வு
IUPAC விதிகளின் படி
1− Un; 2 − bi; 0 − Nil
எனவே IUPAC தற்காலிகப் பெயர் : Unbinilium
IUPAC தற்காலிகக் குறியீடு : ubn
எலக்ட்ரான் அமைப்பு : [Og] 8s2
தன்மதிப்பீடு
3) (n - 1) d2, ns2 (இங்கு n = 5) என்ற எலக்ட்ரான் அமைப்பினை நிறைவு செய்யும் தனிமமானது தனிமவரிசை அட்டவணையில் பெற்றுள்ள இடத்தினைக் கண்டறிக.
தீர்வு
• n = 5 எனவே இத்தனிமம் 5வது வரிசையை சார்ந்ததாகும். மேலும் இதன் வெளிக்கூட்டு எலக்ட்ரான் அமைப்பில் ns ஆர்பிட்டால் முழுவதும் நிரம்பி, (n−1) d ஆர்பிட்டாலில் இரண்டு எலக்ட்ரான்களைப் பெற்று உள்ளதால் 4வது தொகுதியை சேர்ந்த தனிமம் ஆகும். 5வது வரிசை, 4வது தொகுதியைச் சேர்ந்த அத்தனிமம் ஜிர்கோனியம் ஆகும்.
தன்மதிப்பீடு
4) அலுமினியம் மற்றும் குளோரினின் 3p எலக்ட்ரான் மீதான செயலுறு அணுக்கரு மின்சுமையின் மதிப்பினை ஸ்லேட்டர் விதிகளைப் பயன்படுத்தி கண்டறிக. இதன் முடிவுகள் இவ்விரு அணுக்களின் அயனி ஆரங்களோடு எவ்விதத்தில் தொடர்பு கொண்டுள்ளன என்பதை விவரி.
தீர்வு
13A1 ன் எலக்ட்ரான் அமைப்பு
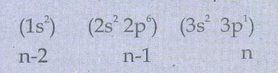
S = (2 × 0.35) + (8 × 0.85) + (2×1)
= 9.5
= Z−S
Zசெயலுறு = 13 − 9.5
= 3.5
17Cl ன் எலக்ட்ரான் அமைப்பு
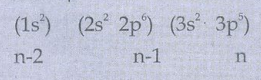
S = (6 × 0.35) + (8 × 0.85) + (2 × 1)
= 10.9
= 17 − 10.9.
Zசெயலுறு = 6.1
• குளோரின் Zசெயலுறு மதிப்பு அலுமினியத்தின் Zசெயலுறு மதிப்பை விட அதிகமாக உள்ளதால் குளோரினின் ஆரம் அலுமினியத்தின் ஆரத்தை விட குறைவாக காணப்படும்.
தன்மதிப்பீடு
5) X3+, Y2+ மற்றும் Z- ஆகிய சம எலக்ட்ரான்களைக் கொண்ட அயனிகளின் ஆரங்கள் முறையே 136 pm, 64 pm, 49 pm என ஒரு மாணவர் அறிக்கை அளித்தார். இந்த வரிசை சரியானதா? குறிப்புரை தருக.
தீர்வு
• X3+, Y2+ மற்றும் Z− ஆகிய சம எலக்ட்ரான்களைக் கொண்ட அயனிகள் என்பதால் அவற்றின் செயலுறு மின் சுமை பின்வருமாறு குறைகிறது.
(Zசெயலுறு) X3+ > (Zசெயலுறு)Y2+ (Zசெயலுறு) Z−
• செயலுறு மின்சுமை அதிகம் எனில் ஆரம் குறைவாக காணப்படும். எனவே அயனி ஆரத்தின் சரியான வரிசை

தன்மதிப்பீடு
6. X, Y மற்றும் Z ஆகிய தனிமங்களின் முதல் அயனியாக்கும் ஆற்றல் (IE1) மற்றும் இரண்டாம் அயனியாக்கும் ஆற்றல் (IE2) ஆகியன முறையே கீழே கொடுக்கப்பட்டுள்ளன.
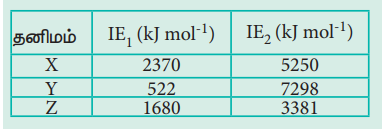
மேற்கண்ட தனிமங்களுள் அதிக வினைபுரியும் உலோகம் எது? மந்த வாயு எது? குறைவாக வினைபுரியும் உலோகம் எது?
தீர்வு
எத்தனிமம் மிக குறைந்த முதல் அயனியாக்கும் ஆற்றலை பெற்றுள்ளதோ அத்தனிமமே மிக அதிக வினைபுரியும் திறன் கொண்டதாகும். எனவே தனிமம் Y அதிக வினைபுரியும் உலோகம் ஆகும்.
தனிமம் X மிக அதிகமான முதல் அயனியாகும் ஆற்றலை பெற்றுள்ளது எனவே X என்பது மந்த வாயுவாகும்.
தனிமம் Z ன் முதல் அயனியாக்கும் ஆற்றல் Y ஐ விட அதிகம். எனவே தனிமம் Z ன் வினைபுரியும் திறன் தனிமம் Y ஐ விட குறைவு.
தன்மதிப்பீடு
7. குளோரினின் எலக்ட்ரான் ஏற்கும் என்தால்பி மதிப்பு 348 kJ mol-1 வாயுநிலையில் உள்ள 17.5g குளோரின் அணுக்கள் முழுவதும் Cl- அயனியாக மாற்றப்படும் போது வெளியிடப்படும் ஆற்றலின் மதிப்பினை kJ ல் கணக்கிடுக.
தீர்வு
Cl(g) + e− → Cl−(g) ∆H = 348 kJ mol−1
ஒரு மோல் (35.5g) குளோரின் 348 kJ ஆற்றலை வெளியிடுகிறது.
ஃ17.75g குளோரின்,
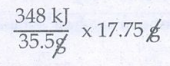 ஆற்றலை வெளியிடுகிறது.
ஆற்றலை வெளியிடுகிறது.
ஃ வெளிப்பட்ட ஆற்றலின் அளவு = 348/2 = 174 kJ