11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
நவீன ஆவர்த்தன அட்டவணை
1. நவீன ஆவர்த்தன அட்டவணை
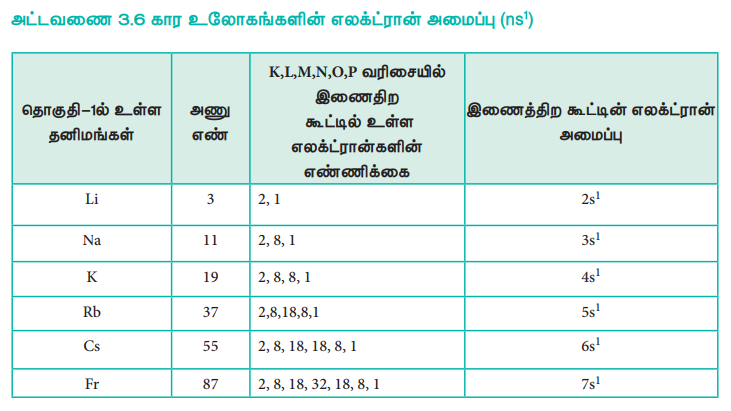
தனிமங்களின் இயற் மற்றும் வேதிப்பண்புகள், அத்தனிமங்களின் வெளிக்கூட்டில் காணப்படும் எலக்ட்ரான் அமைப்போடு தொடர்புடையது. வெவ்வேறு தனிமங்கள் தங்களது வெளிக்கூட்டில் ஒத்த எலக்ட்ரான் அமைப்பினை பெற்றிருப்பின், அவற்றின் பண்புகளும் ஒத்திருக்கும். எடுத்துக்காட்டாக தங்களின் இணைதிறக்கூட்டில் உள்ள s ஆர்பிட்டாலில் ஒரு எலக்ட்ரானைப் பெற்றுள்ள தனிமங்கள் அவைகளின் இயற் மற்றும் வேதிப் பண்புகளில் ஒத்துக் காணப்படுகின்றன. நவீன ஆவர்த்தன அட்டவணையில் இத்தனிமங்கள் அனைத்தும் ஒன்றாக ஒரே தொகுதியில் ஒருங்கிணைக்கப்பட்டு முதல் தொகுதி தனிமங்கள் என அழைக்கப்படுகின்றன.
அட்டவணை 3.6 கார உலோகங்களின் எலக்ட்ரான் அமைப்பு (ns1)
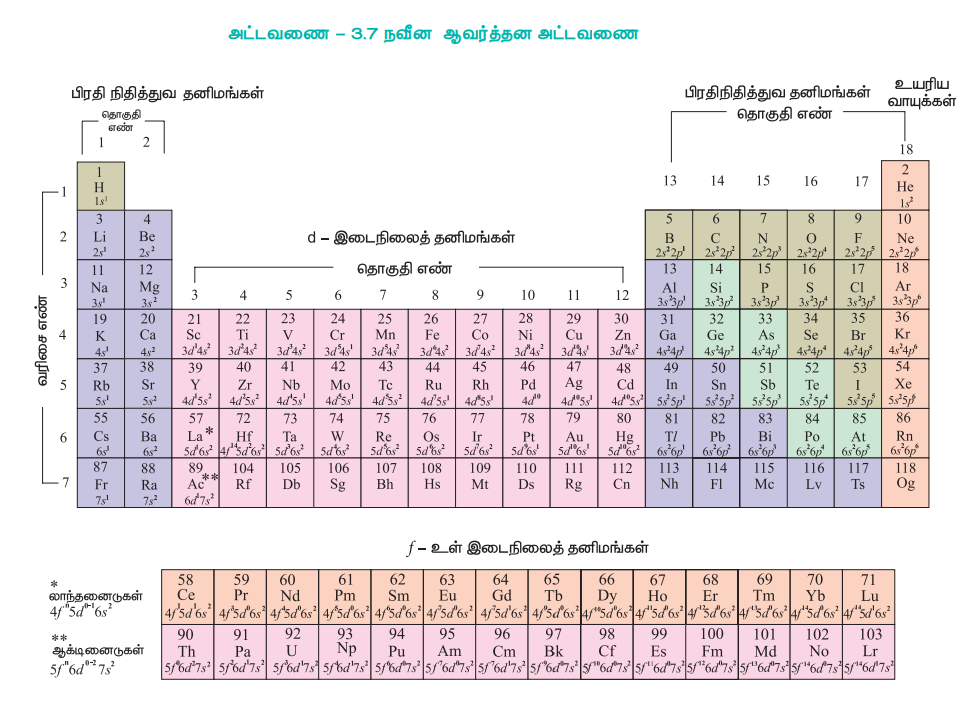
இவ்வாறாக, நவீன ஆவர்த்தன அட்டவணையில் அனைத்து தனிமங்களும் 18 செங்குத்து நிரல்களிலும் 7 கிடைமட்ட நிரைகளிலும் வைக்கப்பட்டுள்ளன. செங்குத்து நிரல்கள் தொகுதிகள் (group) எனவும், கிடைமட்ட நிரைகள் வரிசைகள் (periods) எனவும், அழைக்கப்படுகின்றன. IUPAC விதிமுறையின் படி தொகுதிகள் குறிக்கப்படும் முந்தைய முறையான 1A முதல் VIIA வரை மற்றும் 1B முதல் VIII வரை ஆகியவை மாற்றியமைக்கப்பட்டு 1 முதல் 18 வரையிலான இயல் எண்கள் மூலம் தொகுதிகள் குறிப்பிடப்படுகின்றன.
ஒவ்வொரு வரிசையும், 'ns1' என்ற பொதுவான வெளிக்கூட்டு எலக்ட்ரான் அமைப்பினைக் கொண்டுள்ள தனிமத்தில் துவங்கி ns2np6 என்ற வெளிக்கூட்டு எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள தனிமத்தில் முடிவடைகிறது. இங்கு 'n' என்பது வரிசையின் எண்ணைக் (முதன்மைக் குவாண்டம் எண்) குறிப்பிடுகின்றது. ஆஃபா தத்துவம் மற்றும் அதன் அடிப்படையிலான அணுக்களின் எலக்ட்ரான் அமைப்பானது நவீன தனிமவரிசை அட்டவணைக்கு கருத்து வடிவிலான அடிப்படையைத் தருகின்றது.
தன்மதிப்பீடு
1) மெண்டலீஃபின் தனிம வரிசை அட்டவணைக்கும் நவீன தனிம வரிசை அட்டவணைக்கும் அணுகுமுறையில் உள்ள அடிப்படை வேறுபாடு யாது?
மெண்டலீஃப் தனிமங்களை அவற்றின் அணு நிறைகளின் ஏறுவரிசையிலும், நவீன தனிம வரிசை அட்டவணையில் மோஸ்லே தனிமங்களை அணு எண்ணின் ஏறுவரிசையிலும் அட்டவணைப் படுத்தியுள்ளனர்.
அட்டவணை - 3.7 நவீன ஆவர்த்தன அட்டவணை