11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
அயனி ஆரம்
அயனி ஆரம்
ஒரு அயனியின் அணுக்கருவின் மையத்திற்கும், அவ்வயனியின் எலக்ட்ரான் திரள்முகில் (electron cloud) மீது அதன் அணுக்கருவால் கவர்ச்சி விசையினை செலுத்த இயலும் தூரத்திற்கும் இடையிலான தொலைவு அயனி ஆரம் என வரையறுக்கப்படுகிறது. நேரயனி மற்றும் எதிரயனி ஆகியவற்றிற்கு இடையேயான அயனி இடைத் தொலைவினைக் கொண்டு பாலிங் முறைப்படி, ஒற்றை மின்சுமையுடைய படிகங்களின் அயனி ஆரங்களை கணக்கிடலாம்.
படிக அலகுக்கூட்டில் காணப்படும் அயனிகள் கோள வடிவமுடையவை என பாலிங் கருதினர். மேலும் அவைகள் ஒன்றையொன்று தொட்டுக் கொண்டிருப்பதாகவும் கருதினார். எனவே,
d = rc+ + rA- - - - - - - - - - - (1)
இங்கு d என்பது நேர் அயனி C+ ன் அணுக்கருவிற்கும், எதிர் அயனி A- ன் அணுக்கருவிற்கும் இடையேயானத் தொலைவு ஆகும். rc+ மற்றும் rA-ஆகியன முறையே நேர் மற்றும் எதிர் அயனிகளின் ஆரங்களாகும்.
மேலும், மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பினைப் (எடுத்துக்காட்டாக Na+ மற்றும் F- அயனிகள் 1s2 2s2 2p6 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளன) பெற்றுள்ள அயனிகளின் ஆரமானது, அவ்வயனிகள் மீது அணுக்கருவால் செலுத்தப்படும் செயலுறு அணுக்கருமின்சுமைக்கு எதிர்விகிதத்தில் அமையும். அதாவது,
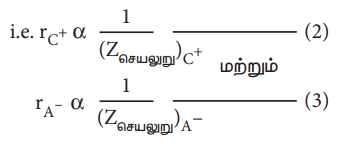
இங்கு Zசெயலுறு என்பது செயலுறு அணுக்கரு மின்சுமைக்குச் சமம். Zசெயலுறு = Z - S
சமன்பாடு (2) ஐ (3) ஆல் வகுக்க,
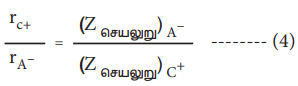
சமன்பாடு (1) மற்றும் (4) ஐத் தீர்ப்பதன் மூலம் rc+ மற்றும் rA- மதிப்புகளைப் பெற இயலும்.
NaF படிகத்திலுள்ள Na+ மற்றும் F- அயனிகளின் ஆரங்களைக் கணக்கிடுவதன் மூலம் இம்முறையினை நாம் விளக்கலாம். NaF படிகத்தின் அயனி இடைத் தொலைவு 231 pm ஆகும்,
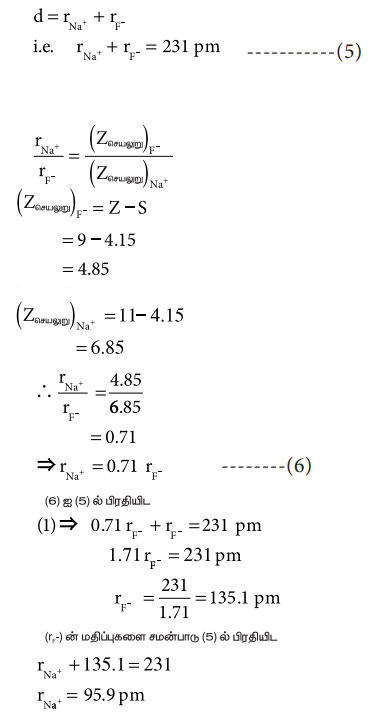
rNa+ + 135.1 = 231
rNa+ = 95.9 pm
தன்மதிப்பீடு
5) X3+, Y2+ மற்றும் Z- ஆகிய சம எலக்ட்ரான்களைக் கொண்ட அயனிகளின் ஆரங்கள் முறையே 136 pm, 64 pm, 49 pm என ஒரு மாணவர் அறிக்கை அளித்தார். இந்த வரிசை சரியானதா? குறிப்புரை தருக.
தீர்வு
• X3+, Y2+ மற்றும் Z− ஆகிய சம எலக்ட்ரான்களைக் கொண்ட அயனிகள் என்பதால் அவற்றின் செயலுறு மின் சுமை பின்வருமாறு குறைகிறது.
(Zசெயலுறு) X3+ > (Zசெயலுறு)Y2+ (Zசெயலுறு) Z−
• செயலுறு மின்சுமை அதிகம் எனில் ஆரம் குறைவாக காணப்படும். எனவே அயனி ஆரத்தின் சரியான வரிசை
