11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
பாடச்சுருக்கம்
பாடச்சுருக்கம்
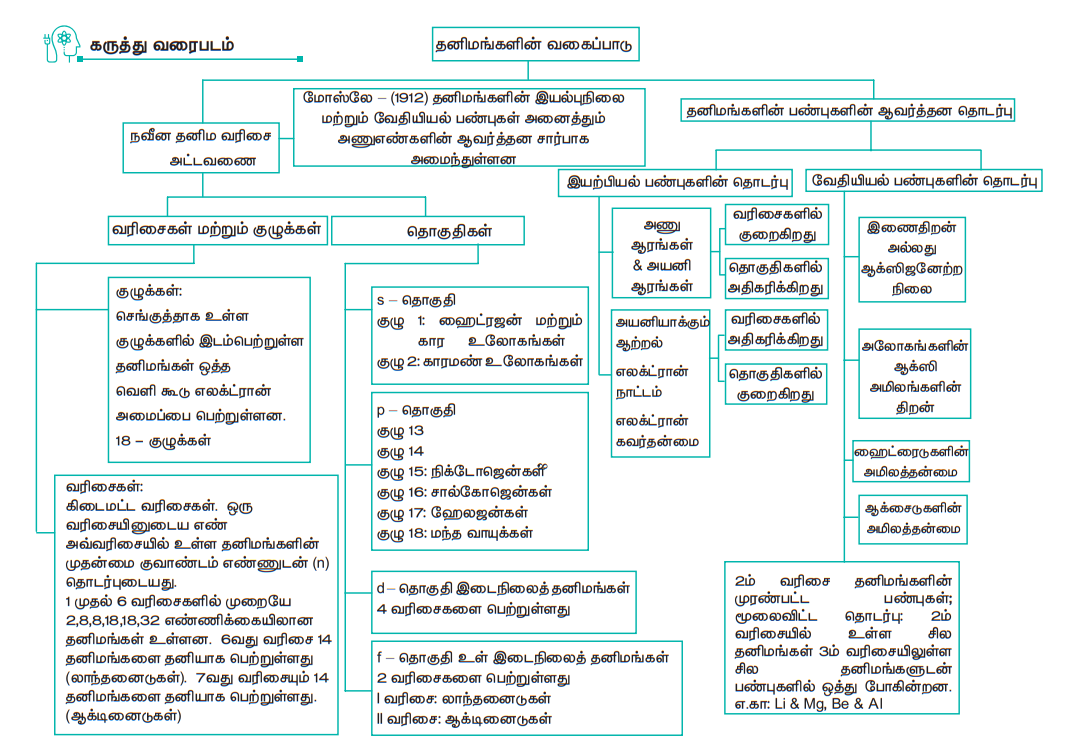
பல்வேறுபட்ட தனிமங்களை முறையாக வகைப்படுத்துவதற்கு தனிமவரிசை அட்டவணை தோற்றுவிக்கப்பட்டது. தனிமங்களின் பண்புகளை அடிப்படையாகக்கொண்டு அவைகளை வகைப்படுத்தும் முதல் முயற்சியினை லவாய்சியர் மேற்கொண்டார். இவரின் முயற்சியினை ஜோகன் டாபரீனியர், AEB சான்கோர்டியஸ் மற்றும் நியூ லாண்ட்ஸ் ஆகியோர் பின்பற்றி ஆராய்ச்சிகளை தொடர்ந்தனர். அர்த்தமுள்ள விளக்கங்களைக் கொண்ட முதல் தனிம வரிசை அட்டவணை, அணுநிறையை அடிப்படையாகக் கொண்டு மெண்டலீஃப் என்பவரால் கட்டமைக்கப்பட்டது. இக்கட்டமைப்பானது, தனிமங்களின் பண்புகள் அனைத்தும் அவைகளின் அணு எண்களின் அடிப்படையிலேயே அமைந்துள்ளன, என்கிற நவீன ஆவர்த்தன விதியால் மாற்றியமைக்கப்பட்டது. நவீன தனிமவரிசை அட்டவணையானது, 18 தொகுதிகளையும் 7 வரிசைகளையும் கொண்டு உருவாக்கப்பட்டுள்ளது.
ஒரே தொகுதியில் உள்ள தனிமங்கள் அனைத்தும் ஒத்த பண்புகளைப் பெற்றுள்ளன. ஏனெனில் அவைகளின் இணைதிற கூட்டில் ஒத்த எலக்ட்ரான் ஒழுங்கமைப்பினை பெற்றுள்ளன. ஒரே வரிசையில் உள்ள தனிமங்கள் அனைத்தும் பண்புகளில் வேறுபடுகின்றன. ஏனெனில் அவைகளின் இணைதிற கூட்டின் எலக்ட்ரான் ஒழுங்கமைப்பில் வேறுபடுகின்றன. தனிமங்களின் எலக்ட்ரான் ஒழுங்கமைப்பினை அடிப்படையாகக்கொண்டு s-தொகுதி, p-தொகுதி, d-தொகுதி மற்றும் f-தொகுதி தனிமங்கள் என்றும் வகைப் படுத்தப்படுகின்றன. s, p, d மற்றும் f தொகுதிகளில் இடம்பெற்றுள்ள தனிமங்கள் தனித்துவமான பண்புகளைப் பெற்றுள்ளன. இந்த அட்டவணையில் இடம்பெற்றுள்ள தனிமங்களுள் 78%க்கும் அதிகமான தனிமங்கள் உலோகங்களாகும். இத்தனிமங்கள் தனிமவரிசை அட்டவணையின் இடப்புறத்தில் இடமளிக்கப்பட்டுள்ளன. அலோகங்கள் அனைத்தும் தனிமவரிசை அட்டவணையில் வலது மேற்புறத்தில் வைக்கப்பட்டுள்ளன. உலோகங்கள் மற்றும் அலோகங்களின் தனித்துவமான பண்புகளுள் சிலவற்றை ஒருங்கே கொண்டுள்ள தனிமங்கள் உலோகப்போலிகள் என்று அழைக்கப்படுகின்றன.
அணு ஆரம், அயனி ஆரம், அயனியாக்கும் ஆற்றல் எலக்ட்ரான் நாட்டம் மற்றும் எலக்ட்ரான் கவர்தன்மை போன்ற ஆவர்த்தன பண்புகள் ஆவர்த்தன தொடர்பினை பெற்றுள்ளன. ஆவர்த்தன பண்புகளின் போக்கில் ஏற்படும் மாற்றங்கள் பின்வரும் வரைபடத்தில் கொடுக்கப்பட்டுள்ளது.
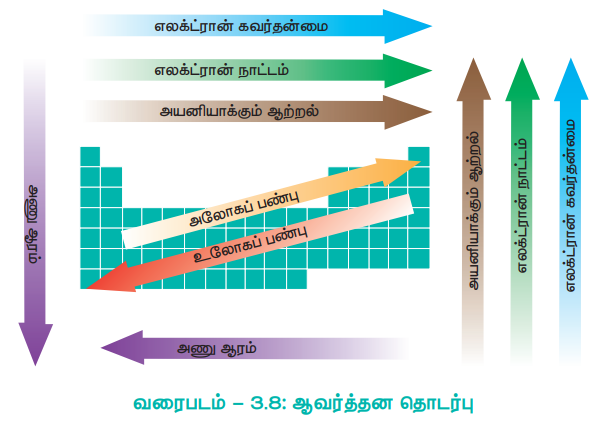
தனிமவரிசை அட்டவணையின் இடப்புறத்தில் இடம் பெற்றுள்ள தனிமங்கள் உச்சபட்ச ஒடுக்கும் தன்மையினையும், வலப்புறத்தில் இடம் பெற்றுள்ள தனிமங்கள் உச்சபட்ச ஆக்ஸிஜனேற்றும் தன்மையினையும் காட்டுகின்றன. தனிமவரிசை அட்டவணையின் மையத்தில் இடம்பெற்றுள்ள தனிமங்களின் வினைத்திறனானது, வலப்புறம் மற்றும் இடப்புறத்தில் இடம்பெற்றுள்ள தனிமங்களின் வினைத்திறனை விட குறைவாக இருக்கும். இரண்டாம் மற்றும் மூன்றாம் வரிசைகளுக்கிடையே மூலைவிட்ட தொடர்பினை பெற்றுள்ள தனிமங்கள் வேதியியல் பண்புகளில் ஒத்துள்ளன.
கருத்து வரைபடம்
இணையச்செயல்பாடு
தனிமங்களின் பண்புகள்
இந்நவீனத் தனிம அட்டவணையைப் பயன்படுத்தி, ஒரு குறிப்பிட்ட குழுமம், ஆவர்த்தனம், தொகுதி மற்றும் தனிமங்களின் பிற பண்புகளைக் காணலாம்.
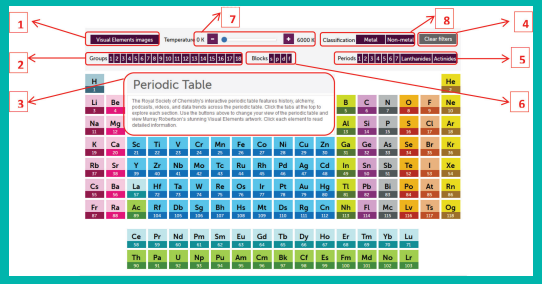
http://www.rsc.org/periodic-table/ உரலிக்குச் செல்க (அல்லது) வலது பக்கமுள்ள விரைவுத் துலக்கக் குறியீட்டினை (QR Code) ஸ்கேன் செய்க.
இணையப்பக்கத்தைத் திறந்து கொடுக்கப்பட்ட உரலியைத் (URL) தட்டச்சு செய்க அல்லது விரைவுத் துலக்கக் குறியீட்டினை ஸ்கேன் செய்க. இதில் 1 முதல் 118 வரை அணு எண் கொண்ட தனிமங்களின் ஊடாட்ட வகையிலான (interactive) நவீன ஆவர்த்தன அட்டவணையைக் காணலாம்.
தெரிவுகள்:
1. ஆவர்த்தன அட்டவணையில் ஊர்ந்து எந்தத் தனிமத்திற்கெனினும் எலக்ட்ரான் வடிவமைப்பு, அயனியாக்க ஆற்றல், அடர்த்தி போன்ற அடிப்படைத் தகவல்களைக் காட்சிப் பலகையில் (3) பெறலாம்.
2. ஏதாவது ஒரு தனிமத்தின் மீது சொடுக்கினால் அத்தனிமத்தின் அனைத்துப் பண்புகளின் பட்டியலையும் காணலாம்.
3. ஒவ்வொரு தனிமத்தின் உருவினையும் காண Visual Elements image (1)-யைச் சொடுக்குக. எந்த ஒரு தனிமத்தின் மீது உலவினாலும் அத்தனிமத்தைப் பற்றிய கூடுதல் தகவல்கள் காட்சிப் பலகையில் (3) தோன்றும்.
4. ஆவர்த்தன அட்டவணையில் உரிய தெரிவினை (8) செய்வதன் மூலம், உலோக மற்றும் அலோகங்களைக் காணலாம்
5. நழுவியைப் (7) பயன்படுத்தித் கொடுக்கப்பட்ட வெப்பநிலையில் தனிமங்களின் இயற் நிலைமையினைக் காணலாம்.
6. ஒரு குறிப்பிட்ட தொகுதியைத் (Blocks) (6) தேர்வு செய்வதன் வாயிலாக s, p, d அல்லது f தொகுதித் தனிமங்களைக் காணலாம்.
7. குறிப்பிட்ட குழு (2) அல்லது வரிசையினை (5) தெரிவு செய்வதன் வாயிலாகத் தொடர்புடைய தனிமங்களைக் காணலாம்.
8. நீக்க வடிப்பான்களை (Clear Fiters) (4) சொடுக்குவதன் வாயிலாக தங்களால் மேற்கொள்ளப்பட்ட தெரிவுகளை நீக்கலாம்.