தனிமங்களின் ஆவர்த்தன வகைப்பாடு | வேதியியல் - ஆவர்த்தன பண்புகளில் காணப்படும் ஆவர்த்தனத் தொடர்பு | 11th Chemistry : UNIT 3 : Periodic Classification of Elements
11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
ஆவர்த்தன பண்புகளில் காணப்படும் ஆவர்த்தனத் தொடர்பு
ஆவர்த்தன பண்புகளில் காணப்படும் ஆவர்த்தனத் தொடர்பு
முன்னரே விவரித்துள்ளவாறு, தனிமங்களின் அணு எண் அதிகரிக்கும் போது, அவற்றின் எலக்ட்ரான் அமைப்பில் காணப்படும் ஆவர்த்தனத் தன்மையினைப் போல, தனிமங்களின் இயற் மற்றும் வேதிப் பண்புகளிலும் ஆவர்த்தனத் தன்மை காணப்படுகிறது. இப்பாடப்பகுதியில் பின்வரும் பண்புகளில் காணப்படும் ஆவர்த்தனத் தன்மையினை நாம் கற்போம்.
1. அணு ஆரம்
2. அயனி ஆரம்
3. அயனியாக்கும் என்தால்பி (ஆற்றல்)
4. எலக்ட்ரான் நாட்டம் (எலக்ட்ரான் ஏற்கும் என்தால்பி)
5. எலக்ட்ரான் கவர் தன்மை
1. அணு ஆரம்
ஒரு அணுவின் அணு ஆரம் என்பது அதன் அணுக்கருவின் மையத்திற்கும், இணைதிற எலக்ட்ரான் உள்ள வெளிக்கூட்டிற்கும் இடையேயான தூரம் என வரையறுக்கப்படுகிறது.
ஒரு தனித்த அணுவின் ஆரத்தினை நேரடியாக அளவிட இயலாது. மந்த வாயுக்களைத் தவிர்த்து, வழக்கமாக அணு ஆரம் என்பது தொடர்புடைய அணுக்களுக்கிடையே காணப்படும் பிணைப்பின் தன்மையினைப் பொறுத்து, சகப்பிணைப்பு ஆரம் அல்லது உலோக ஆரத்தினைக் குறிப்பிடுகின்றது.
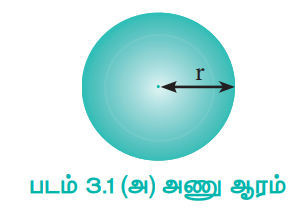
படம் 3.1 (அ) அணு ஆரம்
சகப்பிணைப்பு ஆரம்
ஒற்றை சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள இரண்டு ஒத்த அணுக்களின் அணுக்கருக்களுக்கு இடையேயான தொலைவின் பாதியளவு சகப்பிணைப்பு ஆரம் என்றழைக்கப்படுகிறது. அணுக்கருக்களுக்கு இடைப்பட்ட தொலைவு X - கதிர் விளிம்பு விளைவு ஆய்வின் மூலம் கண்டறியப்படுகிறது.
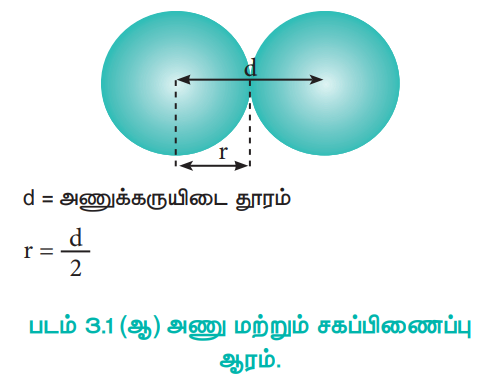
d = அணுக்கருயிடை தூரம்
r = d / 2
படம் 3.1 (ஆ) அணு மற்றும் சகப்பிணைப்பு ஆரம்
எடுத்துக்காட்டு
சோதனை மூலம் கண்டறியப்பட்ட Cl2 மூலக்கூறின் அணுக்கருயிடை தூரம், 1.98 Å.

படம் 3.1 (இ) குளோரினின் சகப்பிணைப்பு ஆரம்.
சகப்பிணைப்பு உருவாதலானது, அணு ஆர்பிட்டால்கள் மேற்பொருந்துதலை உள்ளடக்கியது. மேலும் இது அணுக்கருக்களுக்கு இடையேயானத் தொலைவினைக் குறைக்கிறது. எனவே சகப்பிணைப்பு ஆரம் என்பது, உண்மையான அணு ஆரத்தினை விட எப்போதும் குறைவான மதிப்பினைப் பெற்றிருக்கும்.
தனித்த ஒரு அணுவின் சகப்பிணைப்பு ஆரத்தினை, இரு வேறுபட்ட A மற்றும் B ஆகிய அணுக்களுக்கிடையே உள்ள அணுக்கருயிடை தூரத்திலிருந்தும் கணக்கிடலாம். இதற்கு ஷோமேக்கர் மற்றும் ஸ்டீவன்சன் முன்மொழிந்த எளிமையான முறை பின்வருமாறு
dA-B = rA + rB - 0.09 (XA − XB)
இங்கு XA மற்றும் XB என்பன முறையே ஃபாலிங் அளவீட்டில் A மற்றும் B ஆகியவற்றின் எலக்ட்ரான் கவர்தன்மை மதிப்புகளாகும். இங்கு XA > XB மற்றும் ஆரத்தின் அளவீடு Å.
சோதனை மூலம் கண்டறியப்பட்ட dH-Cl. மதிப்பான 1.28 Å -ல் இருந்து ஹைட்ரஜனின் சகப்பிணைப்பு ஆரத்தினை நாம் கணக்கிடுவோம். குளோரினின் சகப்பிணைப்பு ஆரம் 0.99 Å ஃபாலிங் அளவீட்டில், குளோரின் மற்றும் ஹைட்ரஜன் ஆகியவற்றின் எலக்ட்ரான் கவர்தன்மை மதிப்புகள் முறையே 3 மற்றும் 21 ஆகும்.
dн-Cl = rH + rCl - 0.09 (XCl – XH)
1.28 = rH + 0.99 – 0.09 (3 – 2.1)
1.28 = rH + 0.99 – 0.09 (0.9)
1.28 = rH + 0.99 – 0.081
1.28 = rH + 0.909
∴rH = 1.28 - 0.909 = 0.371 Å
உலோக ஆரம்
நெருங்கி பொதிந்து அமைந்துள்ள உலோகப் படிகத்தில், அருகருகே அமைந்துள்ள இரு உலோக அணுக்களுக்கு இடைப்பட்டத் தொலைவின் சரிபாதியளவு உலோக ஆரம் என வரையறுக்கப்படுகிறது.
எடுத்துக்காட்டாக, தாமிர (Copper) உலோகத்தில், அடுத்தடுத்து அருகே அமைந்துள்ள தாமிர (Copper) அணுக்களுக்கு இடைப்பட்டத் தொலைவு 2.56 Å. எனவே தாமிரத்தின் (Copper) உலோக ஆரம்
2.56 / 2 = 1.28 Å
உலோகப் படிகத்தின், அலகு கூட்டின் நீளத்தினைப் பயன்படுத்தி உலோக ஆரத்தினை கணக்கிட இயலும். Xll -ம் வகுப்பின் திட நிலைமை பாடத்தில் இது பற்றிய விரிவான கணக்கீட்டினை நீங்கள் கற்பீர்கள்.
அணு ஆரத்தில் காணப்படும் ஆவர்த்தனத் தொடர்பு
வரிசையில் ஏற்படும் மாறுபாடு (Variation in Periods)
ஒரு வரிசையில் செல்லும் போது அணு ஆரம் குறைகிறது. ஒரு வரிசையில் இடமிருந்து வலமாகச் செல்லும் போது, இணைதிற எலக்ட்ரான்கள் ஒரே கூட்டில் சேர்க்கப்படுகின்றன. அதே நேரத்தில் அணுக்கருவில் சேர்க்கப்படும் புரோட்டான், அணுக்கருவின் மின்சன்மையினை அதிகரிப்பதுடன் இணைதிற எலக்ட்ரான்களுக்கும், அணுக்கருவிற்கும் இடையேயான கவர்ச்சி விசையினையும் அதிகரிக்கின்றது. எனவே, ஒரு வரிசையில் செல்லும்போது அணு ஆரம் குறைகிறது.
செயலுறு அணுக்கரு மின்சுமை (effective nuclear charge)
எலக்ட்ரான்களுக்கும், அணுக்கருவிற்கும் இடையே நிலை மின்னியல் கவர்ச்சி விசைக் காணப்படுகிறது. இக்கவர்ச்சி விசை மட்டும் அல்லாமல், எலக்ட்ரான்களுக்கிடையே விலக்கு விசையும் காணப்படுகிறது. உள்கூட்டில் காணப்படும் எலக்ட்ரான்களுக்கும், இணைதிற கூட்டில் உள்ள எலக்ட்ரான்களுக்கும் இடையேயான இந்த விலக்கு விசையின் விளைவாக வெளிக்கூட்டில் உள்ள இணைதிற எலக்ட்ரான்கள் மீது, அணுக்கருவினால் செலுத்தப்படும் கவர்ச்சி விசை குறைக்கப் படுகின்றது. எனவே, உட்கூட்டில் உள்ள எலக்ட்ரான்கள், அணுக்கருவிற்கும், இணைதிற எலக்ட்ரான்களுக்கும் இடையே ஒரு திரை போல செயல்படுகிறது. இவ்விளைவு திரைமறைப்பு விளைவு (Screening effect) என்றழைக்கப்படுகிறது. வெளிக்கூட்டில் உள்ள இணைதிற எலக்ட்ரான்களால் உணரப்படும் நிகர அணுக்கரு மின்சுமை செயலுறு அணுக்கரு மின்சுமை (effective nuclear charge) என்றழைக்கப்படுகின்றது. செயலுறு அணுக்கரு மின்சுமையானது பின்வரும் சமன்பாட்டால் தோராயமாக கணக்கிடப்படுகிறது.
Zசெயலுறு = Z - S
இங்கு, Z என்பது அணு எண் மற்றும் S என்பது திரைமறைப்பு மாறிலி. இம்மாறிலியைக் கீழே விவரிக்கப்பட்டுள்ள, ஸ்லேட்டர் விதிகளைப் பயன்படுத்தி. கணக்கிடலாம்.
படி 1
முதலில் கொடுக்கப்பட்ட அணுவின் எலக்ட்ரான் அமைப்பினை எழுதவும். பிறகு ns மற்றும் np ஆர்பிட்டால்களை ஒரே தொகுதியாகவும், பிற ஆர்பிட்டால்களை தனி தொகுதிகளாகவும் பின்வரும் அமைப்பில் எழுதவும்.
(1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d) (4f) (5s, 5p)...
படி 2
செயலுறு அணுக்கரு மின்சுமை கண்டறிய வேண்டிய எலக்ட்ரான் அமைந்துள்ள தொகுதியினை இனம் கண்டறியவும். இதற்கு வலப்புறம் அமைந்துள்ள தொகுதிகளில் காணப்படும் எலக்ட்ரான்கள் திரைமறைப்பு விளைவிற்கு காரணமாக அமைவதில்லை.
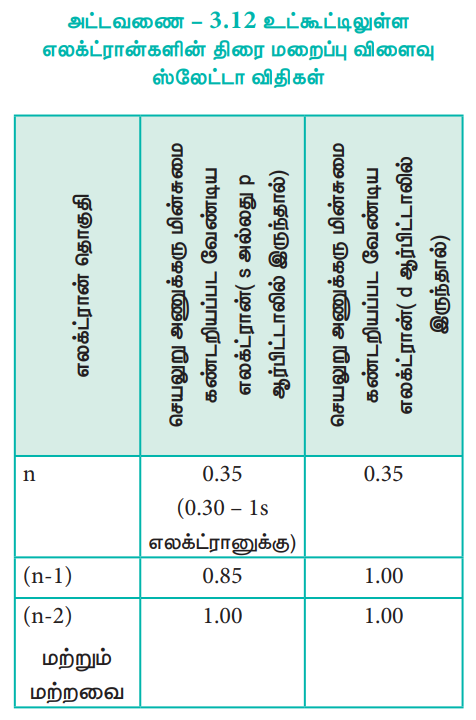
இனம் கண்டறியப்பட்ட தொகுதியில் (n என்ற எழுத்தால் குறிக்கப்படுகிறது) உள்ள எலக்ட்ரான்கள் ஒவ்வொன்றும் 0.35 அலகு அணுக்கரு மின்சுமையை மறைக்கின்றன. எனினும் 1s எலக்ட்ரான்களுக்கு இதன் மதிப்பு 0.30 அலகு ஆகும்.
படி 3
உட்கூட்டிலுள்ள எலக்ட்ரான்களின் மறைத்தல்
செயலுறு அணுக்கரு மின்சுமை கண்டறியப்பட வேண்டிய எலக்ட்ரான் s அல்லது p ஆர்பிட்டாலில் இருந்தால்,
i. (n - 1) தொகுதியில் உள்ள ஒவ்வொரு எலக்ட்ரான்களும் 0.85 அலகு அணுக்கரு மின்சுமையினை மறைக்கின்றன.
ii. (n - 2) தொகுதி அல்லது அதனை விடக்குறைவான (n - 3), (n - 4) போன்ற தொகுதிகளில் உள்ள ஒவ்வொரு எலக்ட்ரானும் முழுமையாக மறைக்கின்றன. அதாவது 1 அலகு அணுக்கரு மின் சுமையினை மறைக்கின்றன.
செயலுறு அணுக்கரு மின்சுமை கண்டறியப்பட வேண்டிய எலக்ட்ரான் d அல்லது f ஆர்பிட்டாலில் இருந்தால், அந்த எலக்ட்ரான் அமைந்துள்ள தொகுதிக்கு இடப்புறம் உள்ள தொகுதிகளில் காணப்படும் எலக்ட்ரான்கள் 1 அலகு அணுக்கரு மின்சுமையினை மறைக்கின்றன.
படி 4
அனைத்து எலக்ட்ரான்களின் திரைமறைப்பு விளைவு மதிப்புகளின் கூடுதல் திரைமறைப்பு மாறிலி 'S' ஐத் தருகின்றது.
அட்டவணை – 3.12 உட்கூட்டிலுள்ள எலக்ட்ரான்களின் திரை மறைப்பு விளைவு ஸ்லேட்டா விதிகள்
எடுத்துக்காட்டு
ஸ்கேன்டியத்தில் உள்ள 3d எலக்ட்ரான் மற்றும் 4s எலக்ட்ரானின் மீதான செயலுறு அணுக்கரு மின்சுமையின் மதிப்பினைக் கணக்கிடுதலை நாம் விளக்குவோம். ஸ்கேன்டியத்தின் எலக்ட்ரான் அமைப்பு 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1, இதனை பின்வருமாறு மாற்றியமைக்கலாம்.
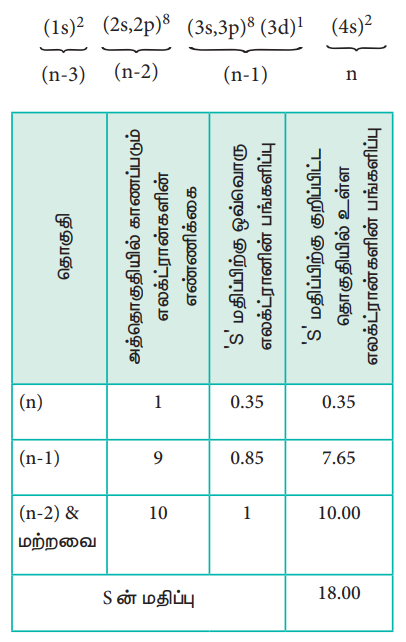
Zசெயலுறு = Z - S
Zசெயலுறு = 21 - 18
Zசெயலுறு = 3
3d1 எலக்ட்ரான் மீதான செயலுறு அணுக்கரு மின்சுமையினைக் கணக்கிடுதல்
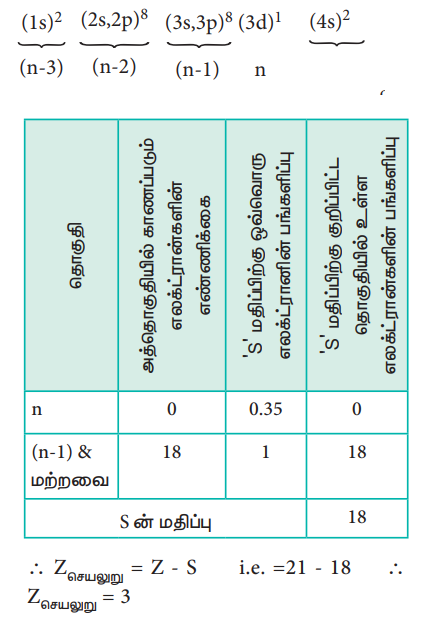
∴ Zசெயலுறு = Z – S
i.e. = 21 – 18
∴ Zசெயலுறு = 3
அட்டவணை 3.13 இரண்டாம் வரிசை தனிமங்களின் அணு ஆரம் (சகப்பிணைப்பு ஆரம்)
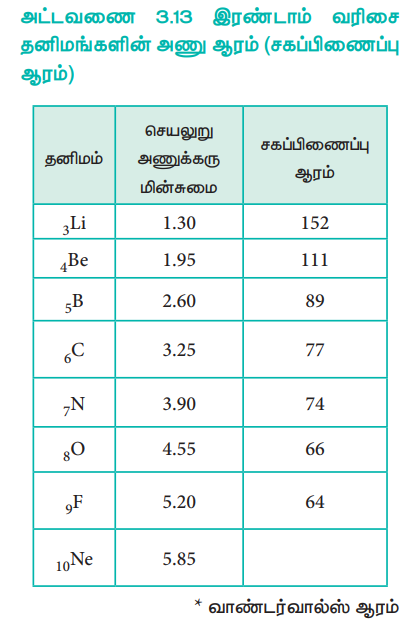
● வாண்டர்வால்ஸ் ஆரம்
தன்மதிப்பீடு
4) அலுமினியம் மற்றும் குளோரினின் 3p எலக்ட்ரான் மீதான செயலுறு அணுக்கரு மின்சுமையின் மதிப்பினை ஸ்லேட்டர் விதிகளைப் பயன்படுத்தி கண்டறிக. இதன் முடிவுகள் இவ்விரு அணுக்களின் அயனி ஆரங்களோடு எவ்விதத்தில் தொடர்பு கொண்டுள்ளன என்பதை விவரி.
தீர்வு
13A1 ன் எலக்ட்ரான் அமைப்பு
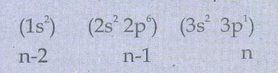
S = (2 × 0.35) + (8 × 0.85) + (2×1)
= 9.5
= Z−S
Zசெயலுறு = 13 − 9.5
= 3.5
17Cl ன் எலக்ட்ரான் அமைப்பு
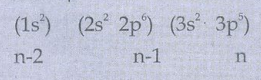
S = (6 × 0.35) + (8 × 0.85) + (2 × 1)
= 10.9
= 17 − 10.9.
Zசெயலுறு = 6.1
• குளோரின் Zசெயலுறு மதிப்பு அலுமினியத்தின் Zசெயலுறு மதிப்பை விட அதிகமாக உள்ளதால் குளோரினின் ஆரம் அலுமினியத்தின் ஆரத்தை விட குறைவாக காணப்படும்.
தொகுதியில் ஏற்படும் மாறுபாடுகள் (variation in group)
தனிம வரிசை அட்டவணையில், ஒரு தொகுதியில் மேலிருந்து கீழாக அணு ஆரம் அதிகரிக்கின்றது. ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும் போது, புதிதாகச் சேர்க்கப்படும் இணைதிற எலக்ட்ரான்கள் இடம்பெறும் பொருட்டு, புதிய கூடுகள் உருவாக்கப்படுகின்றன. இதன் காரணமாக, அணுக்கருவின் மையத்திற்கும், இணைதிற எலக்ட்ரான்கள் காணப்படும் வெளிக்கூட்டிற்கும் இடையேயான தொலைவு அதிகரிக்கின்றது. எனவே அணு ஆரம் அதிகரிக்கின்றது. ஒரு தொகுதியில் கார உலோகங்களின் அணு ஆரங்களின் மாறுபாடு பின்வருமாறு
அட்டவணை 3.14 தொகுதி – 1 தனிமங்களின் சகப்பிணப்பு ஆரங்களின் மாறுபாடுகள்
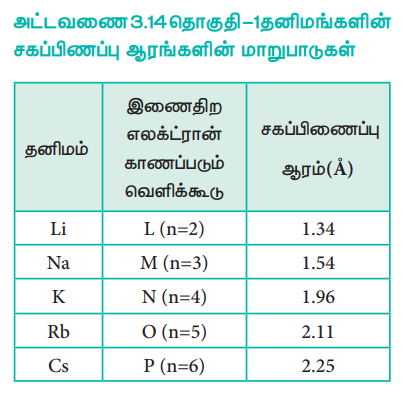
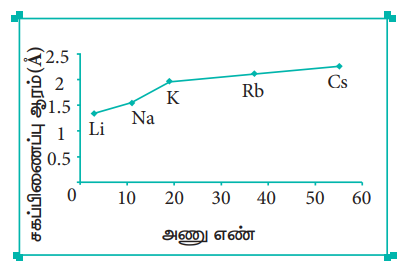
செயல்பாடு 3.1
பல்வேறு தொகுதிகள் மற்றும் வரிசைகளைச் சார்ந்த சில தனிமங்களின் சகப்பிணைப்பு ஆரம் (Å - ல்) பின்வருமாறு அட்டவணையிடப்பட்டுள்ளது. இம் மதிப்புகளை அவற்றின் அணு எண்ணிற்கு எதிராக வரைபடத்தில் குறிக்க. இவ்வரைபடத்தில் இருந்து ஒரு தொகுதி மற்றும் தொடரில் ஏற்படும் மாறுபாடுகளை விளக்குக.
2 ஆம் தொகுதி தனிமங்கள் Be (0.89), Mg (1.36), Ca (1.74), Sr (1.91) Ba (1.98)
17 ஆம் தொகுதி தனிமங்கள் F (0.72), Cl (0.99), Br (1.14), I (1.33)
3 ஆம் வரிசை தனிமங்கள் Na (1.57), Mg (1.36), Al (1.25), Si (1.17), P (1.10), S (1.04), Cl (0.99)
நான்காம் வரிசை தனிமங்கள் :
K (2.03), Ca (1.74), Sc (1.44), Ti (1.32), V (1.22), Cr (1.17), Mn (1.17), Fe (1.17), Co (1.16), Ni (1.15), Cu (1.17), Zn (1.25), Ga (1.25), Ge (1.22), As (1.21), Se (1.14), Br (1.14)
2. அயனி ஆரம்
ஒரு அயனியின் அணுக்கருவின் மையத்திற்கும், அவ்வயனியின் எலக்ட்ரான் திரள்முகில் (electron cloud) மீது அதன் அணுக்கருவால் கவர்ச்சி விசையினை செலுத்த இயலும் தூரத்திற்கும் இடையிலான தொலைவு அயனி ஆரம் என வரையறுக்கப்படுகிறது. நேரயனி மற்றும் எதிரயனி ஆகியவற்றிற்கு இடையேயான அயனி இடைத் தொலைவினைக் கொண்டு பாலிங் முறைப்படி, ஒற்றை மின்சுமையுடைய படிகங்களின் அயனி ஆரங்களை கணக்கிடலாம்.
படிக அலகுக்கூட்டில் காணப்படும் அயனிகள் கோள வடிவமுடையவை என பாலிங் கருதினர். மேலும் அவைகள் ஒன்றையொன்று தொட்டுக் கொண்டிருப்பதாகவும் கருதினார். எனவே,
d = rc+ + rA- - - - - - - - - - - (1)
இங்கு d என்பது நேர் அயனி C+ ன் அணுக்கருவிற்கும், எதிர் அயனி A- ன் அணுக்கருவிற்கும் இடையேயானத் தொலைவு ஆகும். rc+ மற்றும் rA-ஆகியன முறையே நேர் மற்றும் எதிர் அயனிகளின் ஆரங்களாகும்.
மேலும், மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பினைப் (எடுத்துக்காட்டாக Na+ மற்றும் F- அயனிகள் 1s2 2s2 2p6 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளன) பெற்றுள்ள அயனிகளின் ஆரமானது, அவ்வயனிகள் மீது அணுக்கருவால் செலுத்தப்படும் செயலுறு அணுக்கருமின்சுமைக்கு எதிர்விகிதத்தில் அமையும். அதாவது,
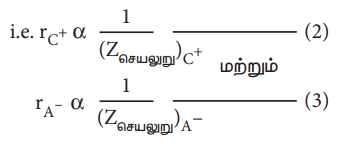
இங்கு Zசெயலுறு என்பது செயலுறு அணுக்கரு மின்சுமைக்குச் சமம். Zசெயலுறு = Z - S
சமன்பாடு (2) ஐ (3) ஆல் வகுக்க,
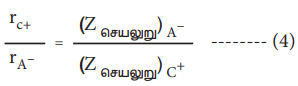
சமன்பாடு (1) மற்றும் (4) ஐத் தீர்ப்பதன் மூலம் rc+ மற்றும் rA- மதிப்புகளைப் பெற இயலும்.
NaF படிகத்திலுள்ள Na+ மற்றும் F- அயனிகளின் ஆரங்களைக் கணக்கிடுவதன் மூலம் இம்முறையினை நாம் விளக்கலாம். NaF படிகத்தின் அயனி இடைத் தொலைவு 231 pm ஆகும்,
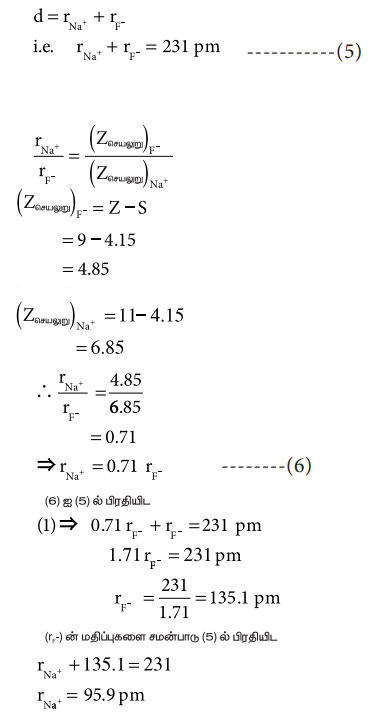
rNa+ + 135.1 = 231
rNa+ = 95.9 pm
தன்மதிப்பீடு
5) X3+, Y2+ மற்றும் Z- ஆகிய சம எலக்ட்ரான்களைக் கொண்ட அயனிகளின் ஆரங்கள் முறையே 136 pm, 64 pm, 49 pm என ஒரு மாணவர் அறிக்கை அளித்தார். இந்த வரிசை சரியானதா? குறிப்புரை தருக.
தீர்வு
• X3+, Y2+ மற்றும் Z− ஆகிய சம எலக்ட்ரான்களைக் கொண்ட அயனிகள் என்பதால் அவற்றின் செயலுறு மின் சுமை பின்வருமாறு குறைகிறது.
(Zசெயலுறு) X3+ > (Zசெயலுறு)Y2+ (Zசெயலுறு) Z−
• செயலுறு மின்சுமை அதிகம் எனில் ஆரம் குறைவாக காணப்படும். எனவே அயனி ஆரத்தின் சரியான வரிசை

3. அயனியாக்கும் ஆற்றல்
இயல்பு ஆற்றல் நிலையில் (சிறும ஆற்றல் நிலையில் - ground state) உள்ள நடுநிலைத்தன்மை உடைய தனித்த வாயு நிலை அணு ஒன்றின் இணைதிற கூட்டிலிருந்து இலகுவாக பிணைக்கப்பட்டுள்ள ஒரு எலக்ட்ரானை நீக்குவதற்கு தேவைப்படும் குறைந்தபட்ச ஆற்றல் அயனியாக்கும் ஆற்றல் எனப்படும். இது KJmol-1 அல்லது eV என்ற அலகால் குறிப்பிடப்படுகின்றது.
M(g) + IE1 → M+(g) + 1 e-
இங்கு, IE1 என்பது முதலாவது அயனியாக்கும் ஆற்றலைக் குறிப்பிடுகிறது.
அடுத்தடுத்த அயனியாக்கும் ஆற்றல்கள் (Successive ionization energies)
ஒரு ஒற்றை நேர்மின்சுமையுடைய அயனியிலிருந்து, ஒரு எலக்ட்ரானை நீக்குவதற்கு தேவைப்படும் குறைந்தபட்ச ஆற்றல் இரண்டாம் அயனியாக்கும் ஆற்றல் எனப்படும். இது பின்வரும் சமன்பாட்டால் குறிப்பிடப்படுகிறது.
M+(g) + IE2 → M2+(g) + 1 e-
இதைப் போலவே, நாம் மூன்றாம், நான்காம் அயனியாக்கும் ஆற்றல்களை வரையறுக்கலாம்.
ஒரு நேர்மின் சுமையுடைய அயனியில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கையானது, அதன் நடுநிலை அணுவில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கையைவிட குறைவாக இருந்தபோதிலும் அவைகளின் அணுக்கரு மின்சுமை சமமாக இருக்கும். எனவே, நேர்மின்சுமையுடைய அயனியின் செயலுறு அணுக்கருகவர்ச்சி விசையானது, தொடர்புடைய நடுநிலை அணுவின் செயலுறு கவர்ச்சி விசையினை விட அதிகம். எனவே தொடர்ச்சியான அயனியாக்கும் ஆற்றலின் மதிப்புகள், எப்போதும் பின்வரும் ஏறுவரிசையில் அமைகின்றன.
IE1 < IE2 < IE3 < ….
அயனியாக்கும் ஆற்றலில் காணப்படும் ஆவர்த்தனத் தன்மை.
ஒரு சில விதிவிலக்குகளைத் தவிர்த்து, பொதுவாக அயனியாக்கும் ஆற்றல், ஒரு வரிசையில் அதிகரிக்கின்றது. முன்னரே விவரித்தவாறு, ஒரு வரிசையில் இடமிருந்து வலமாகச் செல்லும் போது, இணைதிற எலக்ட்ரான்கள் ஒரே கூட்டில் சேர்க்கப்படும் நிலையில், அணுக்கருவில் புரோட்டான்கள் சேர்க்கப்படுகின்றன. இவ்வாறு தொடர்ச்சியாக அணுக்கருவின் மின்சுமை அதிகரிப்பதால், இணைதிற எலக்ட்ரான்கள் மீதான கவர்ச்சி விசையும் அதிகரிக்கின்றது. மேலும் இணைதிற எலக்ட்ரானை நீக்க தேவைப்படும் ஆற்றல் அதிகரிப்பதால் அயனியாக்கும் ஆற்றலும் அதிகரிக்கிறது.
இரண்டாம் வரிசை தனிமங்களின் அயனியாக்கும் ஆற்றலில் ஏற்படும் மாறுபாடுகளை நாம் கருதுவோம். அணு எண்ணிற்கு எதிரான அயனியாக்கும் ஆற்றல் மதிப்பின் வரைபடம் கீழே கொடுக்கப்பட்டுள்ளது.
பின்வரும் வரைபடத்தில், அயனியாக்கும் ஆற்றலின் வழக்கமான போக்கில், இரு மாறுபாடுகள் காணப்படுகின்றன. பெரிலியத்தினைக் காட்டிலும் போரான் அதிகமான அணுக்கரு மின் சுமையினைப் பெற்றிருப்பதால், போரானின் அயனியாக்கும் ஆற்றல் மதிப்பு அதிகம் என எதிர்பார்க்கப்படுகிறது. ஆனால் எதிர்பார்த்தலுக்கு முரணாக பெரிலியம் மற்றும் போரான் அணுக்களின் அயனியாக்கும் ஆற்றல்கள் முறையே 899 மற்றும் 800 kJ mol-1 ஆகும்.
சிறும ஆற்றல் நிலையில், பெரிலியம் (Z = 4) 1s2, 2s2 எலக்ட்ரான் அமைப்பினையும், போரான் (Z = 5) 1s2 2s2 2p1 என்ற எலக்ட்ரான் அமைப்பினையும் பெற்றுள்ளன.
பெரிலியம் முழுவதும் நிரப்பப்பட்ட 2s ஆர்பிட்டாலைப் பெற்றுள்ளதால், பகுதியளவு நிரப்பப்பட்ட இணைதிற கூடு எலக்ட்ரான் அமைப்பை பெற்றுள்ள (2s22p1) போரானைக் காட்டிலும் அதிக அளவு நிலைப்புத்தன்மை உடையது. இதன் காரணமாக பெரிலியத்தின் அயனியாக்கும் ஆற்றல் அதிகம்.
படம் 3.2 வரிசை 2-ல் தனிமங்களின் அயனியாக்கும் ஆற்றலில் ஏற்படும் மாறுபாடு
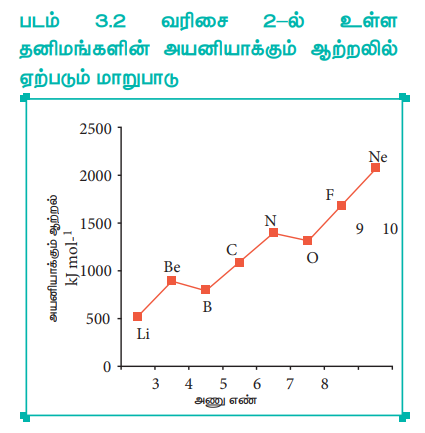
இதைப் போலவே, 1s2 2s2 2p3 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள நைட்ரஜனின் அயனியாக்கும் ஆற்றல். (1402 k.Jmol-1), 1s2 2s2 2p4 என்ற எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள ஆக்சிஜனின் அயனியாக்கும் ஆற்றல் (1314 kJmol-1) மதிப்பைக் காட்டிலும் அதிகம். ஏனெனில் சரிபாதியளவு நிரப்பப்பட்ட எலக்ட்ரான் அமைப்பு அதிக நிலைப்புத் தன்மையுடையது. ஆதலால், நைட்ரஜனின் 2p ஆர்பிட்டாலிலிருந்து, ஒரு எலக்ட்ரானை நீக்குவதற்கு அதிக ஆற்றல் தேவைப்படுகிறது. ஆனால், ஆக்சிஜனின் 2p ஆர்பிட்டாலில் உள்ள ஒரு எலக்ட்ரானை நீக்குவதால், அது சரிபாதியளவு நிரப்பப்பட்ட நிலையான எலக்ட்ரான் அமைப்பினைப் பெறுகிறது. இதன் விளைவாக நைட்ரஜனோடு ஒப்பிடும் போது ஆக்சிஜனில் 2p எலக்ட்ரானை நீக்குவது எளிதாகிறது.
தொகுதியில் ஏற்படும் ஆவர்த்தன மாறுபாடுகள்
ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும் போது அயனியாக்கும் ஆற்றல் குறைகிறது. தொகுதியில் மேலிருந்து வரும் போது, இணைதிற எலக்ட்ரான்கள் புதிய கூட்டில் சேர்கின்றன. அணுக்கருவிற்கும் இணைதிற எலக்ட்ரான்களுக்கும் இடையேயானத் தொலைவு அதிகரிக்கின்றது. எனவே இணைதிற எலக்ட்ரான்கள் மீதான அணுக்கருவின் கவர்ச்சி விசை குறைகின்றது. இதன் காரணமாக ஒரு தொகுதியில் மேலிருந்து கீழே செல்லும் போது அயனியாக்கும் ஆற்றல் குறைகிறது.
அயனியாக்கும் ஆற்றல் மற்றும் மறைத்தல் விளைவு
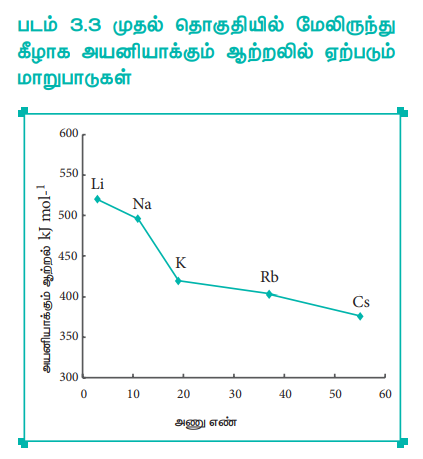
ஒரு தொகுதியில் மேலிருந்து கீழாக செல்லும் போது, உட்கூட்டில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை அதிகரிக்கின்றது. இதன் காரணமாக உட்கூட்டில் உள்ள எலக்ட்ரான்களுக்கும் இணைதிற எலக்ட்ரான்களுக்கும் இடையேயான விலக்கு விசையும் அதிகரிக்கின்றது. அதாவது உள்கூட்டில் உள்ள எலக்ட்ரான்களின் மறைத்தல் விளைவு அதிகரிப்பதனால், அணுக்கருவினால், இணைதிற எலக்ட்ரான்கள் மீது செலுத்தப்படும் கவர்ச்சி விசை குறைகிறது. எனவே, அயனியாக்கும் ஆற்றலும் குறைகிறது. அயனியாக்கும் ஆற்றலின் இத்தகைய போக்கினை கார உலோகங்களை எடுத்துக்காட்டாகக் கொண்டு நாம் புரிந்து கொள்வோம்.
படம் 3.3 முதல் தொகுதியில் மேலிருந்து கீழாக அயனியாக்கும் ஆற்றலில் ஏற்படும் மாறுபாடுகள்
தன்மதிப்பீடு
6. X, Y மற்றும் Z ஆகிய தனிமங்களின் முதல் அயனியாக்கும் ஆற்றல் (IE1) மற்றும் இரண்டாம் அயனியாக்கும் ஆற்றல் (IE2) ஆகியன முறையே கீழே கொடுக்கப்பட்டுள்ளன.
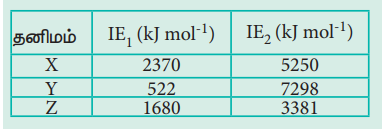
மேற்கண்ட தனிமங்களுள் அதிக வினைபுரியும் உலோகம் எது? மந்த வாயு எது? குறைவாக வினைபுரியும் உலோகம் எது?
தீர்வு
எத்தனிமம் மிக குறைந்த முதல் அயனியாக்கும் ஆற்றலை பெற்றுள்ளதோ அத்தனிமமே மிக அதிக வினைபுரியும் திறன் கொண்டதாகும். எனவே தனிமம் Y அதிக வினைபுரியும் உலோகம் ஆகும்.
தனிமம் X மிக அதிகமான முதல் அயனியாகும் ஆற்றலை பெற்றுள்ளது எனவே X என்பது மந்த வாயுவாகும்.
தனிமம் Z ன் முதல் அயனியாக்கும் ஆற்றல் Y ஐ விட அதிகம். எனவே தனிமம் Z ன் வினைபுரியும் திறன் தனிமம் Y ஐ விட குறைவு.
4. எலக்ட்ரான் நாட்டம்
இயல்பு ஆற்றல் நிலையில் உள்ள ஒரு தனித்த நடுநிலைத்தன்மை உடைய, வாயுநிலை அணு ஒன்றின் இணைதிற கூட்டில் ஒரு எலக்ட்ரானை சேர்த்து அதன் எதிர் அயனியை உருவாக்கும் போது வெளிப்படும் ஆற்றல் (மந்த வாயுக்களைப் பொருத்த வரையில் தேவைப்படும் ஆற்றல்) எலக்ட்ரான் நாட்டம் எனப்படும். இது kJmol-1 என்ற அலகால் குறிப்பிடப்படுகின்றது.
A + 1 e- → A- + EA
ஒரு வரிசையில் ஏற்படும் எலக்ட்ரான் நாட்டத்தின் மாறுபாடுகள்
அயனியாக்கும் ஆற்றலில் காணப்படுவதைப் போன்று எலக்ட்ரான் நாட்டத்தில் சீரான மாற்றம் காணப்படுவதில்லை. ஒருவரிசையில், கார உலோகத்திலிருந்து ஹாலஜன்களை நோக்கிச் செல்லும் போது, பொதுவாக எலக்ட்ரான் நாட்டம் அதிகரிக்கின்றது அதாவது வெளிப்படும் ஆற்றலின் மதிப்பு அதிகமாக இருக்கும். அணுவின் உருவளவு சிறிதாவதும், அணுக்கரு மின்சுமை அதிகரிப்பதுமே இதற்கு காரணமாகும். எனினும் பெரிலியம் (1s2 2s2) நைட்ரஜன் (1s2 2s2 2p3) போன்ற தனிமங்களில் ஒரு எலக்ட்ரான் சேர்க்கப்படும் நிலையில், அவற்றின் அதிக நிலைப்புத் தன்மையுடைய எலக்ட்ரான் அமைப்பு இழக்கப்படும் நிலை ஏற்படும். எனவே இத்தகைய தனிமங்கள் ஏறத்தாழ பூஜ்ஜிய எலக்ட்ரான் நாட்ட மதிப்பினைப் பெற்றுள்ளன.
படம் 3.4. இரண்டாம் வரிசை தனிமங்களின் எலக்ட்ரான் நாட்டத்தில் ஏற்படும் மாறுபாடுகள்.
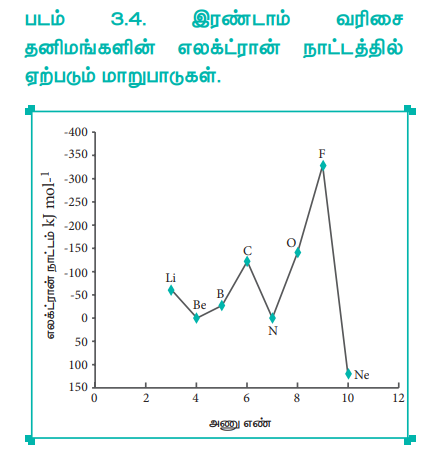
மந்த வாயுக்கள் ns2, np6 என்ற முழுவதும் நிரப்பப்பட்ட நிலையான எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளன. எனவே கூடுதலாக ஓர் எலக்ட்ரானை சேர்த்தல் சாதகமானதல்ல. மேலும் அந்நிகழ்விற்கு அதிக ஆற்றல் தேவைப்படும். ns2, np5 என்ற எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள ஹாலஜன்கள் எளிதில் ஒரு எலக்ட்ரானை ஏற்றுக்கொண்டு நிலையான ns2 np6 எலக்ட்ரான் அமைப்பினை பெறுவதால், ஒவ்வொரு வரிசையிலும், ஹாலஜன்கள் அதிக எலக்ட்ரான் நாட்ட மதிப்பினைப் (அதிக எதிர்குறி மதிப்புகள்) பெற்றுள்ளன.
ஒரு தொகுதியில் ஏற்படும் எலக்ட்ரான் நாட்டத்தின் மாறுபாடுகள்
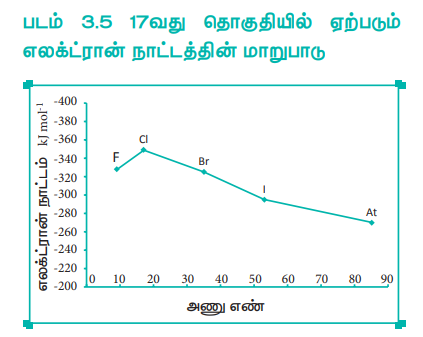
ஒரு தொகுதியில் மேலிருந்து கீழாக வரும்போது பொதுவாக எலக்ட்ரான் நாட்டத்தின் மதிப்பு குறைகிறது. அணுபருமன் மற்றும் உள்கூட்டில் உள்ள எலக்ட்ரான்களின் திரைமறைப்பு விளைவு ஆகியவை அதிகரிப்பதே இதற்குக் காரணமாகும். எனினும், ஆக்சிஜன் மற்றும் புளூரின் ஆகியன முறையே சல்பர் மற்றும் குளோரினைக் காட்டிலும் குறைவான எலக்ட்ரான் நாட்ட மதிப்பினைப் பெற்றுள்ளன. ஆக்சிஜன் மற்றும் புளூரினின் உருவளவு ஒப்பீட்டளவில் சிறியது. எனவே அவைகள் அதிக எலக்ட்ரான் அடர்த்தியைக் கொண்டுள்ளன. மேலும், சேர்க்கப்படும் கூடுதல் எலக்ட்ரான் ஆக்சிஜன் மற்றும் புளூரினில் 2p ஆர்பிட்டாலில் சென்று சேரவேண்டும். இந்த 2p ஆர்பிட்டாலானது சல்பர் மற்றும் குளோரினின் 3p ஆர்பிட்டாலுடன் ஒப்பிடும் போது நெருக்கமான அமைப்பினைப் பெற்றுள்ளது. எனவே, ஆக்சிஜன் மற்றும் புளூரினானது முறையே அவைகள் இடம்பெற்றுள்ள தொகுதியில் அடுத்து உள்ள தனிமங்களான சல்பர் மற்றும் குளோரினைக் காட்டிலும் குறைவான எலக்ட்ரான் நாட்ட மதிப்புகளைப் பெற்றுள்ளன.
படம் 3.5 17வது தொகுதியில் ஏற்படும் எலக்ட்ரான் நாட்டத்தின் மாறுபாடு
தன்மதிப்பீடு
7. குளோரினின் எலக்ட்ரான் ஏற்கும் என்தால்பி மதிப்பு 348 kJ mol-1 வாயுநிலையில் உள்ள 17.5g குளோரின் அணுக்கள் முழுவதும் Cl- அயனியாக மாற்றப்படும் போது வெளியிடப்படும் ஆற்றலின் மதிப்பினை kJ ல் கணக்கிடுக.
தீர்வு
Cl(g) + e− → Cl−(g) ∆H = 348 kJ mol−1
ஒரு மோல் (35.5g) குளோரின் 348 kJ ஆற்றலை வெளியிடுகிறது.
ஃ17.75g குளோரின்,
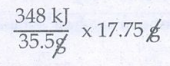 ஆற்றலை வெளியிடுகிறது.
ஆற்றலை வெளியிடுகிறது.
ஃ வெளிப்பட்ட ஆற்றலின் அளவு = 348/2 = 174 kJ
5. எலக்ட்ரான் கவர்தன்மை
சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள மூலக்கூறில் உள்ள ஒரு அணுவானது, சகப்பிணைப்பில் பங்கிடப்பட்டுள்ள எலக்ட்ரான் இணையினைத் தன்னை நோக்கி ஒப்பீட்டு அளவில் கவரும் பண்பு எலக்ட்ரான் கவர்தன்மை எனப்படும்.
எலக்ட்ரான் கவர்தன்மை ஒரு அளவிடத்தக்க பண்பு அல்ல எனினும் இம்மதிப்பினைக் கணக்கிட பல்வேறு அளவீட்டு முறைகள் உள்ளன. அதில் ஒரு முறை ஃபாலிங் என்பவரால் உருவாக்கப்பட்டது. அவர் ஹைட்ரஜன் மற்றும் புளூரினுக்கு முறையே 2.1 மற்றும் 4.0 என்ற மதிப்புகளை அவைகளினுடைய எலக்ட்ரான் கவர்திறன் மதிப்புகள் என எடுத்துக்கொண்டார். இதனடிப்படையில் பிற தனிமங்களுக்கு பின்வரும் வாய்ப்பாட்டினைப் பயன்படுத்தி எலக்ட்ரான் கவர்திறன் மதிப்புகளை கண்டறியலாம்.
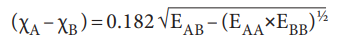
இங்கு, EAB, EAA மற்றும் EBB ஆகியன முறையே AB, A2 (A - A) மற்றும் B2 (B - B) ஆகிய மூலக்கூறுகளின் பிணைப்பு பிளவு ஆற்றல்கள் (K cal) ஆகும்.
கொடுக்கப்பட்ட எந்த ஒரு தனிமத்தின் எலக்ட்ரான் கவர்திறன் மதிப்பும் மாறிலியல்ல இதன் மதிப்பு அத்தனிமம் எத்தனிமத்துடன் சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ளது என்பதனைப் பொறுத்து அமையும். பிணைப்பின் தன்மையினைத் தீர்மானிப்பதில் எலக்ட்ரான் கவர் தன்மை மதிப்புகள் முக்கிய பங்காற்றுகின்றன.
ஒரு வரிசையில் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் மாறுபாடு
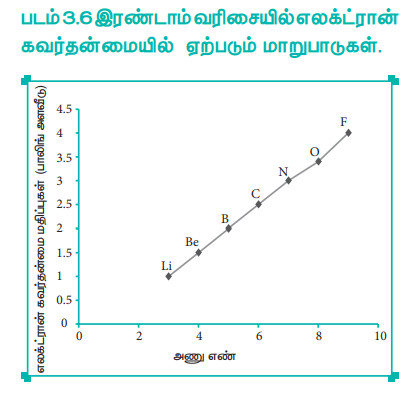
இடமிருந்து வலமாகச் செல்லும் போது பொதுவாக எலக்ட்ரான் கவர் தன்மை மதிப்பு அதிகரிக்கின்றது. முன்னரே விவரித்துள்ளவாறு, ஒரு வரிசையில், அணுக்கருவிற்கும், இணைதிற எலக்ட்ரான்களுக்கும் இடையேயான கவர்ச்சி விசை அதிகரிப்பதால் அணு ஆரம் குறைகிறது. எனவே, பங்கிடப்பட்டுள்ள எலக்ட்ரான்களை கவரும் தன்மை அதிகரிக்கிறது. இதன் காரணமாக ஒரு வரிசையில் எலக்ட்ரான் கவர்தன்மை அதிகரிக்கின்றது.
படம் 3.6 இரண்டாம் வரிசையில் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் மாறுபாடுகள்.
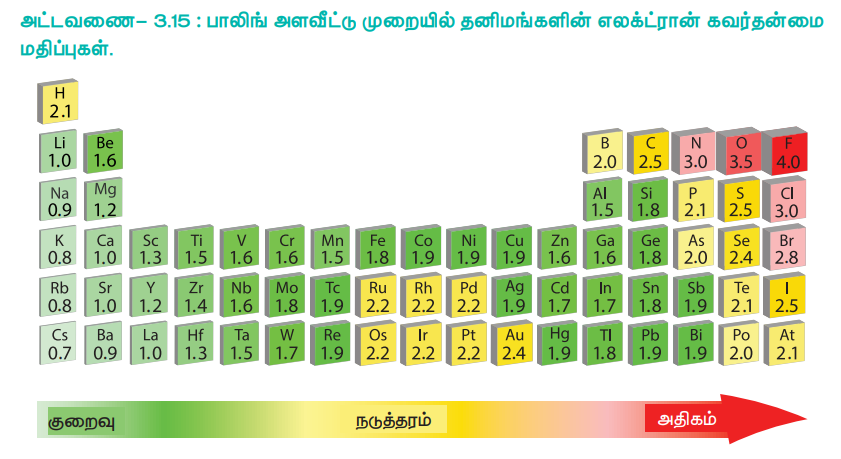
அட்டவணை 3.15 : பாலிங் அளவீட்டு முறையில் தனிமங்களின் எலக்ட்ரான் கவர்தன்மை மதிப்புகள்.
ஒரு தொகுதியில் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் மாறுபாடுகள்
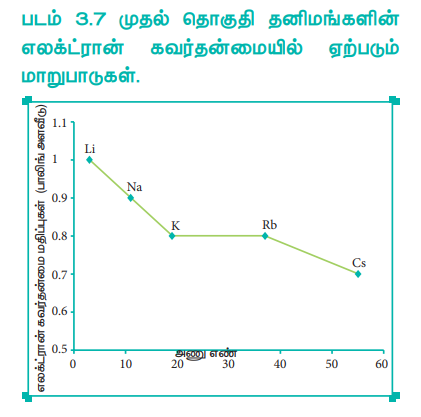
ஒரு தொகுதியில் மேலிருந்து கீழாக வரும் போது எலக்ட்ரான் கவர்தன்மை மதிப்பு பொதுவாகக் குறைகிறது. தொகுதியில் மேலிருந்து கீழே வரும்போது அணு ஆரம் அதிகரிக்கிறது. இணைதிற எலக்ட்ரான்கள் மீது அணுக்கரு செலுத்தும் கவர்ச்சி விசை குறைகிறது. எனவே, எலக்ட்ரான் கவர்தன்மையும் குறைகிறது.
மந்த வாயுக்களின் எலக்ட்ரான் கவர்தன்மை மதிப்பு பூஜ்யம் என எடுத்துக் கொள்ளப்படுகிறது. s-தொகுதி தனிமங்களின் எலக்ட்ரான்கவர் தன்மை மதிப்பு எதிர்பார்க்கப்படுவது போல தொகுதியில் குறைகிறது. 13 மற்றும் 14 ஆம் தொகுதி தனிமங்களைத் தவிர்த்து பிற p-தொகுதித் தனிமங்கள் எதிர்பார்க்கப்படுவது போன்று தொகுதியில், எலக்ட்ரான் கவர் தன்மை குறையும் போக்கினைக் கொண்டுள்ளன. (படம் 3.15 ஐப் பார்க்கவும்)
படம் 3.7 முதல் தொகுதி தனிமங்களின் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் மாறுபாடுகள்.