11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
பின்வரும் கேள்விகளுக்கு சுருக்கமாக விடையளி
II) பின்வரும் கேள்விகளுக்கு சுருக்கமாக விடையளி
24. நவீன ஆவர்த்தன விதியை வரையறு.
இவ்விதியின்படி, "தனிமங்களின் இயற் மற்றும் வேதிப் பண்புகள் அவற்றின் அணு எண்களின் ஆவர்த்தன சார்பாக அமைகின்றன". இக்கூற்று நவீன ஆவர்த்தன விதி என்றழைக்கப்படுகிறது.
25. ஐசோ எலக்ட்ரானிக் அயனிகள் என்றால் என்ன? உதாரணங்கள் கொடு.
ஒரே எண்ணிக்கையிலான எலக்ட்ரான்கள் கொண்ட அயனிகள் ஐசோ - எலக்ட்ரானிக் அயனிகள் எனப்படும்.
எ.கா: F−,Na+, Mg2+ , Ne (10e), Ar , Cl−, K+ (18e)
26. செயலுறு அணுக்கரு மின்சுமை என்றால் என்ன?
வெளிக்கூட்டில் உள்ள இணைதிற எலக்ட்ரான்களால் உணரப்படும் நிகர அணுக்கரு மின்சுமை செயலுறு அணுக்கரு மின்சுமை (effective nuclear charge) என்றழைக்கப்படுகிறது.
செயலுறு அணுக்கரு மின்சுமையானது பின்வரும் சமன்பாட்டில் தோராயமாக கணக்கிடப்படுகிறது.
Z செயலுறு = Z − S
இங்கு, Z என்பது அணு எண் மற்றும் S என்பது திரைமறைப்பு மாறிலி.
27. அயனியாக்கும் ஆற்றலுக்கு கொடுக்கப்பட்டுள்ள பின்வரும் வரையறை சரியானதா? “ஒரு அணுவின் இணைதிற கூட்டில் இலகுவாக பிணைக்கப்பட்டுள்ள எலக்ட்ரானை நீக்க தேவைப்படும் ஆற்றல் அயனியாக்கும் ஆற்றல்."
ஆம், சரியானதே. அடி ஆற்றல் நிலையில் (சிறும ஆற்றல் நிலையில் − ground state) உள்ள நடுநிலைத் தன்மை உடைய தனித்த வாயு நிலை அணு ஒன்றின் இணைதிற கூட்டிலிருந்து இலகுவாக பிணைக்கப்பட்டுள்ள ஒரு எலக்ட்ரானை நீக்குவதற்கு தேவைப்படும் குறைந்த பட்ச ஆற்றல் அயனியாக்கும் ஆற்றல் எனப்படும்.
M(g) + IE1 →M+(g) + 1e−
இங்கு IE1 என்பது முதலாவது அயனியாக்கும் ஆற்றலைக் குறிப்பிடுகிறது.
28. மெக்னீசியம் அடுத்தடுத்து எலக்ட்ரான்களை இழந்து Mg+, Mg2+ மற்றும் Mg3+ அயனிகளை தருகிறது. இதில் அதிக அயனியாக்கும் ஆற்றல் தேவைப்படும் படி எது? ஏன்?
Mg + IE1 → Mg+ + e− படி: 1
Mg+ + IE2 →Mg2+ + e− படி: 2
Mg2+ + IE3 →Mg3+ + e− படி: 3
அதிக அயனியாக்கும் ஆற்றல் தேவைப்படும் படி : 3 ஏனெனில்
1. Mg2+ அயனியின் செயலுறு கவர்ச்சி விசை அதிகம்.
2. Mg2+ மந்த வாயு நியானின் நிலைப்புத் தன்மை வாய்ந்த எலக்ட்ரான் அமைப்பு கொண்டது. இதிலிருந்து எலக்ட்ரானை நீக்குவது மிகவும் கடினம்.
29. எலக்ட்ரான் கவர்தன்மையை வரையறு.
சகப் பிணைப்பால் பிணைக்கப்பட்டுள்ள மூலக்கூறில் உள்ள ஒரு அணுவானது சகப்பிணைப்பில் பங்கிடப்பட்டுள்ள எலக்ட்ரான் இணையினைத் தன்னை நோக்கி ஒப்பீட்டு அளவில் கவரும் பண்பு எலக்ட்ரான் கவர்தன்மை எனப்படும்.
30. முதல் அயனியாக்கும் ஆற்றலை விட இரண்டாம் அயனியாக்கும் ஆற்றல் எப்பொழுதும் அதிகம் எனும் கூற்றிலுள்ள உண்மையை எவ்வாறு விளக்குவாய்?
Mg + IE1 → Mg+ + e−
Mg+ + IE2 → Mg2+ + e−
IE2 > IE1 ஏனெனில் இரண்டாம் எலக்ட்ரானானது செயலுறு அணுக்கவர்ச்சிக்கு எதிராக M+ அயனியிலிருந்து நீக்கப்பட அதிக ஆற்றல் தேவைப்படும்.
31. இயல்பு நிலையிலுள்ள ஹைட்ரஜன் அணுவில் உள்ள எலக்ட்ரானின் ஆற்றலானது -2.18 × 10−18 J ஆகும். அந்த ஹைட்ரஜன் அணுவின் அயனியாக்கும் ஆற்றலை kJ mol-1 அலகில் கணக்கிடுக.
E1 = −2.8 × 10−18J
E∞ = 0
H − அணுவில் உள்ள எலக்ட்ரான் ஆற்றல் E∞ − E1 = 0 − (−2.8 × 10−18 J)
= +2.8 × 10−18 J × 6.023 × 1023 mol−1
= +2.8 × 10−18 J × 10-3 KJ × 6.023 × 1023 mol−1
= +16.8644 × 102 KJ mol−1
= +1.686 × 10−3 KJ mol−1 = 1686 KJ mol−1
32. அயனியாக்கும் ஆற்றல் மற்றும் எலக்ட்ரான் நாட்டத்தினை பாதிக்கும் காரணிகளுள் முக்கியமான ஒரு காரணி அணுவின் எலக்ட்ரான் அமைப்பு - விளக்குக.
அயனியாக்கும் ஆற்றல் :
1. ஓர் அணுவின் எலக்ட்ரான் அமைப்பு சரிபாதி (அ) முழுவதும் (ns2,np6) நிரப்பப்பட்டிருந்தால் அதிக நிலைப்புத்தன்மை பெறுகிறது.
2. இது போன்ற நிலைத்த எலக்ட்ரான் அமைப்பை பெற்றிருக்கும் போது அணுவிலிருந்து எலக்ட்ரானை நீக்க அதிக ஆற்றல் தேவைப்படுவதால் அயனியாக்கும் ஆற்றல் அதிகரிக்கிறது.
எலக்ட்ரான் நாட்டம் :
1. அணுவானது (ns2,np6) நிலைத்த எலக்ட்ரான் அமைப்பை பெற்றிருக்கும் போது மேலும் ஓர் எலக்ட்ரானை சேர்ப்பது எளிதல்ல. இதற்கு அதிக ஆற்றல் தேவைப்படும்.
2. பெரும்பாலும் சரிபாதியாக நிரப்பப்பட்ட எலக்ட்ரான் அமைப்பை பெற்றிருக்கும் தனிமங்கள் பூஜ்ஜிய எலக்ட்ரான் நாட்டத்தை பெற்றுள்ளன.
33. Z = 118ஐக் கொண்ட தனிமம், எந்த வரிசை மற்றும் தொகுதியில் இடம் பெற்றுள்ளது?
எலக்ட்ரான் அமைப்பு
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6 5f14 6d10 7s2 7p6
இத்தனிமம் வரிசை எண் : 7 மற்றும் தொகுதி எண் : 18 இல் இடம் பெற்றுள்ளது.
34. குவாண்டம் எண்களை அடிப்படையாகக் கொண்டு தனிம வரிசை அட்டவணையின் 5வது வரிசையில் 18 தனிமங்கள் இடம் பெற்றிருக்க வேண்டும் என்பதை நிறுவுக.
5வது வரிசையில் (n = 5)
n = 5

மொத்த ஆர்பிட்டால்கள் எலக்ட்ரான் 1 + 3 + 5 = 9
அதிகபட்ச தனிமங்களின் எண்ணிக்கை = 18
35. அ, ஆ, இ மற்றும் ஈ ஆகிய தனிமங்கள் பின்வரும் எலக்ட்ரான் அமைப்பை பெற்றுள்ளன.
அ) 1s2, 2s2, 2p6
ஆ) 1s2, 2s2, 2p6, 3s2, 3p1
இ) 1s2, 2s2, 2p6, 3s2, 3p6
ஈ) 1s2, 2s2, 2p1
இவைகளுள் எந்த தனிமங்கள் தனிமவரிசை அட்டவணையில் ஒரே தொகுதியில் இடம் பெற்றுள்ளன.
(அ) மற்றும் (இ)− மந்த வாயுக்கள் − தொகுதி 18
(ஆ) மற்றும் (ஈ) − 13ஆம் தொகுதி (போரான் குடும்பம்)
36. லாந்தனைடுகள் மற்றும் ஆக்டினைடுகளின் பொதுவான எலக்ட்ரான் அமைப்பினை தருக.
லாந்தனைடுகள் − 4f1−14 5d0−1 6s2
ஆக்டினைடுகள் − 5f0−14 6d0−2 7s2
37. ஹேலஜன்கள் ஆக்ஸிஜனேற்றியாக செயல்படுவது ஏன்?
ஹேலஜன்களின் எலக்ட்ரான் அமைப்பு இவை எளிதில் ஒரு எலக்ட்ரானை பெற்று ns2np6 என்ற நிலையான எலக்ட்ரான் அமைப்பை பெறுவதால் எலக்ட்ரான் நாட்டம் அதிகம். எனவே ஹேலஜன்கள் ஆக்ஸிஜனேற்றியாக செயல்படுகின்றன.
(x2 + 2e → 2x−)
38. இரண்டாம் வரிசை தனிமங்களின் முரண்பட்ட பண்புகளில் ஏதேனும் இரண்டினைக் குறிப்பிடுக.
• ஒரே தொகுதியில் உள்ள தனிமங்கள் ஒரே மாதிரியான இயற் மற்றும் வேதிப்பண்புகளைப் பெற்றுள்ளன எனினும் ஒவ்வொரு தொகுதியிலும் உள்ள முதல் தனிமமானது அத்தனிமம் இடம் பெற்றுள்ள தொகுதியில் உள்ள பிற தனிமங்களின் பண்புகளிலிருந்து சில முரண்பட்ட பண்புகளைப் பெற்றிருக்கின்றன.
• உதாரணமாக, கார மற்றும் காரமண் உலோகங்கள் பொதுவாக அயனிச் சேர்மங்களை உருவாக்கும் தன்மையினைப் பெற்றுள்ளன. மாறாக லித்தியம் மற்றும் பெரிலியம் ஆகியன அதிக அளவில் சகப்பிணைப்புச் சேர்மங்களை உருவாக்குகின்றன.
• இரண்டாம் வரிசையில் உள்ள தனிமங்கள் அவற்றின் இணைதிற கூட்டில் மொத்தம் நான்கு ஆர்பிட்டால்களை (2s மற்றும் 2p) மட்டும் பெற்றிருக்கின்றன. எனவே அவற்றின் அதிகபட்ச சகப்பிணைப்பு இணைதிறன் 4.
• ஆனால் அடுத்தடுத்த வரிசைகளில் உள்ள தனிமங்கள் தங்களது இணைதிற கூட்டில் அதிக ஆர்பிட்டால்களைப் பெற்றுள்ளன.
• எனவே உயர் இணைதிறன் மதிப்புகளைப் பெற்றுள்ளன. எடுத்துக்காட்டாக போரான் BF−4 ஐயும் மற்றும் அலுமினியம் AIF−6 ஐயும் உருவாக்குகின்றன.
39. அயனி ஆரத்தினை கண்டறியும் பாலிங் முறையினை விவரி.
• நேரயனி மற்றும் எதிரயனி ஆகியவற்றிற்கு இடையேயான அயனி இடைத்தொலைவினைக் கொண்டு பாலிங், ஒற்றை மின்சுமையுடைய படிகங்களின் அயனி ஆரங்களை கணக்கிட்டார்.
• படிக அலகுக்கூட்டில் காணப்படும் அயனிகள் கோள வடிவமுடையவை என பாலிங் கருதினார். மேலும் அவைகள் ஒன்றையொன்று தொட்டுக் கொண்டிருப்பதாகவும் கருதினார் எனவே,
d = rC+ + rA− …………………. (1)
• இங்கு d என்பது நேர் அயனி C+ ன் அணுக்கருவிற்கும் எதிர் அயனி A− ன் அணுக்கருவிற்கும் இடையேயானத் தொலைவு ஆகும். rC+ மற்றும் rA− ஆகியன முறையே நேர் மற்றும் எதிர் அயனிகளின் ஆரங்களாகும்.
• மேலும், மந்த வாயுக்களின் எலக்ட்ரான் அமைப்பினை (எடுத்துக்காட்டாக Na+ மற்றும் F− அயனிகள் 1S2 2S2 2P6 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளன) பெற்றுள்ள அயனிகளின் ஆரமானது அவ்வயனிகள் மீது அணுக்கருவால் செலுத்தப்படும் செயலுறு அணுக்கரு மின்சுமைக்கு எதிர்விகிதத்தில் அமையும், அதாவது,
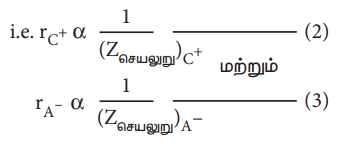
இங்கு Z செயலுறு என்பது செயலுறு அணுக்கரு மின்சுமைக்குச் சமம்.
Z செயலுறு = Z − S
சமன்பாடு (2) ஐ (3) ஆல் வகுக்க,
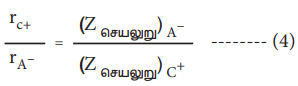
சமன்பாடு (1) மற்றும் (4) ஐத் தீர்ப்பதன் மூலம் rC+ மற்றும் rA− மதிப்புகளைப் பெற இயலும்.
40. அயனியாக்கும் ஆற்றலின் ஆவர்த்தன தொடர்பினை விவரி.
வரிசையில் ஏற்படும் மாறுபாடு
• அயனியாக்கும் ஆற்றல் ஒரு சில விதிவிலக்குகளைத் தவிர்த்து பொதுவாக ஒரு வரிசையில் அதிகரிக்கின்றது ஒரு வரிசையில் இடமிருந்து வலமாகச் செல்லும் போது, இணைதிற எலக்ட்ரான்கள் ஒரே கூட்டில் சேர்க்கப்படும் நிலையில், அணுக்கருவில் புரோட்டான்கள் சேர்க்கப்படுகின்றன.
• இவ்வாறு தொடர்ச்சியாக அணுக்களின் சுமை அதிகரிப்பதால், இணைதிற எலக்ட்ரான் மீதான கவர்ச்சி விசையும் அதிகரிக்கிறது. மேலும் இணைதிற எலக்ட்ரானை நீக்க தேவைப்படும் ஆற்றல் அதிகரிப்பதால் அயனியாக்கும் ஆற்றல் அதிகரிக்கிறது.
தொகுதியில் ஏற்படும் ஆவர்த்தன மாறுபாடுகள் :
• ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும் போது அயனியாக்கும் ஆற்றல் குறைகிறது. தொகுதியில் மேலிருந்து வரும் போது இணைதிற எலக்ட்ரான்கள் புதிய கூட்டில் சேர்கின்றன.
• அணுக்கருவிற்கும் இணைதிற எலக்ட்ரான்களுக்கும் இடையேயானத் தொலைவு அதிகரிக்கின்றது. எனவே இணைதிற எலக்ட்ரான்கள் மீதான அணுக்கருவின் கவர்ச்சி விசை குறைகின்றது. இதன் காரணமாக ஒரு தொகுதியில் மேலிருந்து கீழே செல்லும் போது அயனியாக்கும் ஆற்றல் குறைகிறது.
41. மூலைவிட்ட தொடர்பினை விவரி.
• தனிம வரிசை அட்டவணையில் மூலைவிட்டமாகச் செல்லும் போது, இரண்டாம் மற்றும் மூன்றாம் வரிசையில் உள்ள தனிமங்கள் சில பண்புகளில் ஒத்துக் காணப்படுகின்றன.
• ஒரு தொகுதியில் காணப்படும் தனிமங்களுக்கிடையே நாம் காணும் பண்புகளைப் போன்று அதிக அளவில் ஒற்றுமைத் தன்மை காணப்படாவிட்டாலும் கூட, பின்வரும் தனிம இணைகளில் இப்பண்பு குறிப்பிடத்தக்க அளவில் உள்ளது.
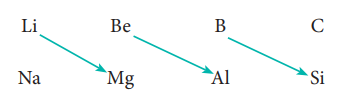
• மூலைவிட்டத்தில் அமைந்துள்ள தனிமங்களின் பண்புகளுக்கிடையே காணப்படும் ஒற்றுமைத் தன்மை மூலை விட்டத்தொடர்பு எனப்படும்.
42. சோடியத்தின் முதல் அயனியாக்கும் ஆற்றலானது மெக்னீசியத்தை விட குறைவு; ஆனால் அதன் இரண்டாம் அயனியாக்கும் ஆற்றல் மெக்னீசியத்தை விட அதிகம், ஏன்?
• Mg உருவளவில் Na −விட சிறியது, எனவே சோடியத்தின் முதல் அயனியாக்கும் ஆற்றல் மெக்னீசியத்தை விட குறைவு.
• Na ஒரு எலக்ட்ரானை இழந்து Na+ அயனியாக மாறும்போது, அது மந்தவாயு (Ne)வின் நிலைப்புத் தன்மை வாய்ந்த அமைப்பைப் பெறுவதால் இதிலிருந்து e நீக்குவது கடினம். Na+ −இன் இரண்டாம் அயனியாக்கும் ஆற்றல் Mg விட அதிகம்.
43. பாலிங் முறையினை பயன்படுத்தி பொட்டாசியம் குளோரைடு படிகத்தில் உள்ள K+ மற்றும் Cl- அயனிகளின் அயனி ஆரங்களை கணக்கிடுக. கொடுக்கப்பட்டுள்ள தரவு dk+-cl- = 3.14 Å
dk + cl− =3.14Å
dk+cl− = rk+ + rcl− = 3.14 Å …………………. (1)
K+ மற்றும் Cl− ஆர்கான் Ar மந்த வாயுவின் எலக்ட்ரான் அமைப்பைக் கொண்டுள்ளது.
K+ மற்றும் Cl− ⇒ எலக்ட்ரான் அமைப்பு
(1s2) (2s2 2s6) (3s2 3p6)
Zசெயலுறு = Z − S
Zk + (செயலுறு) =19 − [(0.35 × 7) + (0.85 × 8) + (1.00 × 2)]
19 −11.25 = 7.75
Zசெயலுறு = 17 − 11.25 = 5.75
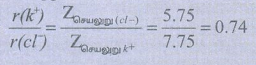
rk+ = 0.74 rcl− …………………. (2)
(2) ஐ (1)ல் பிரதியிட,
dk+ − dcl− = 0.74 rcl− + rcl− = 3.14 Å
1.74 rcl− = 3.14 Å
rcl− = 3.14/1.74 = 1.81 Å
rk+ = 0.74 rcl−
= 0.74 × 1.81
rk+ = 1.33 Å
எனவே rk+ = 1.33 Å
rcl− = 1.81 Å
44. பின்வருவனவற்றை விவரி. மேலும் தக்க காரணம் தருக.
(i) N-ன் அயனியாக்கும் ஆற்றல் O-ஐ விட அதிகம்
(ii) C-அணுவின் முதல் அயனியாக்கும் ஆற்றலின் மதிப்பு B-அணுவை விட அதிகம்; அதே வேளையில் இதன் மறுதலைக் கூற்று இரண்டாம் அயனியாக்கும் ஆற்றலுக்கு உண்மையாகிறது.
(iii) Be, Mg ஆகியவற்றின் எலக்ட்ரான் நாட்ட மதிப்புகள் ஏறத்தாழ பூஜ்ஜியமாகும். மேலும் N (0.02eV) மற்றும் P (0.80eV) ஆகியவைகளுக்கும் இதன் மதிப்பு குறைவு
(iv) F(g) லிருந்து F-(g) உருவாவது வெப்ப உமிழ்வினையாகும். ஆனால் O(g)லிருந்து O2-(g) உருவாவது வெப்பக்கொள் வினையாகும்.
விடைகள்:
(i) N(Z = 7) 1S2 2S2 2Px1 2Py1 2Pz1
O (Z = 8) 1S2 2S2 2Px2 2Py1 2Pz1
N - அணுவின் பாதியளவு நிரம்பிய நிலைப்புத் தன்மை வாய்ந்த எலக்ட்ரான் அமைப்பு உள்ளதால், அதன் அயனியாக்கும் ஆற்றல் O − ஐ விட குறைவு.
(ii) C(Z = 6) 1S2 2S2 2Px1 2Py1 2Pz1
B(Z = 5) 1S2 2S2 2Px1
C - அணுவின் அணுக்கரு மின்சுமை B −ஐ விட அதிகம். எனவே C−ன் IE B விட அதிகம்.
ஆனால் B−ஒரு எலக்ட்ரானை இழந்து 1S2 2S2 என்ற முழுவதும் நிரம்பிய எலக்ட்ரான் அமைப்பைப் பெற்று நிலைப்புத் தன்மை பெறுவதால் இதன் இரண்டாம் அயனியாக்கும் ஆற்றல் C−ஐ விட அதிகமாகிறது.
(iii) Be (Z = 4) 1S2 2S2
Mg (X =12) 1S2 2S2 2P6 3S2
மந்தவாயுக்கள் − nS2 np6
N (Z = 7) 1S2 2S2 2Px1 2Py1 2Pz1
P (Z = 15) 1S2 2S2 2P6 3S2 3Px1 3Py1 3Pz1
நிலைப்புத்தன்மை கொண்ட எலக்ட்ரான் அமைப்பைப் பெற்றுள்ளதால் இவற்றில் மற்றொரு எலக்ட்ரானை சேர்க்க இயலாது. எனவே இவற்றின் எலக்ட்ரான் நாட்ட மதிப்புகள் பூஜ்ஜியம்
(iv) 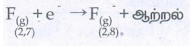
F(g) ஓர் எலக்ட்ரான் எளிதில் பெற்று நிலைப்புத் தன்மை வாய்ந்த மந்த வாயுவின் அமைப்பைப் பெறுகின்றது. இதனால் F(g)− உருவாக்கும்போது ஆற்றல் வெளித்தள்ளப்படும்.

ஒரு எலக்ட்ரானை எளிதில் பெற்றுக்கொண்டு (O(g)) அயனி உருவாகும் போது ஆற்றலை வெளியிடுகிறது. அதுவே (O−(g)) அயனியில் மற்றொரு எலக்ட்ரானை சேர்க்கும் போது ஒத்த மின்சுமைகளுக்கிடையே நிலை மின்னியல் விலக்கு விசை காரணமா எலக்ட்ரானை சேர்ப்பதற்கு அதிக ஆற்றல் தேவைப்படுகிறது. ஆதலால் O−அயனி O2− −யாக மாறுவது வெப்ப கொள்வினையாகும். மேலும் இரண்டு எலக்ட்ரானை நாட்ட மதிப்பு முதல் எலக்ட்ரான் நாட்ட மதிப்பை விட அதிகம். எனவே, நிகர வினையான O(g) அணுவிலிருந்து O2− (g) உருவாதல் வெப்பக் கொள்வினையாகும்.
45. திரைமறைப்பு விளைவு என்றால் என்ன?
• ஒரு தொகுதியில் மேலிருந்து கீழாக செல்லும் போது உட்கூட்டில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை அதிகரிக்கின்றது.
• இதன் காரணமாக உட்கூட்டில் உள்ள எலக்ட்ரான்களும் இணைதிற எலக்ட்ரான்களுக்கும் இடையேயான விலக்கு விசையும் அதிகரிக்கின்றது.
• அதாவது உள்கூட்டில் உள்ள எலக்ட்ரான்களின் மறைத்தல் விளைவு அதிகரிப்பதனால் அணுக்கருவினால் இணைதிற எலக்ட்ரான்கள் மீது செலுத்தப்படும் கவர்ச்சி விசை குறைகிறது.
• இவ்விளைவையே திரைமறைப்பு விளைவு என்கிறோம்.
46. எலக்ட்ரான் கவர்தன்மைக்கான பாலிங் முறையின் அடிப்படையை சுருக்கமாக தரவும்.
• ஹைட்ரஜன் மற்றும் புளூரினுக்கு முறையே 2.1 மற்றும் 4.0 என்ற மதிப்புகளை எலக்ட்ரான் நாட்ட மதிப்புகள் என தோராயமாக பாலிங் எடுத்துக்கொண்டார்.
• இதனடிப்படையில் பிற தனிமங்களுக்கு பின்வரும் வாய்ப்பாட்டினை பயன்படுத்தி எலக்ட்ரான் நாட்ட மதிப்புகளைக் கண்டறியலாம்.
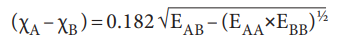
இங்கு
EAB −AB மூலக்கூறின் பிணைப்பு பிளவு ஆற்றல்
EAA = A2(A − A) மூலக்கூறின் பிணைப்பு பிளவு ஆற்றல்
EBB = B2(B − B) மூலக்கூறின் பிணைப்பு பிளவு ஆற்றல்
• கொடுக்கப்பட்ட எந்த ஒரு தனிமத்தின் எலக்ட்ரான் நாட்டத்தின் மதிப்பும் மாறிலியல்ல. இதன் மதிப்பு அத்தனிமம் எத்தனிமத்துடன் சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ளது என்பதைப் பொறுத்து அமையும்.
47. தொகுதிகள் மற்றும் வரிசைகளில் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் ஆவர்த்தன மாற்றங்களை கூறுக.
ஒரு வரிசையில் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் மாறுபாடு:
• இடமிடருந்து வலமாகச் செல்லும் போது பொதுவாக எலக்ட்ரான் கவர்தன்மை மதிப்பு அதிகரிக்கின்றது. ஒரு வரிசையில் அணுக்கருவிற்கும், இணைதிற எலக்ட்ரான்களுக்கும் இடையேயான கவர்ச்சி விசை அதிகரிப்பதால் அணு ஆரம் குறைகிறது.
• எனவே, பங்கிடப்பட்டுள்ள எலக்ட்ரான்களை கவரும். தன்மை அதிகரிக்கிறது. இதன் காரணமாக ஒரு வரிசையில் எலக்ட்ரான் கவர்தன்மை அதிகரிக்கிறது.
ஒரு தொகுதியில் எலக்ட்ரான் கவர்தன்மையில் ஏற்படும் மாறுபாடுகள்:
• ஒரு தொகுதியில் மேலிருந்து கீழாக வரும் போது எலக்ட்ரான் கவர்தன்மை மதிப்பு பொதுவாகக் குறைகிறது. தொகுதியில் மேலிருந்து கீழாக வரும் போது அணு ஆரம் அதிகரிக்கிறது.
• இணைதிற எலக்ட்ரான்கள் மீது அணுக்கரு செலுத்தும் கவர்ச்சி விசை குறைகிறது. எனவே, எலக்ட்ரான் கவர்தன்மையும் குறைகிறது.