வேதியியல் - தனிமங்களை வகைப்படுத்துதல் | 11th Chemistry : UNIT 3 : Periodic Classification of Elements
11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
தனிமங்களை வகைப்படுத்துதல்
தனிமங்களை வகைப்படுத்துதல்
19 ஆம் நூற்றாண்டில், அறிவியல் அறிஞர்கள் பல்வேறு தனிமங்களைப் பிரித்தெடுத்தனர். இதன்மூலம் கண்டறியப்பட்ட தனிமங்களின் எண்ணிக்கை அதிகரித்தது. தற்போது நாம் 118 தனிமங்களைக் கண்டறியப் பெற்றிருக்கின்றோம். இந்த 118 தனிமங்களில் அணு எண் 1 முதல் 92 வரையுள்ள தொண்ணூற்று இரண்டு தனிமங்களும் இயற்கையில் கிடைக்கின்றன. இவற்றில் சில தனிமங்களுக்கிடைய சில பண்புகளில் ஒற்றுமைத் தன்மை உள்ளதை அறிவியல் அறிஞர்கள் கண்டறிந்தனர். இக்கண்டுபிடிப்பானது, தனிமங்களை அவற்றின் பண்புகளின் அடிப்படையில் வகைப்படுத்தலாம் என்ற கருத்து உருவாக காரணமாக அமைந்தது. தனிமங்களை அதிகம் பயன்படுத்துவதற்கு, அதனை வகைப்படுத்துதல், நன்மை தரத்தக்கதாக அமையும். தனிமங்களை வகைப்படுத்துவதற்கு பல்வேறு முயற்ச்சிகள் மேற்கொள்ளப்பட்டன. எனினும் அணுநிறையின் அடிப்படையிலான வகைப்பாடு, தனிம வரிசை அட்டவணையினை சரியான வடிவில் உருவாக்குவதற்கு வழிவகை செய்தது.
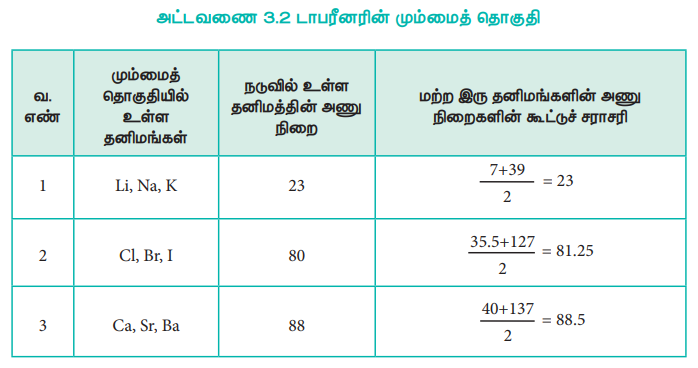
1817 -ல், J.W. டாபரீனர், வேதிப்பண்புகளில் ஒத்துள்ள குளோரின், புரோமின், அயோடின் போன்ற தனிமங்களை மூன்று தனிமங்கள் கொண்ட ஒரு குழுவாக வகைப்படுத்தினார். இதனை அவர் மும்மைத் தொகுதி (triads) என அழைத்தார். மும்மைத் தொகுதியில் நடுவில் உள்ள தனிமத்தின் அணு நிறையானது, மற்ற இரு தனிமங்களின் அணு நிறைகளின் கூட்டுச் சாராசரிக்கு ஏறத்தாழ சமமாக இருந்தது. எனினும் குறிப்பிட்ட சில தனிமங்களை மட்டுமே மும்மைத் தொகுதிகளாக வகைப்படுத்த முடிந்தது. ஏறத்தாழ ஒத்த அணு நிறைகளைப் பெற்றுள்ள [Fe, Co, Ni], [Ru, Rh, Pd], [Os, Ir, Pt] போன்ற மும்மைத் தொகுதிகளுக்கு இவ்வகைப்பாட்டுக் கொள்கையினைப் பயன்படுத்த இயலவில்லை.
அட்டவணை 3.2 டாபரீனரின் மும்மைத் தொகுதி
1862-ல், A.E.B.டி சான்கோர்டாய்ஸ், தனிமங்களின் பண்புகள், அவற்றின் அணுநிறையோடு கொண்டுள்ள ஒரு தொடர்பினை எடுத்துக் கூறினார். அவரது கூற்றுப்படி, பொருட்களின் பண்புகள் அவற்றின் எண்களின் பண்புகளோடு தொடர்புடையது. இவர் அணு நிறையினை குறிப்பிட 'எண்கள்' என்ற வார்த்தையினைப் பயன்படுத்தினார். அடிப்பக்க சுற்றளவில் 16 அலகுகள் உடைய ஒரு உருளையின் செங்குத்து மைய அச்சிற்கு 45° கோணத்தில் ஒரு சுருளை (helix) அவர் உருவாக்கினார். உருளையின் மேற்பரப்பில் அச்சுருளின் வழியே தனிமங்களை, அவற்றின் அணு நிறைகளின் ஏறுவரிசையில் குறித்தார். சுருளின் ஒரு முழுச்சுற்று, அணுநிறை 16 அதிகரிப்பதற்குச் சமம். உருளையின் மேற்பரப்பில் சம இடைவெளிகளுடன் வரையப்பட்ட பதினாறு செங்குத்துக் கோடுகளில், ஒரே செங்குத்துக் கோட்டில் அமைந்துள்ள தனிமங்கள் ஒத்தப் பண்புகளைக் கொண்டிருந்தன. தனிம வரிசை அட்டவணையை உருவாக்குவது தொடர்பான முயற்சிகளில் முதல் குறிப்பிடத்தக்க முயற்சி இதுவாகும். எனினும் இது அதிகளவில் கவனத்தை ஈர்ப்பதாக அமைந்திருக்கவில்லை.
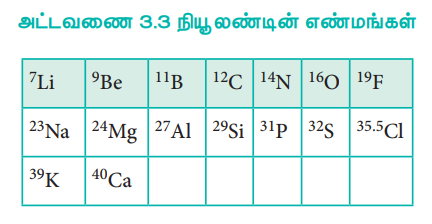
1864 - ல் J. நியூலண்ட் என்பவர் தனிமங்களை வகைப்படுத்தும் பொருட்டு, எண்ம விதியினை முன் மொழிந்தார். தனிமங்களை அவற்றின் அணு நிறைகளின் ஏறுவரிசையில் அமைக்கும் போது, ஒவ்வொரு எட்டாவது தனிமத்தினுடைய பண்பும், முதலாவது தனிமத்தின் பண்புடன் ஒத்திருந்தது. இவ்விதி கால்சியம் வரையிலான இலேசான தனிமங்களுக்கு மட்டுமே சரியாக பொருந்தியது.
அட்டவணை 3.3 நியூ லண்டின் எண்மங்கள்
1. மெண்டலீஃபின் வகைப்பாடு
1868-ல் லோதர் மேயர், தற்போதுள்ள நவீன ஆவர்த்தன அட்டவணையினை ஒத்த ஒரு தனிம வரிசை அட்டவணையை உருவாக்கினார். இயற்பண்புகளான அணு பருமன், உருகுநிலை மற்றும் கொதிநிலை போன்றவற்றை அணுக்களின் அணுநிறைக்கு எதிராக வரைபடத்தில் குறித்தபோது, அப்பண்புகளில் ஆவர்த்தன தன்மை காணப்படுவதை இவர் கண்டறிந்தார்.
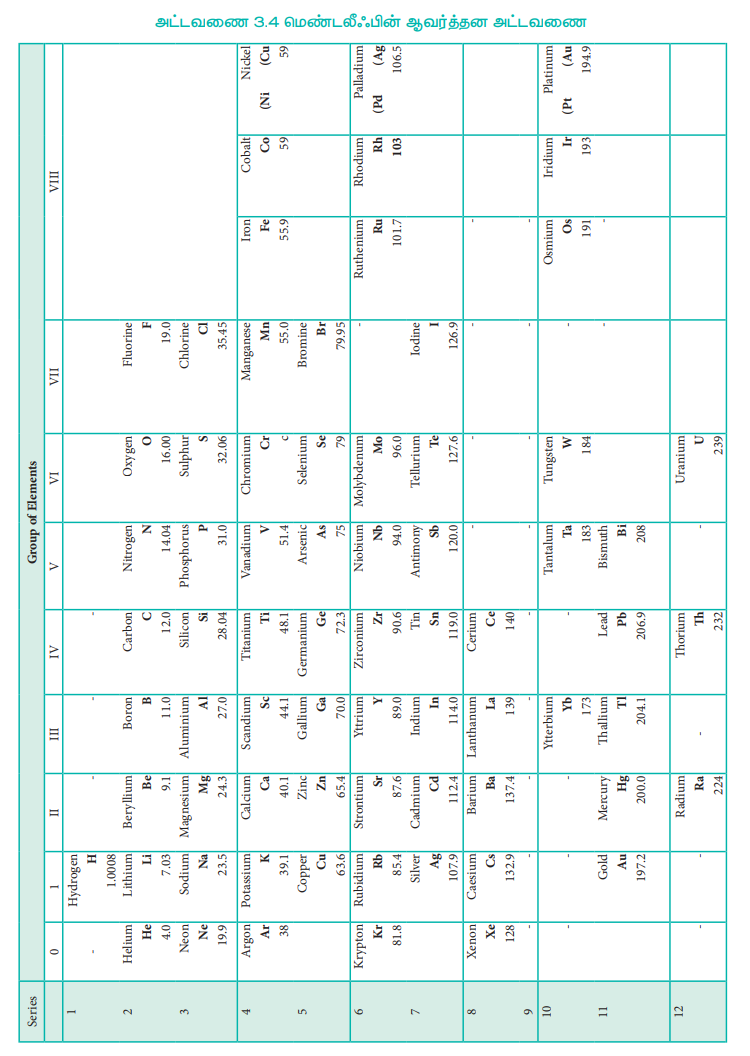
இதே காலகட்டத்தில், டிமிரிட்டி மெண்டலீஃப் தனியே ஒரு கருத்தினை முன்மொழிந்தார். அது "தனிமங்களின் பண்புகள் அவற்றின் அணுநிறைகளின் ஆவர்த்தன சார்பாக அமைகின்றன," என்பதாகும். இக்கூற்று ஆவர்த்தன விதி என அழைக்கப்படுகிறது. அக்காலத்தில் அறியப்பட்டிருந்த 70 தனிமங்களை அவற்றின் அணு நிறைகளின் ஏறுவரிசையில் பல செங்குத்து தொகுதிகளாக வகைப்படுத்தினார். இவ்வாறாக, ஆவர்த்தன விதியின் அடிப்படையில் மெண்டலீஃப், முதன் முதலாக ஆவர்த்தன அட்டவணையினைக் கட்டமைத்தார்.
அட்டவணை 3.4 மெண்டலீஃபின் ஆவர்த்தன அட்டவணை
மெண்டலீஃபின் ஆவர்த்தன அட்டவணையில் உள்ளவாறு, தகுந்த பண்புகளைக் கொண்ட தனிமங்கள் அந்நேரத்தில் கண்டறியப்படாத நிலையில் அவற்றிற்கென வெற்றிடங்களை விட்டிருந்தார். அவரும் மற்ற அறிஞர்களும் இடம் விடப்பட்ட தனிமங்கள் பெற்றிருக்க வேண்டிய இயற்பியல் மற்றும் வேதிப்பண்புகளை நிர்ணயித்தனர். பின்னாளில் கண்டறியப்பட்ட தனிமங்களின் பண்புகள் ஏற்கனவே இடம் விடப்பட்ட தனிமங்களுக்கென நிர்ணயிக்கப்பட்ட பண்புகளோடு ஒத்துக் காணப்பட்டன.
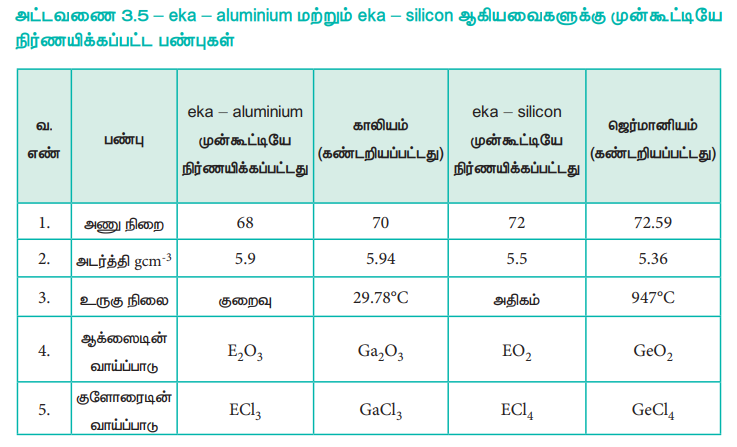
எடுத்துக்காட்டாக, தொகுதி III ஐச் சார்ந்த காலியம் (Ga) மற்றும் தொகுதி IV ஐச் சார்ந்த ஜெர்மானியம் (Ge) ஆகியவை அக்காலத்தில் கண்டறியப்பட்டிருக்கவில்லை. ஆனால், மெண்டலீஃப் அவைகள் இருப்பதற்கான சாத்தியக் கூறினையும், அவற்றின் பண்புகளையும் நிர்ணயித்திருந்தார். அவர் நிர்ணயித்திருந்த பண்புகளை பெற்ற தனிமங்களுக்கு (eka - aluminium) மற்றும் (eka - silicon) என பெயரிட்டார்.
சரியான தனிமங்கள் கண்டறியப்பட்ட பின்னர், அவைகளின் பண்புகள், மெண்டலீஃப்பினால் முன் கூட்டியே நிர்ணயிக்கப்பட்ட பண்புகளுடன் ஏறத்தாழ ஒத்திருந்தன. (அட்டவணை 3.5)
அட்டவணை 3.5 - eka - aluminium மற்றும் eka - silicon ஆகியவைகளுக்கு முன்கூட்டியே நிர்ணயிக்கப்பட்ட பண்புகள்
2. மெண்டலீஃபின் ஆவர்த்தன அட்டவணையில் உள்ள முரண்பாடுகள்
ஒத்த பண்புகளை உடைய தனிமங்கள் வெவ்வேறு தொகுதிகளிலும், வெவ்வேறு பண்புகளுடைய தனிமங்கள் ஒரே தொகுதியிலும் வைக்கப்பட்டிருந்தன. இதைப் போலவே ஆவர்த்தன விதிக்கு முரணாக, அதிக அணு நிறையுள்ள தனிமமானது குறைவான அணு நிறையுள்ள தனிமத்திற்கு முன்னதாகவே வைக்கப்பட்டிருந்தது.
எடுத்துக்காட்டாக டெலூரியம் (127.6) ஆறாவது (VI) தொகுதியிலும், அயோடின் (127) ஏழாவது (VII) தொகுதியிலும் வைக்கப்பட்டிருந்தன. 58.7Ni28 –க்கு முன்னதாக 59Co27 வைக்கப்பட்டிருந்தது.