11 Я«хЯ«цЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«▓Я«ЋЯ»Ђ 3 : Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«єЯ«хЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«Е Я«хЯ«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ
Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї
Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї
Я«ЄЯ«»Я«▓Я»ЇЯ«фЯ»Ђ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї (Я«џЯ«┐Я«▒Я»ЂЯ«« Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї - ground state) Я«ЅЯ«│Я»ЇЯ«│ Я«еЯ«ЪЯ»ЂЯ«еЯ«┐Я«▓Я»ѕЯ«цЯ»ЇЯ«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЅЯ«ЪЯ»ѕЯ«» Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«ц Я«хЯ«ЙЯ«»Я»Ђ Я«еЯ«┐Я«▓Я»ѕ Я«ЁЯ«БЯ»Ђ Я«њЯ«ЕЯ»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЄЯ«▓Я«ЋЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«фЯ«┐Я«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«њЯ«░Я»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«цЯ»ЄЯ«хЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«цЯ«фЯ«ЪЯ»ЇЯ«џ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ KJmol-1 Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ eV Я«јЯ«ЕЯ»ЇЯ«▒ Я«ЁЯ«▓Я«ЋЯ«ЙЯ«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ.
M(g) + IE1 Рєњ M+(g) + 1 e-
Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ђ, IE1 Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я««Я»ЂЯ«цЯ«▓Я«ЙЯ«хЯ«цЯ»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЁЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«ц Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЇЯ«ЋЯ«│Я»Ї (Successive ionization energies)
Я«њЯ«░Я»Ђ Я«њЯ«▒Я»ЇЯ«▒Я»ѕ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«» Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ, Я«њЯ«░Я»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«цЯ»ЄЯ«хЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«цЯ«фЯ«ЪЯ»ЇЯ«џ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«ЙЯ««Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
M+(g) + IE2 Рєњ M2+(g) + 1 e-
Я«ЄЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ»ІЯ«▓Я«хЯ»Є, Я«еЯ«ЙЯ««Я»Ї Я««Я»ѓЯ«ЕЯ»ЇЯ«▒Я«ЙЯ««Я»Ї, Я«еЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«ЙЯ««Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЇЯ«ЋЯ«│Я»ѕ Я«хЯ«░Я»ѕЯ«»Я«▒Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«▓Я«ЙЯ««Я»Ї.
Я«њЯ«░Я»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»Ї Я«џЯ»ЂЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«» Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«ЁЯ«цЯ«ЕЯ»Ї Я«еЯ«ЪЯ»ЂЯ«еЯ«┐Я«▓Я»ѕ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«»Я»ѕЯ«хЯ«┐Я«Ъ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«еЯ»ЇЯ«цЯ«фЯ»ІЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«ЁЯ«хЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕ Я«џЯ««Я««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є, Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«» Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЂЯ«▒Я»Ђ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ»ЂЯ«ЪЯ»ѕЯ«» Я«еЯ«ЪЯ»ЂЯ«еЯ«┐Я«▓Я»ѕ Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЂЯ«▒Я»Ђ Я«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«ЕЯ»ѕ Я«хЯ«┐Я«Ъ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐Я«»Я«ЙЯ«Е Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї, Я«јЯ«фЯ»ЇЯ«фЯ»ІЯ«цЯ»ЂЯ««Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«ЈЯ«▒Я»ЂЯ«хЯ«░Я«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЁЯ««Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
IE1 < IE2 < IE3 < Рђд.
Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«єЯ«хЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«ЕЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ.
Я«њЯ«░Я»Ђ Я«џЯ«┐Я«▓ Я«хЯ«┐Я«цЯ«┐Я«хЯ«┐Я«▓Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«│Я»ѕЯ«цЯ»Ї Я«цЯ«хЯ«┐Я«░Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ, Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї, Я«њЯ«░Я»Ђ Я«хЯ«░Я«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ. Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ«░Я»Є Я«хЯ«┐Я«хЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«хЯ«ЙЯ«▒Я»Ђ, Я«њЯ«░Я»Ђ Я«хЯ«░Я«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«ЪЯ««Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«хЯ«▓Я««Я«ЙЯ«ЋЯ«џЯ»Ї Я«џЯ»єЯ«▓Я»ЇЯ«▓Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«њЯ«░Я»Є Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▓Я»Ї Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐Я«»Я«ЙЯ«Ћ Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я»ђЯ«цЯ«ЙЯ«Е Я«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«Ћ Я«цЯ»ЄЯ«хЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«ЙЯ««Я»Ї Я«хЯ«░Я«┐Я«џЯ»ѕ Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«ЙЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ѕ Я«еЯ«ЙЯ««Я»Ї Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ»ІЯ««Я»Ї. Я«ЁЯ«БЯ»Ђ Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«јЯ«цЯ«┐Я«░Я«ЙЯ«Е Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«хЯ«░Я»ѕЯ«фЯ«ЪЯ««Я»Ї Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«хЯ«░Я»ѕЯ«фЯ«ЪЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї, Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«ЋЯ»ЇЯ«ЋЯ««Я«ЙЯ«Е Я«фЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▓Я»Ї, Я«ЄЯ«░Я»Ђ Я««Я«ЙЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«фЯ»єЯ«░Я«┐Я«▓Я«┐Я«»Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Е Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»Ї Я«џЯ»ЂЯ««Я»ѕЯ«»Я«┐Я«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я«┐Я«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї, Я«фЯ»ІЯ«░Я«ЙЯ«ЕЯ«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я»Ї Я«јЯ«Е Я«јЯ«цЯ«┐Я«░Я»ЇЯ«фЯ«ЙЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ«фЯ«ЙЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я««Я»ЂЯ«░Я«БЯ«ЙЯ«Ћ Я«фЯ»єЯ«░Я«┐Я«▓Я«┐Я«»Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЇЯ«ЋЯ«│Я»Ї Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є 899 Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї 800 kJ mol-1 Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
Я«џЯ«┐Я«▒Я»ЂЯ«« Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«фЯ»єЯ«░Я«┐Я«▓Я«┐Я«»Я««Я»Ї (Z = 4) 1s2, 2s2 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ««Я»Ї, Я«фЯ»ІЯ«░Я«ЙЯ«ЕЯ»Ї (Z = 5) 1s2 2s2 2p1 Я«јЯ«ЕЯ»ЇЯ«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«Е.
Я«фЯ»єЯ«░Я«┐Я«▓Я«┐Я«»Я««Я»Ї Я««Я»ЂЯ«┤Я»ЂЯ«хЯ«цЯ»ЂЯ««Я»Ї Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ 2s Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ«ЙЯ«▓Я»Ї, Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«│Я«хЯ»Ђ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«ЋЯ»ѓЯ«ЪЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ (2s22p1) Я«фЯ»ІЯ«░Я«ЙЯ«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«ЁЯ«│Я«хЯ»Ђ Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«цЯ»ЇЯ«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЅЯ«ЪЯ»ѕЯ«»Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»Ї Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Ћ Я«фЯ»єЯ«░Я«┐Я«▓Я«┐Я«»Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я»Ї.
Я«фЯ«ЪЯ««Я»Ї 3.2 Я«хЯ«░Я«┐Я«џЯ»ѕ 2-Я«▓Я»Ї Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«ЙЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»Ђ
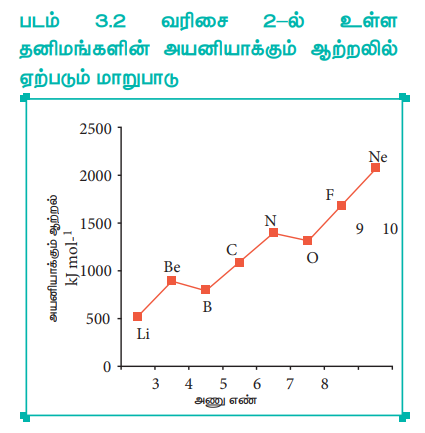
Я«ЄЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ»ІЯ«▓Я«хЯ»Є, 1s2 2s2 2p3 Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї. (1402 k.Jmol-1), 1s2 2s2 2p4 Я«јЯ«ЕЯ»ЇЯ«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї (1314 kJmol-1) Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я»Ї. Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї Я«џЯ«░Я«┐Я«фЯ«ЙЯ«цЯ«┐Я«»Я«│Я«хЯ»Ђ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«цЯ«┐Я«Ћ Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«»Я«цЯ»Ђ. Я«єЯ«цЯ«▓Я«ЙЯ«▓Я»Ї, Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї 2p Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ, Я«њЯ«░Я»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«ЁЯ«цЯ«┐Я«Ћ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«цЯ»ЄЯ«хЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї, Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї 2p Я«єЯ«░Я»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«њЯ«░Я»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«цЯ»Ђ Я«џЯ«░Я«┐Я«фЯ«ЙЯ«цЯ«┐Я«»Я«│Я«хЯ»Ђ Я«еЯ«┐Я«░Я«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«еЯ«┐Я«▓Я»ѕЯ«»Я«ЙЯ«Е Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»Ї Я«хЯ«┐Я«│Я»ѕЯ«хЯ«ЙЯ«Ћ Я«еЯ»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»ІЯ«ЪЯ»Ђ Я«њЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ«┐Я«▓Я»Ї 2p Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ѕ Я«еЯ»ђЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ»Ђ Я«јЯ«│Я«┐Я«цЯ«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«цЯ»іЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«єЯ«хЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«Е Я««Я«ЙЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї
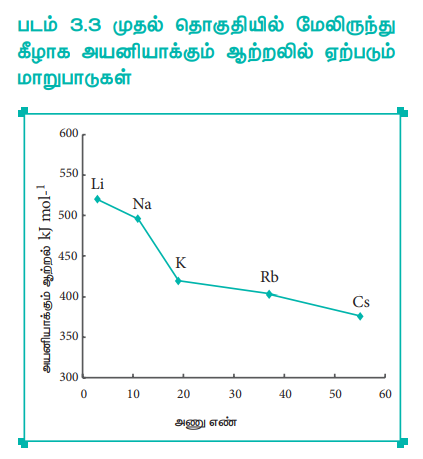
Я«њЯ«░Я»Ђ Я«цЯ»іЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я««Я»ЄЯ«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ђЯ«┤Я«ЙЯ«ЋЯ«џЯ»Ї Я«џЯ»єЯ«▓Я»ЇЯ«▓Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«цЯ»іЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я««Я»ЄЯ«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«хЯ«░Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»ЂЯ«цЯ«┐Я«» Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЄЯ«ЪЯ»ѕЯ«»Я»ЄЯ«»Я«ЙЯ«ЕЯ«цЯ»Ї Я«цЯ»іЯ«▓Я»ѕЯ«хЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я»ђЯ«цЯ«ЙЯ«Е Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»Ї Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Ћ Я«њЯ«░Я»Ђ Я«цЯ»іЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я««Я»ЄЯ«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ђЯ«┤Я»Є Я«џЯ»єЯ«▓Я»ЇЯ«▓Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я«▒Я»ѕЯ«цЯ»ЇЯ«цЯ«▓Я»Ї Я«хЯ«┐Я«│Я»ѕЯ«хЯ»Ђ
Я«њЯ«░Я»Ђ Я«цЯ»іЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я««Я»ЄЯ«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ђЯ«┤Я«ЙЯ«Ћ Я«џЯ»єЯ«▓Я»ЇЯ«▓Я»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»Ї Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Ћ Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЄЯ«ЪЯ»ѕЯ«»Я»ЄЯ«»Я«ЙЯ«Е Я«хЯ«┐Я«▓Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«хЯ«┐Я«џЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«ЅЯ«│Я»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я«▒Я»ѕЯ«цЯ»ЇЯ«цЯ«▓Я»Ї Я«хЯ«┐Я«│Я»ѕЯ«хЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ЂЯ«хЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї, Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я»ђЯ«цЯ»Ђ Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЋЯ«хЯ«░Я»ЇЯ«џЯ»ЇЯ«џЯ«┐ Я«хЯ«┐Я«џЯ»ѕ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є, Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«ЕЯ»Ї Я«ЄЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я«фЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ѕ Я«ЋЯ«ЙЯ«░ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«еЯ«ЙЯ««Я»Ї Я«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї.
Я«фЯ«ЪЯ««Я»Ї 3.3 Я««Я»ЂЯ«цЯ«▓Я»Ї Я«цЯ»іЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я««Я»ЄЯ«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ђЯ«┤Я«ЙЯ«Ћ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«ЙЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї
Я«цЯ«ЕЯ»ЇЯ««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ђЯ«ЪЯ»Ђ
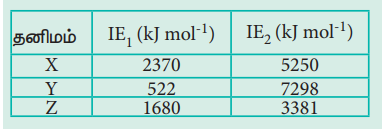
6. X, Y Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Z Я«єЯ«ЋЯ«┐Я«» Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я»ЂЯ«цЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї (IE1) Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«ЙЯ««Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї (IE2) Я«єЯ«ЋЯ«┐Я«»Я«Е Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«БЯ»ЇЯ«Ъ Я«цЯ«ЕЯ«┐Я««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«│Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я»Ї Я«јЯ«цЯ»Ђ? Я««Я«еЯ»ЇЯ«ц Я«хЯ«ЙЯ«»Я»Ђ Я«јЯ«цЯ»Ђ? Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я»Ї Я«јЯ«цЯ»Ђ?
Я«цЯ»ђЯ«░Я»ЇЯ«хЯ»Ђ
Я«јЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я««Я««Я»Ї Я««Я«┐Я«Ћ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я««Я»ЂЯ«цЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»І Я«ЁЯ«цЯ»ЇЯ«цЯ«ЕЯ«┐Я««Я««Я»Є Я««Я«┐Я«Ћ Я«ЁЯ«цЯ«┐Я«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«цЯ«ЕЯ«┐Я««Я««Я»Ї Y Я«ЁЯ«цЯ«┐Я«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
Я«цЯ«ЕЯ«┐Я««Я««Я»Ї X Я««Я«┐Я«Ћ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Е Я««Я»ЂЯ«цЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я«фЯ»єЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ Я«јЯ«ЕЯ«хЯ»Є X Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я««Я«еЯ»ЇЯ«ц Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«цЯ«ЕЯ«┐Я««Я««Я»Ї Z Я«ЕЯ»Ї Я««Я»ЂЯ«цЯ«▓Я»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Y Я«љ Я«хЯ«┐Я«Ъ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«цЯ«ЕЯ«┐Я««Я««Я»Ї Z Я«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я«цЯ«┐Я«▒Я«ЕЯ»Ї Я«цЯ«ЕЯ«┐Я««Я««Я»Ї Y Я«љ Я«хЯ«┐Я«Ъ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ»Ђ.