11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
மோஸ்லே ஆய்வும், நவீன ஆவர்த்தன விதியும்
மோஸ்லே ஆய்வும், நவீன ஆவர்த்தன விதியும்
1913-ல், ஹென்றி மோஸ்லே, பல்வேறு தனிமங்களை அதிக ஆற்றலுடைய எலக்ட்ரான்களைக் கொண்டு மோதச் செய்து அதன் மூலம் உருவான சிறப்பு X கதிர் நிறமாலையினை ஆய்வு செய்தார். இதில் தனிமங்களின் அணு எண்ணிற்கும் உமிழப்பட்ட சிறப்பு X - கதிர்களின் அதிர்வெண்ணிற்கும் நேர்கோட்டுத் தொடர்பு இருப்பதை அவர் கண்டறிந்தார். இத்தொடர்பினை பின்வருமாறு குறிப்பிட்டார்.
√v = a (Z – b)
இங்கு v என்பது 'Z' என்ற அணு எண் கொண்ட தனிமத்தினால் உமிழப்பட்ட 'X' கதிரின் அதிர்வெண். 'a' மற்றும் 'b' ஆகியன மாறிலிகள். மேலும் அனைத்துத் தனிமங்களுக்கும் 'a’ மற்றும் 'b' ஆகியன ஒரே மதிப்புகளைப் பெற்றிருக்கும்.
√v மற்றும் Zக்கு இடையேயான வரைபடம் ஒரு நேர்கோட்டினைத்தரும். இத்தொடர்பினைப் பயன்படுத்தி புதிய தனிமம் ஒன்று வெளியிடும் சிறப்பு X-கதிரின் அதிர்வெண்ணைக் கொண்டு, அத்தனிமத்தின் அணு எண்ணைக் கண்டறிய இயலும்.
மோஸ்லேயின் இந்த ஆய்வின் படி, நவீன ஆவர்த்தன விதி உருவாக்கப்பட்டது. இவ்விதியின்படி "தனிமங்களின் இயற் மற்றும் வேதிப்பண்புகள் அவற்றின் அணுஎண்களின் ஆவர்த்தன சார்பாக அமைகின்றன." இக்கூற்று நவீன ஆவர்த்தன விதி என்றழைக்கப்படுகிறது. இவ்விதியின் அடிப்படையில், தனிமங்கள் அவற்றின் அணுஎண்களின் ஏறுவரிசையில் வரிசைபடுத்தப்பட்டன. இம்முறையில் வரிசைப்படுத்தப்படும் பொழுது ஒரு குறிப்பிட்ட இடைவெளிக்கு பின்னர் ஒத்த பண்புகளை கொண்ட தனிமங்கள் இடம்பெறுகின்றன என்று அறிய முடிந்தது. இவ்வாறு சீரான இடைவெளிகளில் தனிமங்கள் அவற்றின் இயற் மற்றும் வேதிப்பண்புகளில் ஒத்திருப்பது ஆவர்த்தன தன்மை என்றழைக்கப்படுகிறது.
1. நவீன ஆவர்த்தன அட்டவணை
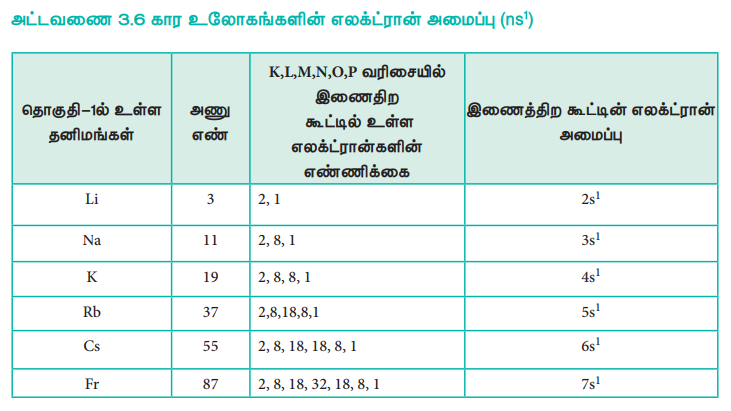
தனிமங்களின் இயற் மற்றும் வேதிப்பண்புகள், அத்தனிமங்களின் வெளிக்கூட்டில் காணப்படும் எலக்ட்ரான் அமைப்போடு தொடர்புடையது. வெவ்வேறு தனிமங்கள் தங்களது வெளிக்கூட்டில் ஒத்த எலக்ட்ரான் அமைப்பினை பெற்றிருப்பின், அவற்றின் பண்புகளும் ஒத்திருக்கும். எடுத்துக்காட்டாக தங்களின் இணைதிறக்கூட்டில் உள்ள s ஆர்பிட்டாலில் ஒரு எலக்ட்ரானைப் பெற்றுள்ள தனிமங்கள் அவைகளின் இயற் மற்றும் வேதிப் பண்புகளில் ஒத்துக் காணப்படுகின்றன. நவீன ஆவர்த்தன அட்டவணையில் இத்தனிமங்கள் அனைத்தும் ஒன்றாக ஒரே தொகுதியில் ஒருங்கிணைக்கப்பட்டு முதல் தொகுதி தனிமங்கள் என அழைக்கப்படுகின்றன.
அட்டவணை 3.6 கார உலோகங்களின் எலக்ட்ரான் அமைப்பு (ns1)
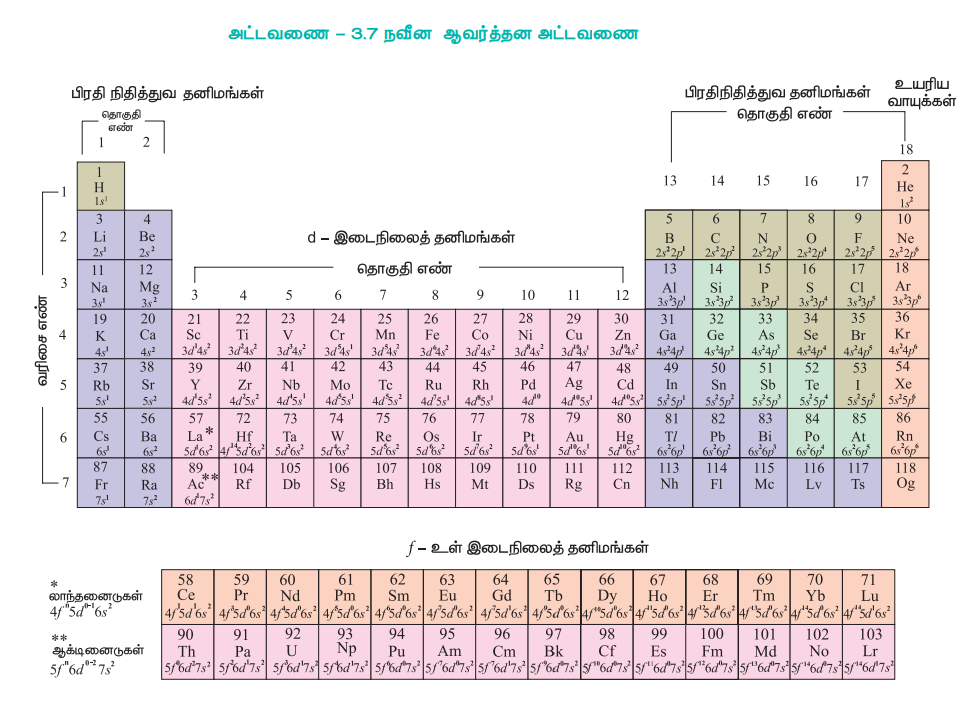
இவ்வாறாக, நவீன ஆவர்த்தன அட்டவணையில் அனைத்து தனிமங்களும் 18 செங்குத்து நிரல்களிலும் 7 கிடைமட்ட நிரைகளிலும் வைக்கப்பட்டுள்ளன. செங்குத்து நிரல்கள் தொகுதிகள் (group) எனவும், கிடைமட்ட நிரைகள் வரிசைகள் (periods) எனவும், அழைக்கப்படுகின்றன. IUPAC விதிமுறையின் படி தொகுதிகள் குறிக்கப்படும் முந்தைய முறையான 1A முதல் VIIA வரை மற்றும் 1B முதல் VIII வரை ஆகியவை மாற்றியமைக்கப்பட்டு 1 முதல் 18 வரையிலான இயல் எண்கள் மூலம் தொகுதிகள் குறிப்பிடப்படுகின்றன.
ஒவ்வொரு வரிசையும், 'ns1' என்ற பொதுவான வெளிக்கூட்டு எலக்ட்ரான் அமைப்பினைக் கொண்டுள்ள தனிமத்தில் துவங்கி ns2np6 என்ற வெளிக்கூட்டு எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள தனிமத்தில் முடிவடைகிறது. இங்கு 'n' என்பது வரிசையின் எண்ணைக் (முதன்மைக் குவாண்டம் எண்) குறிப்பிடுகின்றது. ஆஃபா தத்துவம் மற்றும் அதன் அடிப்படையிலான அணுக்களின் எலக்ட்ரான் அமைப்பானது நவீன தனிமவரிசை அட்டவணைக்கு கருத்து வடிவிலான அடிப்படையைத் தருகின்றது.
தன்மதிப்பீடு
1) மெண்டலீஃபின் தனிம வரிசை அட்டவணைக்கும் நவீன தனிம வரிசை அட்டவணைக்கும் அணுகுமுறையில் உள்ள அடிப்படை வேறுபாடு யாது?
மெண்டலீஃப் தனிமங்களை அவற்றின் அணு நிறைகளின் ஏறுவரிசையிலும், நவீன தனிம வரிசை அட்டவணையில் மோஸ்லே தனிமங்களை அணு எண்ணின் ஏறுவரிசையிலும் அட்டவணைப் படுத்தியுள்ளனர்.
அட்டவணை - 3.7 நவீன ஆவர்த்தன அட்டவணை