தனிமங்களின் ஆவர்த்தன வகைப்பாடு | வேதியியல் - வேதிப்பண்புகளின் ஆவர்த்தனத் தொடர்பு (Periodic trends in chemical properties) | 11th Chemistry : UNIT 3 : Periodic Classification of Elements
11 வது வேதியியல் : அலகு 3 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
வேதிப்பண்புகளின் ஆவர்த்தனத் தொடர்பு (Periodic trends in chemical properties)
வேதிப்பண்புகளின் ஆவர்த்தனத் தொடர்பு (Periodic trends in chemical properties)
அணு ஆரம், அயனியாக்கும் ஆற்றல், எலக்ட்ரான் நாட்டம் மற்றும் எலக்ட்ரான் கவர் தன்மை போன்ற இயற்பண்புகளின் ஆவர்த்தனத் தன்மையினை இதுவரை நாம் கற்றறிந்தோம் இத்துடன் வேதிப்பண்புகளான, வினைத்திறன், இணைதிறன் மற்றும் ஆக்சிஜனேற்ற நிலை முதலியனவும் ஒரு குறிப்பிட்ட அளவிற்கு ஆவர்த்தனத் தொடர்பினைக் கொண்டுள்ளன.
இப்பாடப்பகுதியில், நாம் இணைதிறனில் (ஆக்கிஜனேற்ற நிலை) காணப்படும் ஆவர்த்தனத் தொடர்பினையும், இரண்டாம் வரிசை தனிமங்களின் முரண்பட்ட பண்புகளையும் (மூலைவிட்டத் தொடர்பு) சுருக்கமாக விவாதிப்போம்.
இணைதிறன் அல்லது ஆக்சிஜனேற்ற நிலை
ஒரு அணுவின் இணைதிறன் என்பது ஹைட்ரஜனுடன் ஒப்பிடும் போது அவ்வணுவின் இணையக்கூடிய திறன் எனப்படும். பொதுவாக இது இணைதிறகூட்டில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை அல்லது எட்டிலிருந்து அந்த எலட்ரான்களின் எண்ணிக்கையினைக் கழித்து விட்டு வரும் எண்ணிக்கையாகும். இணைதிறனுக்கு பதிலாக ஆக்சிஜனேற்ற நிலையினைக் குறிப்பிடுவது எளிமையானதாக இருக்கும்.
இணைதிறன் அல்லது ஆக்சிஜனேற்ற நிலையில் காணப்படும் ஆவர்த்தனத் தன்மை
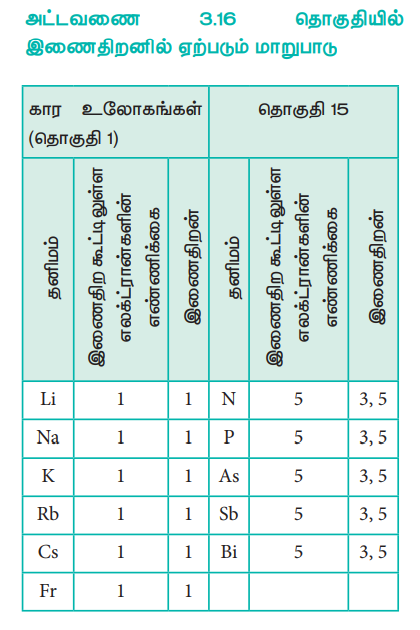
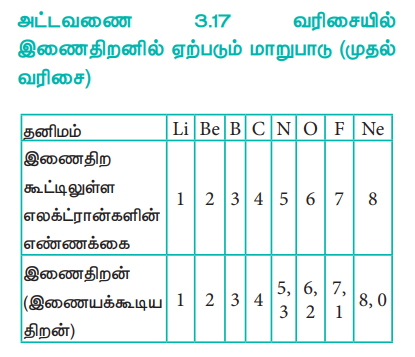
ஒரு அணுவின் இணைதிறன் என்பது அதன் இணைதிற கூட்டில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கையினைப் பொருத்து அமைகிறது. ஒரு தொகுதியில் உள்ள தனிமங்களில் இணைதிற எலக்ட்ரான்களின் எண்ணிக்கை சமம் என்பதால், அதிகபட்சமான இணைதிறன் என்பது மாறாமல் அதே மதிப்பினைப் பெற்றிருக்கும். எனினும் ஒருவரிசையில், இணைதிற எலக்ட்ரான்களின் எண்ணிக்கை அதிகரிப்பதால், இணைதிறனும் அதிகரிக்கின்றது.
அட்டவணை 3.16 தொகுதியில் இணைதிறனில் ஏற்படும் மாறுபாடு
அட்டவணை 3.17 வரிசையில் இணைதிறனில் ஏற்படும் மாறுபாடு (முதல் வரிசை)
மேலும் சில தனிமங்கள் மாறுபடும் ஆக்சிஜனேற்ற நிலைகளைக் கொண்டுள்ளன. எடுத்துக்காட்டாக, தொகுதி 15ல் உள்ள தனிமங்கள் 5 இணைதிற எலக்ட்ரான்களை பெற்றிருந்தாலும், அவற்றில் பெரும்பாலான தனிமங்கள் 3 மற்றும் 5 ஆகிய இரு இணைதிறன்களைப் பெற்றுள்ளன. இதைப்போலவே, இடைநிலை தனிமங்களும், உள் இடைநிலைத் தனிமங்களும் மாறுபடும் ஆக்சிஜனேற்ற நிலைகளைப் பெற்றிருக்கின்றன.
1. இரண்டாம் வரிசை தனிமங்களின் முரண்பட்ட பண்புகள்
ஒரே தொகுதியில் உள்ள தனிமங்கள், ஒரே மாதிரியான இயற் மற்றும் வேதிப் பண்புகளைப் பெற்றுள்ளன. எனினும் ஒவ்வொரு தொகுதியிலும் உள்ள முதல் தனிமமானது அத்தனிமம் இடம்பெற்றுள்ள தொகுதியில் உள்ள பிற தனிமங்களின் பண்புகளிலிருந்து சில முரண்பட்ட பண்புகளைப் பெற்றிருக்கின்றன. உதாரணமாக, கார மற்றும் காரமண் உலோகங்கள் பொதுவாக அயனிச் சேர்மங்களை உருவாக்கும் தன்மையினைப் பெற்றுள்ளன. மாறாக, லித்தியம் மற்றும் பெரிலியம் ஆகியன அதிக அளவில் சகப்பிணைப்புச் சேர்மங்களை உருவாக்குகின்றன. இரண்டாம் வரிசையில் உள்ள தனிமங்கள் அவற்றின் இணைதிற கூட்டில் மொத்தம் நான்கு ஆர்பிட்டால்களை (2s மற்றும் 2p) மட்டும் பெற்றிருக்கின்றன. எனவே அவற்றின் அதிகபட்ச சகப்பிணைப்பு இணைதிறன் 4. ஆனால் அடுத்தடுத்த வரிசைகளில் உள்ள தனிமங்கள் தங்களது இணைதிற கூட்டில் அதிக ஆர்பிட்டால்களைப் பெற்றுள்ளன. எனவே உயர் இணைதிறன் மதிப்புகளைப் பெற்றுள்ளன. எடுத்துக்காட்டாக, போரான் BF4- ஐயும் மற்றும் அலுமினியம் AIF63-ஐயும் உருவாக்குகின்றன.
மூலைவிட்டத் தொடர்பு
தனிம வரிசை அட்டவணையில் மூலைவிட்டமாகச் செல்லும் போது இரண்டாம் மற்றும் மூன்றாம் வரிசையில் உள்ள தனிமங்கள் சில பண்புகளில் ஒத்துக் காணப்படுகின்றன. ஒரு தொகுதியில் காணப்படும் தனிமங்களுக்கிடையே நாம் காணும் பண்புகளைப் போன்று அதிக அளவில் ஒற்றுமைத் தன்மை காணப்படாவிட்டாலும் கூட, பின்வரும் தனிம இணைகளில் இப்பண்பு குறிப்பிடத்தக்க அளவில் உள்ளது.
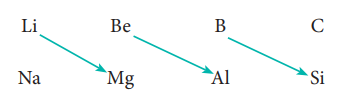
மூலைவிட்டத்தில் அமைந்துள்ள தனிமங்களின் பண்புகளுக்கிடையே காணப்படும் ஒற்றுமைத் தன்மை மூலை விட்டத் தொடர்பு என்றழைக்கப்படுகிறது.
2. ஆவர்த்தன தொடர்பும், வேதிவினைத் திறனும்
முன்னரே கற்றறிந்தவாறு, தனிமங்களின் இயற் மற்றும் வேதிப்பண்புகள் அவைகளின் இணைதிற கூடு எலக்ட்ரான் அமைப்பினைப் பொருத்து அமைகிறது. தனிம வரிசை அட்டவணையில் இடதுபுறம் உள்ள தனிமங்கள் குறைவான அயனியாக்கும் ஆற்றலைப் பெற்றிருக்கின்றன. மேலும் எளிதில் இணைதிற எலக்ட்ரான்களை இழக்கும் தன்மையினையும் பெற்றுள்ளன. தனிம வரிசை அட்டவணையின், வலது புறத்தில் காணப்படும் தனிமங்கள் அதிக எலக்ட்ரான் கவர் தன்மையினைப் பெற்றிருப்பதால் அவைகள் எளிதில் எலக்ட்ரான்களை ஏற்கும் இயல்பினைப் பெற்றுள்ளன. இதன் விளைவாக, தனிம வரிசை அட்டவணையில் இரு பக்கங்களிலும் அமைந்துள்ள தனிமங்கள், நடுவில் உள்ள தனிமங்களோடு ஒப்பிடும் போது அதிக வினைத்திறனைப் பெற்றுள்ளன. மாறாக, மந்த வாயுக்கள் முழுவதும் நிரப்பப்பட்ட எலக்ட்ரான் அமைப்பினைப் பெற்றிருப்பதால் அவைகள் எலக்ட்ரான்களை ஏற்பதோ, இழப்பதோ இல்லை. எனவே அவைகள் எத்தகைய வேதிவினைகளிலும் இயல்பாக ஈடுபடுவதில்லை.
அயனியாக்கும் ஆற்றலானது, உலோகத் தன்மையுடன் நேரடியாக தொடர்புபடுத்தக் கூடியதாகும். மேலும் தனிம வரிசை அட்டவணையின் இடதுபுறத்தின் கீழ்ப்பகுதியில் உள்ள தனிமங்கள் குறைவான அயனியாக்கும் ஆற்றலைப் பெற்றுள்ளதால் அவைகள் உலோகத் தன்மையினைப் பெற்றுள்ளன. மாறாக, வலது புறத்தின் மேற்பகுதியில் உள்ள தனிமங்கள் அதிக அயனியாக்கும் ஆற்றலைப் பெற்றுள்ளதால், அவைகள் அலோகத் தன்மையினைப் பெற்றுள்ளன.
தனிம வரிசை அட்டவணையின் இரு புறங்களிலும் உள்ள தனிமங்களால் உருவாக்கப்படும் சேர்மங்களின் இயல்பினை நாம் ஆய்ந்து அறிவோம். கார உலோகங்கள் மற்றும் ஹாலஜன்கள் ஆக்சிஜனுடன் வினைபுரிந்து அவைகளின் ஆக்சைடுகளைத் தருகின்றன.
4 Na + O2 → 2 Na2O
2 Cl2 + 7 O2 → 2 Cl2 O7
சோடியம் ஆக்சைடு நீருடன் வினைபட்டு, வலிமைமிக்க காரமான சோடியம் ஹைட்ராக்ஸைடைத் தருகிறது. இது ஒரு காரஆக்ஸைடு ஆகும். மாறாக Cl2O7 நீருடன் வினைபட்டு வலிமைமிக்க அமிலமான பெர்குளோரிக் அமிலத்தினை தருகிறது. எனவே, இது ஒரு அமில ஆக்ஸைடாகும்.
Na2O + H2O → 2 NaOH (காரம்)
Cl2O7 + H2O → 2 HClO4 (அமிலம்)
எனவே, தனிம வரிசை அட்டவணையின் இரு புறங்களிலும் உள்ள தனிமங்கள் எதிர்பார்த்தபடியே வெவ்வேறு பண்புகளைப் பெற்றுள்ளன.
ஒரு தொகுதியில் மேலிருந்து கீழாகச் செல்லும் போது, அயனியாக்கும் ஆற்றல் குறைந்து கொண்டே வருகிறது. மேலும் தனிமங்களின் நேர்மின் தன்மையானது அதிகரிக்கின்றது. எனவே இத்தனிமங்களின் ஹைட்ராக்ஸைடுகள் அதிக காரத் தன்மையினைக் கொண்டிருக்கின்றன. இரண்டாம் தொகுதி ஹைட்ராக்சைடுகளின் இயல்பினை நாம் கருதுவோம்.
Be(OH)2 ஈரியல்புத்தன்மை உடையது, Mg(OH)2 வலிமை குறைந்த காரம், Ba(OH)2 வலிமை மிக்க காரம்.
பெரிலியம் ஹைட்ராக்ஸைடு அமிலம் மற்றும் காரம் ஆகிய இரண்டுடனும் வினைபுரிகின்றது எனவே இது ஈரியல்புத் தன்மை உடையது.
Be(OH)2 + 2 HCl → BeCl2 + 2H2O
Be(OH)2 + 2 NaOH → Na2BeO2 + 2 H2O
செயல்பாடு 3.2
வெவ்வேறு தொகுதிகள் மற்றும் வரிசைகளில் அமைந்துள்ள தனிமங்களின் எலக்ட்ரான் கவர் தன்மை மதிப்பானது பாலிங் அளவீட்டில் அட்டவணைப் படுத்தப்பட்டுள்ளது. அணு எண்ணிற்கு எதிராக இம்மதிப்புகளை வரைபடத்தில் குறிக்க இவ்வரைபடத்திலிருந்து, தொகுதி மற்றும் தொடரில் இம்மதிப்பு எவ்வாறு வேறுபடுகிறது என விளக்குக.
2-ம் தொகுதித் தனிமங்கள், :
Be(1.6), Mg(1.2), Ca(1.0), Sr(1.0) Ba(0.9)
17-ம் தொகுதித்தனிமங்கள், : F(4.0), Cl(3.0), Br(2.8), I(2.5)
3-ம் வரிசைத் தனிமங்கள் : Na(0.9), Mg(1.2), Al(1.5), Si(1.8), P(2.1), S(2.5), Cl(3.0)
4-ம் வரிசைத் தனிமங்கள் : K(0.8), Ca(1.0), Sc(1.3), Ti(1.5), V(1.6), Cr(1.6), Mn(1.5), Fe(1.8), Co(1.9), Ni(1.9), Cu(1.9), Zn(1.6), Ga(1.6), Ge(1.8), As(2.0), Se(2.4), Br(2.8)