10Я«хЯ«цЯ»Ђ Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«»Я«▓Я»Ї : Я«ЁЯ«▓Я«ЋЯ»Ђ 10 : Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я»Ї
Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я»Ї
Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї
Я«хЯ»ЄЯ«ЋЯ««Я»Ї
Я«ЄЯ«цЯ»ЂЯ«хЯ«░Я»ѕ Я«еЯ«ЙЯ««Я»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ«▓Я»ЇЯ«хЯ»ЄЯ«▒Я»Ђ
Я«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї, Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї, Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЄЯ«»Я«▓Я»ЇЯ«фЯ»ѕЯ«»Я»ЂЯ««Я»Ї
Я«фЯ«▒Я»ЇЯ«▒Я«┐ Я«хЯ«┐Я«хЯ«ЙЯ«цЯ«┐Я«цЯ»ЇЯ«цЯ»ІЯ««Я»Ї. Я«еЯ«ЙЯ««Я»Ї Я«ЋЯ»ђЯ«┤Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«БЯ»ЇЯ«Ъ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ»ІЯ««Я»Ї.
┬и Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї
┬и Я«ЅЯ«БЯ«хЯ»Ђ Я«џЯ»єЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї
┬и Я«фЯ»єЯ«ЪЯ»ЇЯ«░Я»ІЯ«▓Я»Ї Я«јЯ«░Я«┐Я«цЯ«▓Я»Ї
┬и Я«фЯ«ЙЯ«▒Я»ѕЯ«ЋЯ«│Я»Ї Я«џЯ«┐Я«цЯ»ѕЯ«хЯ«ЪЯ»ѕЯ«цЯ«▓Я»Ї
Я«њЯ«хЯ»ЇЯ«хЯ»іЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«јЯ«хЯ»ЇЯ«хЯ«│Я«хЯ»Ђ Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ
Я«еЯ«ЪЯ»ѕЯ«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ? Я««Я«┐Я«Ћ Я««Я»єЯ«цЯ»ЂЯ«хЯ«ЙЯ«Е Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я««Я«┐Я«Ћ Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Е Я«хЯ«┐Я«ЕЯ»ѕ Я«хЯ«░Я»ѕ Я«хЯ«░Я«┐Я«џЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»Ђ? Я«јЯ«цЯ»Ђ Я««Я»єЯ«цЯ»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ? Я«јЯ«цЯ»Ђ Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ? Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ
Я«јЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«еЯ»ђ Я«цЯ»ђЯ«░Я»ЇЯ««Я«ЙЯ«ЕЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«»Я»Ї? Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕ Я«јЯ«хЯ»ЇЯ«хЯ«│Я«хЯ»Ђ Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ
Я«еЯ«ЪЯ»ѕЯ«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕЯ«цЯ»Ї Я«цЯ»ђЯ«░Я»ЇЯ««Я«ЙЯ«ЕЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«хЯ«┤Я«┐Я«ЋЯ«│Я»ЂЯ«│Я»Ї Я«њЯ«ЕЯ»ЇЯ«▒Я»ѕЯ«фЯ»Ї Я«фЯ«▒Я»ЇЯ«▒Я«┐ Я«фЯ«ЙЯ«░Я»ЇЯ«фЯ»ЇЯ«фЯ»ІЯ««Я»Ї. Я«ЋЯ»ЂЯ«▒Я«┐Я«цЯ»ЇЯ«ц
Я«ЋЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«фЯ»Ї Я«фЯ«┐Я«▒Я«ЋЯ»Ђ Я«њЯ«░Я»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ѕЯ«ЪЯ»ЂЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї, Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«ЋЯ«┐Я«»Я«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»Ђ Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ 100 Я«ЋЯ«┐Я«░Я«ЙЯ««Я»Ї Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ»ІЯ««Я»Ї. Я«њЯ«░Я»Ђ Я««Я«БЯ«┐
Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«фЯ»Ї Я«фЯ«┐Я«▒Я«ЋЯ»Ђ 50 Я«ЋЯ«┐Я«░Я«ЙЯ««Я»Ї РђўAРђЎ Я««Я»ђЯ«цЯ««Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ
Я«јЯ«ЕЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї.
A Рєњ Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї
Я««Я«▒Я»ЇЯ«▒Я»іЯ«░Я»Ђ Я«хЯ«ЋЯ»ѕЯ«»Я«┐Я«▓Я»Ї 100 Я«ЋЯ«┐Я«░Я«ЙЯ««Я»Ї РђўCРђЎ
Я«јЯ«ЕЯ»ЇЯ«▒ Я«хЯ»ЄЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«њЯ«░Я»Ђ Я««Я«БЯ«┐ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«фЯ»Ї Я«фЯ«┐Я«▒Я«ЋЯ»Ђ 20 Я«ЋЯ«┐Я«░Я«ЙЯ««Я»Ї РђўCРђЎ Я«јЯ«ъЯ»ЇЯ«џЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ Я«јЯ«ЕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї.
C Рєњ Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї
Я«ЄЯ«фЯ»ЇЯ«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ Я«ЁЯ«цЯ«┐Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Е Я«хЯ«┐Я«ЕЯ»ѕ Я«јЯ«цЯ»ЂЯ«хЯ»єЯ«ЕЯ»ЇЯ«▒Я»Ђ
Я«ЅЯ«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЋЯ»ѓЯ«▒ Я«ЄЯ«»Я«▓Я»ЂЯ««Я«Й? Я««Я»ЂЯ«цЯ«▓Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї 50Я«ЋЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«Ћ
Я««Я«ЙЯ«▒Я«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«ЙЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї 80 Я«ЋЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї 1 Я««Я«БЯ«┐ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ«ЙЯ«хЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕ Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ
Я«еЯ«ЪЯ»ѕЯ«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ«│Я«хЯ»ђЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ»ЄЯ«Ћ Я««Я»ЂЯ«▒Я»ѕ Я«јЯ«ЕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї.
РђюЯ«њЯ«░Я»Ђ Я«хЯ»ЄЯ«цЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї
Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«ЊЯ«░Я«▓Я«ЋЯ»Ђ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЈЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»ЂЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї
Я«ЁЯ«│Я«хЯ»Ђ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«џЯ»єЯ«▒Я«┐Я«хЯ«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«ЙЯ«▒Я»ЇЯ«▒Я««Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї."
Я«ЋЯ»ђЯ«┤Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«БЯ»ЇЯ«Ъ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ»ІЯ««Я»Ї.
A Рєњ B
Я«ЄЯ«хЯ»ЇЯ«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ
Я«јЯ«┤Я»ЂЯ«цЯ»ЂЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
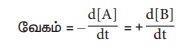
Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ђ [A] Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ A Я«ЄЯ«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
[B] Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ B Я«ЄЯ«ЕЯ»Ї
Я«џЯ»єЯ«▒Я«┐Я«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
РђўЯ«јЯ«цЯ«┐Я«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«▒Я«┐РђЎ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ A Я«ЄЯ«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«цЯ»ѕЯ«ЋЯ»Ї
Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«еЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«▒Я«┐ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ B Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ
Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«хЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ»Ђ: Рђў[ ]РђЎ Я«ЋЯ»ЂЯ«▒Я«┐ Я«џЯ»єЯ«▒Я«┐Я«хЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. РђўdРђЎ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«ЋЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я«џЯ»єЯ«▒Я«┐Я«хЯ«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«┐Я«ЋЯ«џЯ»Ї Я«џЯ«┐Я«▒Я«┐Я«» Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«цЯ»ЇЯ«цЯ»ѕЯ«ЋЯ»Ї
Я«ЋЯ»ЂЯ«▒Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї
Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«ЈЯ«ЕЯ»Ї Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ?
Я«хЯ«┐Я«ЕЯ»ѕ Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ
Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЁЯ«цЯ«┐Я«Ћ Я«ЁЯ«│Я«хЯ»Ђ Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ«┐Я«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«њЯ«░Я»Ђ
Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«▓Я«ЙЯ«│Я«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЁЯ«цЯ«┐Я«Ћ Я«ЁЯ«│Я«хЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕ Я«хЯ«┐Я«│Я»ѕ Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«фЯ»єЯ«░Я»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ»ЄЯ«ЋЯ««Я»Ї
Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я««Я«ЙЯ«ЕЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЅЯ«БЯ«хЯ»Ђ Я«фЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ
Я«ЋЯ»ЂЯ«▒Я»ѕЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«БЯ«хЯ»Ђ Я«ЋЯ»єЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«фЯ»ІЯ«хЯ«цЯ»ѕ Я«цЯ«хЯ«┐Я«░Я»ЇЯ«ЋЯ»ЇЯ«Ћ Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я««Я«ЙЯ«ЕЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї
Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«ЙЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«░Я«БЯ«┐Я«ЋЯ«│Я»Ї
Я«њЯ«░Я»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я««Я«ЙЯ«▒Я»ЇЯ«▒ Я«ЄЯ«»Я«▓Я»ЂЯ««Я«Й? Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ
Я««Я«ЙЯ«▒Я»ЇЯ«▒ Я«ЄЯ«»Я«▓Я»ЂЯ««Я»Ї. Я«ј.Я«ЋЯ«Й Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«еЯ«ЪЯ»ѕЯ«фЯ»єЯ«▒Я»ЂЯ«хЯ«цЯ»ѕ Я«хЯ«┐Я«Ъ Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї
Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ Я«еЯ«ЪЯ»ѕЯ«фЯ»єЯ«▒Я»ЂЯ««Я»Ї, Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«ЙЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«ЋЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»
Я«ЋЯ«ЙЯ«░Я«БЯ«┐Я«ЋЯ«│Я»Ї
1. Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ
Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ
2. Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ
3. Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ
4. Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѓЯ«ЋЯ»ЇЯ«ЋЯ«┐
5. Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї
6. Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я«┐Я«ЕЯ»Ї
Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ«│Я«хЯ»Ђ
i. Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ
Я«џЯ»ІЯ«ЪЯ«┐Я«»Я««Я»Ї, Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї
Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«џЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«┐Я«ЋЯ»Ї
Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я««Я»єЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕ Я«фЯ»ЂЯ«░Я«┐Я«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЈЯ«ЕЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«ЅЯ«ЕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й? Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї, Я«ЁЯ«џЯ«┐Я«ЪЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ
Я«хЯ«┐Я«Ъ Я«хЯ«┐Я«ЕЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«┐Я«ЋЯ»ЇЯ«ЋЯ«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»ЂЯ«фЯ»іЯ«░Я»ЂЯ«│Я«┐Я«ЕЯ»Ї Я«ЄЯ«»Я«▓Я»ЇЯ«фЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«ЙЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2Na(s) + 2HCl(aq) Рєњ 2NaCl(aq) +
H2 (g) (Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ)
2Na(s) + 2CH3COOH(aq) Рєњ 2CH3COONa(aq) +
H2(g) (Я««Я»єЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ)
ii. Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ
Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ
Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ»ЄЯ«ЋЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«ЋЯ«Е Я«ЁЯ«│Я«хЯ»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї
Я«ЋЯ«░Я»ѕЯ«еЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│ Я«ЋЯ«░Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»Є Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ
Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«ЋЯ«ЕЯ«ЁЯ«│Я«хЯ«┐Я«▓Я»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Ћ Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї
Я«хЯ»ЄЯ«ЋЯ««Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї.
Я«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«еЯ«ЙЯ«Ћ Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»Ї, 1 M Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї
Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕЯ«хЯ«┐Я«Ъ 2M Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕ
Я«фЯ»ЂЯ«░Я«┐Я«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«цЯ»Ђ.
iii. Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ
Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ Я«ЅЯ«»Я«░Я»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї
Я«хЯ»ЄЯ«ЋЯ««Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї Я«хЯ»єЯ«фЯ»ЇЯ«фЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»ЂЯ«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї
Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«јЯ«│Я«┐Я«цЯ«┐Я«▓Я»Ї Я«ЅЯ«ЪЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«▒Я»ѕ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї
Я«ЋЯ«ЙЯ«▓Я»ЇЯ«џЯ«┐Я«»Я««Я»Ї Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»Ї Я««Я»єЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї
Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї.
Я«ЅЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»єЯ«░Я«┐Я«»Я»ЂЯ««Я«Й?
Я«ЁЯ«▒Я»ѕ
Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«ЅЯ«БЯ«хЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ЂЯ«│Я«┐Я«░Я»Ї Я«џЯ«ЙЯ«цЯ«ЕЯ«фЯ»Ї Я«фЯ»єЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я«┐Я«▓Я»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї
Я«ЅЯ«БЯ«хЯ»ѕ Я«хЯ«┐Я«Ъ Я«хЯ«┐Я«░Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЋЯ»єЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«фЯ»ЇЯ«фЯ»ІЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЋЯ»ЂЯ«│Я«┐Я«░Я»ЇЯ«џЯ«ЙЯ«цЯ«Е Я«фЯ»єЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЋЯ«│Я»Ї Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЁЯ«▒Я»ѕ
Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ Я«хЯ«┐Я«Ъ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«БЯ«хЯ»Ђ
Я«ЋЯ»єЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«фЯ»ЇЯ«фЯ»ІЯ«ЋЯ»ЂЯ««Я»Ї Я«хЯ»ЄЯ«ЋЯ««Я»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї.
iv. Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї
Я«хЯ«ЙЯ«»Я»ЂЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ
Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ««Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї
Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я««Я«┐Я«Ћ Я«ЁЯ«░Я»ЂЯ«ЋЯ»Є Я«хЯ«еЯ»ЇЯ«цЯ»Ђ
Я«ЁЯ«ЪЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«ЪЯ«┐ Я««Я»ІЯ«цЯ«▓Я«┐Я«▓Я»Ї Я«ѕЯ«ЪЯ»ЂЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
v. Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѓЯ«ЋЯ»ЇЯ«ЋЯ«┐
Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѓЯ«ЋЯ»ЇЯ«ЋЯ«┐ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї
Я«еЯ»ЄЯ«░Я«ЪЯ«┐Я«»Я«ЙЯ«Ћ Я«ѕЯ«ЪЯ»ЂЯ«фЯ«ЪЯ«ЙЯ«цЯ»Ђ, Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЁЯ«хЯ»ЇЯ«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї.
Я«фЯ»іЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«џЯ«┐Я«»Я««Я»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ЄЯ«ЪЯ»ЇЯ«ЪЯ»ѕ
Я«џЯ»ѓЯ«ЪЯ»ЂЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»Ї Я««Я«┐Я«ЋЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Е Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї
Я««Я«ЙЯ«ЎЯ»ЇЯ«ЋЯ«ЕЯ»ђЯ«џЯ»Ђ Я«ЪЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«фЯ«┐Я«▒Я«ЋЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»Ї Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я»ЂЯ««Я»Ї Я«хЯ»ЄЯ«ЋЯ««Я»Ї
Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
vi. Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ«│Я«хЯ»Ђ
Я«хЯ»ЄЯ«цЯ«┐Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЋЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я«ЙЯ«Е Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ
Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«хЯ«┐Я«Ъ, Я«цЯ»ѓЯ«│Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я»ЇЯ«ЋЯ«│Я»Ї Я«хЯ«┐Я«░Я»ѕЯ«хЯ«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї
Я«јЯ«ЋЯ«Й Я«ЋЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я«ЙЯ«Е Я«ЋЯ«ЙЯ«▓Я»ЇЯ«џЯ«┐Я«»Я««Я»Ї Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»ЇЯ«ЪЯ»ѕ
Я«хЯ«┐Я«Ъ Я«цЯ»ЂЯ«│Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЋЯ«ЙЯ«▓Я»ЇЯ«џЯ«┐Я«»Я««Я»Ї Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я»ІЯ«ЋЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я««Я«┐Я«Ћ Я«хЯ«┐Я«░Я»ѕЯ«хЯ«ЙЯ«Ћ
Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я»ЂЯ««Я»Ї, Я«ЈЯ«ЕЯ»єЯ«ЕЯ«┐Я«▓Я»Ї Я«цЯ»ѓЯ«│Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЋЯ«ЙЯ«▓Я»ЇЯ«џЯ«┐Я«»Я««Я»Ї Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ«│Я«хЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ«│Я«хЯ»Ђ
Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«хЯ«┐Я«ЕЯ»ѕ Я«хЯ»ЄЯ«ЋЯ««Я«ЙЯ«Ћ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.