10வது அறிவியல் : அலகு 10 : வேதிவினைகளின் வகைகள்
வேதிவினைகளின் வகைகள்
வேதிவினைகளின்
வகைகள்:
1. அணுக்களின்
மறுசீரமைப்பு தன்மையைப் பொறுத்து வகைப்படுத்துதல்.
இதுவரை நீங்கள், வேதிவினைகள்
பற்றியும், அவை எவ்வாறு வேதிச் சமன்பாடாகக்
குறிக்கப்படுகின்றன என்றும் கற்றறிந்தீர்கள். ஒவ்வொருநாளும் அதிக எண்ணிக்கையிலான
வேதிவினைகள் நம்மைச் சுற்றி நடக்கின்றன. அவை எல்லாம் ஒரே வகையாக நடக்கின்றனவா?
இல்லை.
ஒவ்வொரு வினையும் பல்வேறு வகையான
அணுக்களை உள்ளடக்கியது. எனவே அவை வினைபடும் விதமும் வேறுபடுகிறது. எனவே ஒரு
வினையில் ஈடுபடும் வினைபடு பொருளின் அணுக்கள் எவ்வாறு மாற்றியமைக்கப்படுகின்றன
என்பதன் அடிப்படையில் வேதிவினைகளை பின்வருமாறு வகைப்படுத்தப்படுகிறது.
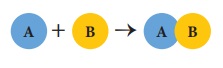
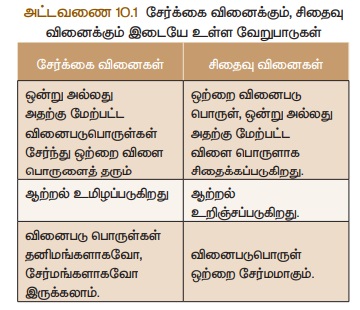
அ) சேர்க்கை அல்லது கூடுகை வினைகள்
இரண்டு அல்லது அதற்கு மேற்பட்ட
வினைபடு பொருள்கள் இணைந்து ஒரு சேர்மம் உருவாகும் வினை சேர்க்கை அல்லது கூடுகை
வினை ஆகும். இதனை “தொகுப்பு வினை” அல்லது “இயைபு
வினை” என்றும் அழைக்கலாம். 'A’ மற்றும்
‘B‘ இணைந்து ‘AB’ என்ற சேர்மம்
உருவாக்கும் சேர்க்கை வினையின் பொதுவான வடிவம் கீழே கொடுக்கப்பட்டுள்ளது.
எடுத்துக்காட்டு : ஹைட்ரஜன் வாயு
குளோரினுடன் இணைந்து ஹைட்ரஜன் குளோரைடு வாயுவை தருகிறது.
H2(g) + Cl2(g) → 2HCl(g)
வினைபடு பொருளின் தன்மையைப்
பொருத்து சேர்க்கை வினைகள் “மூன்று வகைகளாக” பிரிக்கப்படுகின்றன.
* தனிமம் + தனிமம் → சேர்மம்
இந்த வகை சேர்க்கை வினைகளில், இரண்டு தனிமங்கள்
ஒன்றோடொன்று இணைந்து ஒரு சேர்மத்தைத் தருகின்றன. இவ்வகை வினைகள் உலோகம் மற்றும்
அலோகங்களுக்கிடையே அல்லது இரண்டு அலோகங்களுக்கிடையே நடைபெறலாம்.
எடுத்துக்காட்டு
1: திட கந்தகம்
(சல்பர்) ஆக்சிஜனுடன் வினை புரிந்து கந்தக டை ஆக்சைடு உருவாகிறது. இவ்வினையின் இரு
வினைபடு பொருள்களும் அலோகங்கள் ஆகும்.

எடுத்துக்காட்டு
2 : வெள்ளி போன்ற
வெண்மையான சோடியமானது வெளிறிய பச்சை கலந்த மஞ்சள் வாயுவான குளோரினுடன் இணையும்
போது, உண்ணத் தகுந்த சோடியம் குளோரைடைத் தருகிறது. இங்கு
வினைபடு பொருள்களில், ஒன்று உலோகம் (சோடியம்), மற்றொன்று அலோகம் (குளோரின்) ஆகும்.
2Na(s) + Cl2(g) →
2NaCl(s)
சோதிக்க:
பின்வரும் அட்டவணையில்
கொடுக்கப்பட்ட உலோகங்கள் மற்றும் அலோகங்கள் இடையே சாத்தியமான கூடுகை வினை அல்லது
சேர்க்கை வினைகளை கண்டறிந்து அவற்றின் சமன் செய்யப்பட்ட வினைகளை(சமன்பாட்டை)
எழுதுங்கள்.

* சேர்மம் + தனிமம் → சேர்மம்
இவ்வகை சேர்க்கை வினையில், ஒரு சேர்மம்
மற்றொரு தனிமத்துடன் சேர்ந்து ஒரு புதிய சேர்மத்தை தருகிறது.
எடுத்துக்காட்டு: பாஸ்பரஸ் டிரை
குளோரைடு, குளோரினுடன்
இணைந்து பாஸ்பரஸ் பெண்டா குளோரைடைத் தருகிறது.
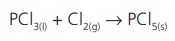
* சேர்மம் + சேர்மம் → சேர்மம்
இச்சேர்க்கை வினையில் இரண்டு
சேர்மங்கள் சேர்ந்து ஒரு புதிய சேர்மத்தை உருவாக்குகின்றன. பின்வரும் வினையில்
சிலிக்கான் டை ஆக்சைடு, கால்சியம் ஆக்சைடுடன் வினைபுரிந்து கால்சியம் சிலிகேட்டைத் தருகிறது.
SiO2(s) + CaO(s) →
CaSiO3(s)
இயற்கையில் நிகழும் பெரும்பாலான
சேர்க்கை வினைகள் வெப்ப உமிழ் வினைகளாகும். ஏனெனில், இங்கு புதிய பிணைப்புகள் உருவாக்கப்படுவதால்,
அதிக ஆற்றல் வெப்பமாக வெளியிடப்படுகிறது.
ஆ) சிதைவு வினைகள்
தகுந்த சூழ்நிலையில் ஒரு சேர்மம்
சிதைவுற்று இரண்டு அல்லது அதற்கு மேற்பட்ட எளிய மூலக்கூறுகளாக சிதைவுறும் வினை
சிதைவுவினை எனப்படும். இவ்வினை சேர்க்கை வினைக்கு எதிர்வினை ஆகும். ஒரு சிதைவு
வினையின் பொதுவான வடிவம் கீழே தரப்பட்டுள்ளது.

சிதைவு வினையின் ஒரு முக்கிய
நிகழ்வு, பிணைப்புகள்
உடைவதேயாகும். எனவே இவ்வினையின் போது பிணைப்புகள் உடைய ஆற்றல் தேவைப்படுகிறது.
அவ்வாறு பயன்படுத்தப்படும் ஆற்றலின் இயல்பைக் பொருத்து சிதைவு வினைகள் மூன்று
வகைகளாகப் பிரிக்கப்படுகின்றன.
i) வெப்பச் சிதைவு
வினைகள்
ii) மின்னாற் சிதைவு
வினைகள்
iii) ஒளிச் சிதைவு
வினைகள்
உங்களுக்குத் தெரியுமா?
சுவற்றில்
வெள்ளையடிக்க நீற்றுச் சுண்ணாம்பு கரைசலைப் பயன்படுத்துகிறோம். கால்சியம் ஹைட்ராக்சைடு, காற்றில் இருக்கும் கார்பன்-டை-ஆக்சைடுடன் வினை புரிந்து கால்சியம்
கார்பனேட் உருவாகி மெல்லிய படலமாக சுவர்களில் படிகிறது. வெள்ளையடித்த இரண்டு
அல்லது மூன்று தினங்களில் கால்சியம் கார்பனேட் சுவர்களுக்கு ஒரு மினுமினுப்புத்
தன்மையைத் தருகிறது. சுண்ணாம்புக்கல்லின் (மார்பிள்) வேதி வாய்ப்பாடு CaCO3
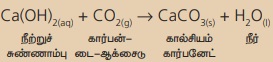
i) வெப்பச் சிதைவு வினைகள்
இவ்வகை வினையில் வினைபடுபொருள்
வெப்பத்தினால் சிதைவுறுகிறது.
எடுத்துக்காட்டு : மெர்குரி (II) ஆக்ஸைடு
வெப்பத்தினால் சிதைவுற்று மெர்குரி மற்றும் ஆக்சிஜன் வாயுவாக மாறுகிறது. வெப்பத்தை
எடுத்துக் கொண்டு இவ்வினை நிகழ்வதால் இது வெப்பச் சிதைவு வினை
எனப்படுகிறது. மேலும் இவ்வினை, சேர்மத்திலிருந்து தனிமம் /
தனிமம் சிதைவடைதல் என்ற வகையைச் சார்ந்தது. அதாவது மெர்குரிக் ஆக்ஸைடு, மெர்குரி மற்றும் ஆக்சிஜன் என்ற தனிமங்களாகச் சிதைவடைகிறது.
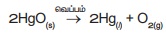
இது போன்று, கால்சியம்
கார்பனேட்டை வெப்பப்படுத்தும் போது அது சிதைவுற்று கால்சியம் ஆக்சைடு மற்றும்
கார்பன்-டை- ஆக்சைடாக மாறுகிறது. இவ்வினை சேர்மத்திலிருந்து சேர்மம் / சேர்மம்
என்ற வகையைச் சார்ந்தது.
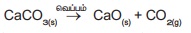
வெப்பச்சிதைவு வினைகளில்
பிணைப்புகளை உடைப்பதற்கு வெப்பம் தரப்படுகிறது. இது போன்ற வெப்பத்தை உறிஞ்சும்
வினைகளை "வெப்பகொள் வினைகள்”
எனலாம்.
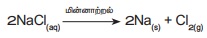
ii) மின்னாற் சிதைவு வினைகள்
சில சிதைவு வினைகளில் மின்னாற்றல்
வினையை நிகழ்த்தப் பயன்படுகிறது. எடுத்துக்காட்டாக சோடியம் குளோரைடு கரைசலில்
மின்னாற்றலைசெலுத்தும்போது சோடியம் குளோரைடு சிதைவுற்று உலோக சோடியம் மற்றும்
குளோரின் வாயு உருவாகின்றன. இந்நிகழ்வு "மின்னாற் பகுப்பு"
எனப்படும்.
இங்கு சோடியம் குளோரைடு, சோடியம் மற்றும்
குளோரின் என்ற தனிமங்களாக மாறுகின்றது. எனவே இது சேர்மத்திலிருந்து தனிமம் -
தனிமம் என்ற வகையைச் சேர்ந்தது.
iii) ஒளிச்சிதைவு வினைகள்
ஒளியானது சிதைவு வினைகளை
நிகழ்த்தும் மற்றொரு வகை ஆற்றல் ஆகும். எடுத்துக்காட்டு: சில்வர் புரோமைடு மீது
ஒளி படும் பொழுது, அது சிதைவுற்று சில்வர் உலோகத்தையும், புரோமின்
வாயுவையும் தருகிறது. ஒளியானது இச்சிதைவை நிகழ்த்துவதால் இவ்வினை "ஒளிச்சிதைவு"
எனப்படும்.

இங்கு மஞ்சள் நிற சில்வர் புரோமைடு
சாம்பல் நிற சில்வர் உலோகமாக மாறுகிறது. இதுவும் சேர்மத்திலிருந்து தனிமம் -
தனிமம் என்ற சிதைவுறுதல் வகைக்கு எடுத்துக்காட்டாகும்.
இ) ஒற்றை இடப்பெயர்ச்சி வினைகள்
இவ்வகை வினை ஒரு தனிமம் மற்றும்
சேர்மத்திற்கிடையே நிகழ்வதாகும். அவை வினைபடும் பொழுது சேர்மத்திலுள்ள ஒரு தனிமம்
மற்றொரு தனிமத்தால் இடப்பெயர்ச்சி அடைந்து புதிய சேர்மத்தையும், தனிமத்தையும்
தருகிறது. ஒற்றை இடப்பெயர்ச்சி வினைகளின் பொதுவான வடிவம் வருமாறு :

தனிமம் ‘A’, ஆனது 'B'
என்ற தனிமத்தை அதனுடைய சேர்மமான 'BC’ -யிலிருந்து
இடப்பெயர்ச்சி செய்கிறது. எனவே இது ஒற்றை இடப்பெயர்ச்சி வினை எனப்படுகிறது.
துத்தநாக உலோகத்தை ஹைட்ரோகுளோரிக்
அமிலத்தில் வைக்கும் பொழுது ஹைட்ரஜன் வாயு வெளிவருகிறது. இங்கு ஹைட்ரஜன்
துத்தநாகத்தால் இடப்பெயர்ச்சி செய்யப்பட்டு துத்தநாக குளோரைடு உருவாகிறது.
Zn(s) + 2HCl(aq) →
ZnCl2(aq) + H2(g)
Fe(s) + CuSO4(aq) →
FeSO4(aq) + Cu(s)
படம் 10.2-இல்
காட்டியுள்ளபடி காப்பர் (II) சல்பேட்டின் நீர்க்கரைசலில் ஒரு
இரும்பு ஆணியை வைக்கும் பொழுது இரும்பு, காப்பரை
இடப்பெயர்ச்சி செய்கிறது.

வினைபடுபொருள்களில் வேறுபட்ட
சேர்க்கை மூலம் இதுபோன்ற பல்வேறு வினைகளை நாம் முன் வைக்க முடியும். ஆனால்
அவையெல்லாம் நடைமுறையில் நடக்குமா? இல்லை. இதனை எளிதாக ஹேலஜன்களை கொண்டு விளக்க
முடியும். எடுத்துகாட்டாக கீழ்க்கண்ட இரு வேதிவினைகளை கருதுவோம்.
2NaCl(aq) + F2(g) →
2NaF(aq) + Cl2(g)
2NaF(aq) + Cl2(g) →
2NaCl(aq) + F2(g)
முதல் வினையில் சோடியம்
குளோரைடிலிருந்து குளோரின்புளூரினால் இடப்பெயர்ச்சி செய்யப்படுகிறது. இரண்டாம்
வினையில் குளோரின், புளூரினை சோடியம் புளூரைடிலிருந்து இடப்பெயர்ச்சி செய்கிறது.
மேற்கண்ட இரண்டு வினைகளில் இரண்டாம்
வினை நடக்க இயலாது. ஏனெனில் குளோரினைவிட புளூரின் வினைதிறன் மிக்கது. மேலும் தனிம
வரிசை அட்டவணையில் குளோரினுக்கு மேலே உள்ளது. எனவே இடப்பெயர்ச்சி வினைகளில், தனிமங்களின்
வினைதிறன் மற்றும் தனிம வரிசை அட்டவணையில் அவற்றின் இடம் ஆகியவை வினை நடைபெறுவதை
தீர்மானிக்கும் முக்கிய காரணிகளாக இருக்கின்றன. அதிக வினைதிறன் கொண்ட தனிமங்கள்
குறைந்த வினைதிறன் கொண்ட தனிமங்களை அவற்றின் கரைசலிருந்து இடப்பெயர்ச்சி
செய்கின்றன.
சில தனிமங்களின் வினைதிறன் வரிசை
கீழே தரப்பட்டுள்ளது.

மேற்கண்ட வினைதிறன் வரிசையை
தொடர்புடுத்தி கீழ்கண்ட வினாக்களுக்கு விடையளிக்க முயற்சி செய்
எந்த உலோகங்கள் ஹைட்ரஜனை
ஹைட்ரோகுளோரிக் அமிலத்திலிருந்து இடப்பெயர்ச்சி செய்யும்? வெள்ளியா? துத்தநாகாமா? இதற்கான வேதிவினைகளை எழுதி உனது விடையை
நியாயப்படுத்துக.
செயல்பாடு 10.1
• ஒரு பீக்கரில் சுமார் 50 மிலி கழிவறைச் சுத்தம்
செய்யும் அமிலத்தை எடுத்துக் கொள்.
• ஒரு சிறிய இரும்பு ஆணியை அதில் வைக்கவும்.
• 10 நிமிடங்களுக்கு பின்பு பீக்கரில் என்ன நிகழ்கிறது என்பதை கவனி.
• ஏதேனும் மாற்றத்தை உன்னால் கவனிக்க முடிகிறதா?
• காண்பனவற்றை தொகுத்து வேதிவினைகளுடன் எழுதுக.
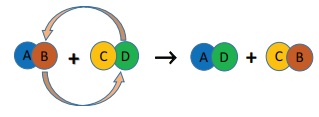
ஈ. இரட்டை இடப்பெயர்ச்சி வினை
இரண்டு சேர்மங்கள் வினைபுரியும்
பொழுது அவற்றின் அயனிகள் பரிமாறிக் கொள்ள படுமானால் அவ்வினை இரட்டை இடப்பெயர்ச்சி
எனப்படுகிறது. ஒரு சேர்மத்தின் அயனி மற்றொரு சேர்மத்தின் அயனியால் இடப்பெயர்ச்சி
செய்யப்படுகிறது. ஒரே மாதிரி மின் சுமைகள் கொண்ட அயனிகள் பரிமாறிக்
கொள்ளப்படுகின்றன. அதாவது ஒரு நேர் அயனி மற்றொரு நேர் அயனியால் இடப்பெயர்ச்சி
செய்யப்படுகிறது. இத்தகைய வினை “மெட்டாதிஸிஸ் வினை" எனவும் அழைக்கப்படுகிறது. இரட்டை இடப்பெயர்ச்சி
வினையை பின்வருமாறு குறிப்பிடலாம்.
ஒரு இரட்டை இடப்பெயர்ச்சி வினை
நடைபெறுவதற்கு, வினைவிளை பொருள்களில் ஒன்று வீழ்படிவாக இருக்க வேண்டும் அல்லது நீராக
இருக்க வேண்டும். இவ்வாறாக இரு வகையான இடப்பெயர்ச்சி வினைகள் உள்ளன. அவையாவன:
i. வீழ்படிவாக்கல்
வினை
ii. நடுநிலையாக்கல்
வினை
i. வீழ்படிவாக்கல் வினைகள்
இரு சேர்மங்களின் நீர்க்கரைசல்களை
கலக்கும் பொழுது, அவை வினைபுரிந்து நீரில் கரையாத ஒரு விளைபொருளும், நீரில்
கரையும் ஒரு விளைபொருளும் தோன்றினால் அவ்வினை வீழ்படிவாக்கல் வினை எனப்படும். ஒரு
விளைபொருள் வீழ்படிவாக இருப்பதால் இவ்வகை வினை வீழ்படிவாக்கல் வினை எனப்படுகிறது.
எடுத்துக்காட்டாக பொட்டாசியம்
அயோடைடு மற்றும் லெட் நைட்ரேட்டின் தெளிவான நீர்க்ககரைசல்களைக் கலக்கும் பொழுது
ஒரு இரட்டை இடப்பெயர்ச்சி வினை நடக்கிறது.
Pb(NO3)2(aq) +
2KI(aq) → PbI2(s) + 2KNO3(aq)
இங்கு பொட்டாசியமும் லெட் உலோகமும்
ஒன்றையொன்று இடப்பெயர்ச்சி செய்துகொண்டு மஞ்சள் நிற லெட் அயோடைடு சேர்மத்தை
தருகின்றன.

செயல்பாடு 10.2
• சிறிதளவு
சில்வர் நைட்ரேட் படிகங்களை ஒரு சோதனைக்குழாயில் எடுத்துக்கொள்
• சுமார் 5 மிலி குழாய் நீரை சோதனைக் குழாயில் சேர்க்கவும்.
• சில்வர்
நைட்ரேட் படிகங்களை நீரில் சேர்த்து கலக்கவும்.
• மாற்றங்களை
கவனித்து உன்னுடைய உற்றுநோக்கலை எழுதுக. இதிலிருந்து என்ன உணர்கிறாய்?
ii. நடுநிலையாக்கல் வினைகள்
உங்களுடைய முந்தைய வகுப்புகளில் ஒரு
அமிலமும், காரமும் எவ்வாறு
வினைப்படுகின்றன என்பதை கற்றிருக்கிறீர்கள். இது இடப்பெயர்ச்சி வினைக்கு மற்றொரு
எடுத்துக்காட்டாகும். இங்கு ஒரு அமிலமும், காரமும்
வினைபுரிந்து உப்பும் நீரும் கிடைக்கின்றன. இவ்வினை நடுநிலையாக்கல் வினை
எனப்படுகிறது. ஏனெனில் அமிலமும், காரமும் ஒன்றை யொன்று
நடுநிலையாக்கிக் கொள்கின்றன.
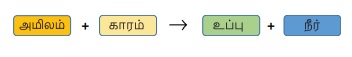
சோடியம் ஹைட்ராக்ஸைடு மற்றும்
ஹைட்ரோ குளோரிக் அமிலத்திற்கு இடையேயான வினை நடுநிலையாக்கல் வினைக்கு ஒரு
எடுத்துக்காட்டாகும். இங்கு சேடியம், ஹைட்ரஜனை ஹைட்ரோகுளோரிக் அமிலத்திலிருந்து
இடப்பெயர்ச்சி செய்கிறது. இதன் விளைவாக சோடியம் குளோரைடு என்ற நடுநிலையான நீரில்
கரையும் உப்பு கிடைக்கிறது.
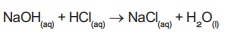
இதே போல் அம்மோனியம் ஹைட்ராக்சைடு
என்ற காரம் நைட்ரிக் அமிலத்துடன் வினைபுரியும் பொழுது அம்மோனியம் நைட்ரேட் என்ற
உப்பும், நீரும்
கிடைக்கிறது.
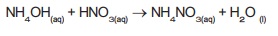
உ. எரிதல் வினைகள்
ஒரு எரிதல் வினையில், வினைபடு பொருள்
மிகவும் விரைவாக ஆக்சிஜனுடன் சேர்ந்து எரிந்து ஒன்று அல்லது பல ஆக்சைடுகளையும்
வெப்ப ஆற்றலையும் தருகின்றன. எனவே ஒரு எரிதல் வினையின் வினைபடு பொருள்களில் ஒன்று
ஆக்சிஜனாகும். பெரும்பான்மையான எரிதல் வினைகள் வெப்ப ஆற்றல் மூலங்களாக நம்முடைய
அன்றாட வாழ்வின் செயல்பாடுகளில் பயன்படுகின்றன. எடுத்துக்காட்டாக நம்முடைய
வீடுகளில் சமைக்க LPG எனப்படும் திரவமாக்கப்பட்ட பெட்ரோலிய
வாயுவைப் பயன்படுத்துகிறோம். LPGன் பகுதிப்பொருள்கள்
ஆக்சிஜனோடு சேர்ந்து எரிவதால் வெப்பமும், தீச்சுவாலையும்
உண்டாகின்றன. LPG என்பது புரோப்பேன், பியூட்டேன்
மற்றும் புரோப்பலீன் போன்ற ஹைட்ரோகார்பன் வாயுக்களின் கலவையாகும். அனைத்து ஹைட்ரோ
கார்பன்களும் ஆக்சிஜனுடன் எரிந்து கார்பன்-டை- ஆக்சைடையும் நீரையும் தருகின்றன.
C3H8(g) +
5O2(g) → 3CO2(g) + 4H2O(g) +
வெப்பம்
புரோப்பேன்
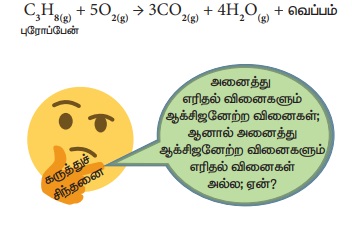
மேற்கூறிய வினையில் வெப்பம்
உருவாவதால் இது ஒரு வெப்ப உமிழ் வினையாகும். ஆக்சிஜன் சேருவதால் இது மேலும்
ஆக்சிஜனேற்ற வினையாகும். எனவே எரிதல் வினையை வெப்ப உமிழ் ஆக்சிஜனேற்றம் எனலாம்.
சுடர் உருவானால் (படம் 10.4 காட்டியுள்ளவாறு) அதனை எரிதல் என்கிறோம்.

கீழ்கண்டவற்றுள் எது எரிதல் வினை?
1. உணவு செரித்தல்
2. இரும்பு
துருப்பிடித்தல்
எண்ணற்ற வினைகள், இதுவரை நாம் கற்ற
ஐந்து வகையான வினைகளில் அடங்கும். இவ்வினைகளை பற்றி மேலும் பல்வேறு விவரங்களை
விளக்கமாக உங்களுடைய உயர் வகுப்புகளில் கற்க இருக்கீறீர்கள்.
2. வினை நடைபெறும்
திசையைக் கொண்டு வகைப்படுத்துதல்
உங்களைச் சுற்றி ஒவ்வொரு நாளும்
எண்ணற்ற மாற்றங்கள் ஏற்படுகின்றன என்பது உங்களுக்குத் தெரியும். அந்த மாற்றங்கள்
நிரந்தரமானவையா? திரவ நிலையில் உள்ள நீர், திட நிலை பனிக்கட்டியாக
உறைகிறது. பனிக்கட்டி உருகி நீராக மாறுகிறது. எனவே உறைதல் என்பது மீள்மாற்றம். இது
நிரந்தர மாற்றமல்ல. இது ஒரு இயற்பியல் மாற்றம். இயற்பியல் மாற்றங்கள்
மீள்மாற்றங்களாகும். ஆனால் வேதி மாற்றங்கள் மீள்மாற்றங்களா? அதாவது,
வினை விளைபொருள்கள் மீண்டும் வினைபடு பொருள்களாக மாறுமா? மரக்கட்டை எரியும் நிகழ்வை எடுத்துக்கொள்வோம். மரத்தில் உள்ள கார்பன்
சேர்மங்கள் எரிந்து கார்பன் டைஆக்சைடு வாயு மற்றும் நீராகவும் மாறுகிறது.
கார்பன்-டை-ஆக்சைடு மற்றும்
நீரையும் சேர்த்து மரத்தை மீண்டும் பெற முடியுமா? நம்மால் பெறமுடியாது. எனவே இது ஒரு நிரந்தர
மாற்றம் ஆகும். பெரும்பாலான வினைகளில் வினைபடு பொருள்களை, வினைவிளை
பொருள்களிலிருந்து பெற இயலாது. ஆனால் சில வேதி வினைகளை மீள் வினைகளாக மாற்றலாம்.
நமது கைப்பேசி இயங்கத் தேவையான ஆற்றலை, அதில் உள்ள லித்தியம்
அயனி மின்கலன், வேதி வினைகள் மூலமாக உண்டாக்குகின்றன.
இந்நிகழ்வு மின்னிறக்கம் எனப்படும். கைப்பேசியை மின்னேற்றம் செய்யும்போது
இவ்வேதிவினை மீள் வினையாகிறது. எனவே வேதிவினையானது தகுந்த சூழ்நிலையில் மீண்டும்
நிகழச் செய்யலாம். எனவே இவ்வினைகள் இரண்டு வகைகளாக வகைப்படுத்தப்படுகின்றன. அவை
மீள் வினைகள் மற்றும் மீளா வினைகள் ஆகும்.

i. மீள் வினைகள்
மீள்வினைகள் என்பவை மீண்டும்
நிகழக்கூடிய வினைகள் ஆகும். அதாவது வினைவிளை பொருள்களை, வினைபடு பொருள்களாக
மாற்றமுடியும். ஒரு மீள் வினையை கீழ்க்ண்ட வாறு குறிக்கலாம்.
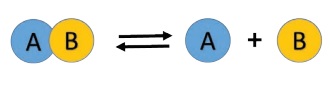
விளக்கம்
மேற்கண்ட வினையில், வினைபடு பொருள் AB
ஆனது சிதைவுற்று வினை விளைபொருள் ‘A’ மற்றும் ‘B’
கிடைக்கிறது. இது ‘முன்னோக்கு வினையாகும்’. இவ்வாறு உருவாகும் வினை விளை பொருளான A மற்றும் B
மீண்டும் இணைந்து AB என்ற சேர்மமாக மாறுகிறது.
இது பின்னோக்கு வினை எனப்படும். ஆகவே இந்த வினை முன்னோக்கு மற்றும்
பின்னோக்கு திசைகளில் நடைபெறுகிறது. அப்படியாயின் மேற்கண்ட வினையில் எந்த ஒரு
வினைவிளை பொருள்களும் உருவாகவில்லை என்று கருதுகிறாயா? நீ
அவ்வாறு கருதினால் அது தவறு. ஏனெனில் வினையானது இரு திசைகளில் நிகழ்ந்தாலும்
வினையின் தொடக்கத்தில் அவற்றின் வினைவேகம் சமமானதாக இல்லை.
எ.கா: பாஸ்பரஸ் பென்டா குளோரைடு
சிதைவுற்று பாஸ்பரஸ் டிரை குளோரைடு மற்றும் குளோரினைத் தரும் வினையை
எடுத்துக்கொள்வோம்.

PCl5 சிதைவுறுதல்
முன்னோக்குவினையாகவும், PCl3 மற்றும் Cl2
இணைந்து PCI5 உருவாதல் பின்னோக்கு
வினையாகவும் நடைபெறுகிறது. முதலில் வினையின் துவக்கத்தில் முன்னோக்கு வினையானது,
பின்னோக்கு வினையை விட வேகமாக நடைபெறும். சிறிது நேரத்திற்கு பிறகு
முன்னோக்கு மற்றும் பின்னோக்கு வினையின் வேகமானது சமமாகிறது. எனவே பின்னோக்கு வினை
நடைபெறுவதால் PCI5 முழுமையாக சிதைவடையாது. இது
மீள்வினையாகும். வேதிச் சமநிலையின் போது PCI5 - இன்
செறிவானது PCI3 மற்றும் CI2 - இன் செறிவை விட அதிகம்.
மீள்வினையின் போது வினைவிளை
பொருள்களை அவை உருவான உடனே நீக்குவது மூலமாகவோ அல்லது குறிப்பிட்ட கால இடைவெளியில்
வினைபடுபொருள்களை சேர்ப்பதன் மூலமாகவோ அதிக அளவு வினை விளை பொருள்களை பெறமுடியும்.
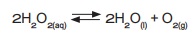
மேலும் அறிக
காயங்களில்
ஹைட்ரஜன் பெராக்சைடை ஊற்றும் போது H2O2 என்பது நீராகவும், ஆக்சிஜனாகவும் சிதைவடைகிறது.
உருவான ஆக்சிஜன் குமிழ்கள் வெளியேறி விடுவதால் மீண்டும் H2O2
உருவாகுதல் தடுக்கப்படுகிறது.
II மீளா வினைகள்
ஒரு வினையில் வினைபடு பொருள்களை
மீண்டும் பெற இயலாத வினை "மீளா வினை" எனப்படும். இவ்வினை ஒரே
திசையில் மட்டுமே நிகழும். அதாவது முன்னோக்கு வினையாக மட்டுமே நடைபெறும்.

நிலக்கரி ஆக்சிஜன் கார்பன் டை
ஆக்சைடு நிலக்கரி எரிதல் வினையின் போது கார்பன் டை ஆக்சைடு வாயுவைக் கொடுக்கிறது.
இவ்வினையில் நிலக்கரியானது
ஆக்சிஜனுடன் வினைபுரிந்து கார்பன் டை ஆக்சைடு வாயு மற்றும் நீரினை வெளியிடுகிறது.
இதில் உருவான கார்பன் டை ஆக்சைடுவாயுவானது மீண்டும், நிலக்கரியாகவும், ஆக்சிஜனாகவும்
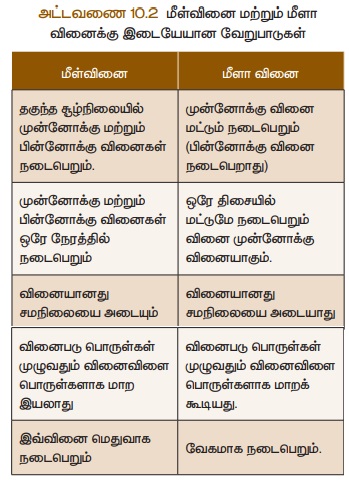
மாற இயலாது. எனவே இவ்வினை மீளாவினை எனப்படும். அட்டவணை 10.2-இல்
மீள்வினை மற்றும் மீளா வினைக்கு இடையேயான வேறுபாடுகள் கொடுக்கப்பட்டுள்ளன.
இவ்வினைகள் பற்றிய பிற தகவல்களை
உங்கள் மேல் வகுப்பில் படிப்பீர்கள்