அறிமுகம் - வேதிவினைகளின் வகைகள் | 10th Science : Chapter 10 : Types of Chemical Reactions
10வது அறிவியல் : அலகு 10 : வேதிவினைகளின் வகைகள்
வேதிவினைகளின் வகைகள்
அலகு 10
வேதிவினைகளின் வகைகள்

கற்றல் நோக்கங்கள்
இப்பாடத்தைக் கற்றபின், மாணவர்கள் பெறும்
திறன்களாவன:
• பல்வேறு வேதிவினைகளின் வகைகளை
அறிதல்.
• சுட்ட சுண்ணாம்பு மற்றும் நீரை
பயன்படுத்தி சேர்க்கை வினை நடைபெறுவதை செய்து பார்க்கும் திறனைப் பெறுதல்.
• மீள் மற்றும் மீளா வினைகளை அடையாளம்
காணுதல் மற்றும் வேறுபடுத்துதல்.
• மீள் வினைகளின் சமநிலையை
விளக்குதல்.
• சமநிலையின் தன்மைகளை பட்டியலிடுதல்
மற்றும் விளக்குதல்.
• வேதிவினையின் வேகத்தை வரையறை
செய்தல்.
• செறிவு, வெப்பநிலை மற்றும்
வினையூக்கியை பொருத்து வினைவேகத்தின் மாற்றங்களை விவரித்தல்.
• pH வரையறை செய்தல்.
• நடுநிலை, அமில மற்றும்
காரத்தன்மையுடைய நீர்க்கரைசல்களில் ஹைட்ரஜன் அயனி செறிவு மற்றும் pH யை தொடர்பு படுத்துதல்.
• அன்றாட வாழ்வில் pH-ன்
முக்கியத்துவத்தை கண்டுணர்தல்.
• நீரின் அயனிப் பெருக்கத்தை
விளக்குதல்.
அறிமுகம்
நீங்கள் ஏற்கனவே கற்றறிந்தது போல்
ஒரு வேதிவினையில் பழைய பிணைப்புகள் உடைந்து புதிய வேதிப்பிணைப்புகள் உருவாகின்றன.
இது தன்னிச்சையாகவோ அல்லது வெளிப்புற ஆற்றல் அல்லது உந்துதல் மூலமாகவோ நடைபெறலாம்.
வேதியியல் என்பது முழுவதும் வேதிவினைகளை பற்றியதாகும். உங்களுடைய அன்றாட வாழ்வில்
பல்வேறு வேதிவினைகளை காண இயலும். மனித இனம் மற்றும் சுற்றுச்சூழல் நலன் பேணுதல்
பொருட்டு, இத்தகைய வினைகள்
பற்றிய தெளிவான புரிதல் இன்றியமையாதது. எனவே வேதியியல் வேதிவினைகளை முதன்மையாக
விளக்குகிறது. நாம் கீழ்க்காணும் வினாக்களுக்கு விடையளிக்க முயற்சிப்போம்.
1. விளையாடுதல்,
நடத்தல், ஓடுதல் மற்றும் பல்வேறு உடற்திறன்
சார்ந்த செயல்களுக்கு ஆற்றல் எதிலிருந்து பெறுகிறீர்கள்?
2 எவ்வாறு தாவரங்கள்
வளர்கின்றன மற்றும் உணவைப் பெறுகின்றன?
3. ஒரு கார் எரி
பொருளைக் கொண்டு எவ்வாறு இயங்குகிறது?
4. நீர் அல்லது
காற்றுடன் தொடர்பு கொள்ளும் பொழுது இரும்பு ஏன் துருப்பிடிக்கிறது?
நீங்கள் உண்ணும் உணவு செரிமானம்
அடைவதன் மூலம் ஆற்றலைப் பெறுகிறீர்கள். தாவரங்கள் பூமியிலிருந்து ஊட்டச்சத்துக்களை
உறிஞ்சி வளர்கின்றன. மேலும் ஒளிச்சேர்க்கையின் மூலம் உணவை பெறுகின்றன. எரிபொருள்
எரிவதால் கார் இயங்குகிறது. இரும்பு ஆக்சிஜனேற்றமடைவதால் துருப்பிடிக்கிறது. எனவே
இவ்வனைத்துச் செயல்களும் வேதி மாற்றங்களாகும். அதாவது மாற்றத்திற்கு உட்படும்
பொருள்கள் அனைத்தும் வேறு புதிய பொருள்களாக மாற்றப்படுகின்றன. எடுத்துக்காட்டு:
பெட்ரோல் எரியும்போது அதில் அடங்கியுள்ள ஹைட்ரோகார்பன்கள், கார்பன் டை ஆக்சைடு
மற்றும் நீராக மாற்றப்படுகின்றன. இப்பாடத்தில் வேதி வினைகளின் தன்மை மற்றும்
வகைகளை விவாதிப்போம்.
ஒரு வேதிவினை
நடைபெறும் பொழுது நிகழ்வதென்ன?
• ஒரு வேதிவினையில் ஈடுபடும்
மூலக்கூறுகளின் அணுக்கள் அல்லது தனிமங்கள் மாற்றியமைக்கப்பட்டு புதிய மூலக்கூறுகள்
உருவாகின்றன.
• அணுக்களுக்கிடையேயான பிணைப்புகள்
உடைந்து புதிய வேதிப்பிணைப்புகள் உருவாகின்றன.
• பிணைப்பு உடையும் பொழுது ஆற்றல்
உறிஞ்சப்படுகிறது. அதேபோன்று பிணைப்பு உருவாகும் போது ஆற்றல் வெளிப்படுகிறது
(உமிழப்படுகிறது)
வேதிவினைகள்
எவ்வாறு குறிக்கப்படுகின்றன?
மீத்தேன் ஆக்சிஜனுடன் வினைபுரிந்து
கார்பன் டை ஆக்சைடு மற்றும் நீரைத் தருகிறது. இவ்வினையை எவ்வாறு குறிப்பிடுவாய்?
இவ்வினையினை வார்த்தை சமன்பாடாக
கீழ்க்கண்டவாறு குறிக்கலாம்.
மீத்தேன் +
ஆக்சிஜன் → கார்பன் டை ஆக்சைடு + நீர்
இச்சமன்பாடானது வினைபடுபொருள், வினை விளைபொருள்களின்
வேதி இயைபைத் தருவதில்லை. எனவே ஒரு வேதிவினையின் பண்புகளை பற்றி அறிய அது வேதிச்
சமன்பாடாக குறிக்கப்படுகிறது. ஒரு வேதிவினையில் ஈடுபடும் வேதிப்பொருள்கள் அவற்றின்
வேதி வாய்பாடுகளால் குறிக்கப்படுகின்றன. வினையில் ஈடுபடும் தனிமங்கள் அல்லது
சேர்மங்கள் (வினைபடு பொருள்கள்) அம்புக்குறியின் இடது புறமும், வினையில் உருவாகும் பொருள்கள் (வினைவிளை பொருள்கள்) அம்புக்குறியின்
வலப்புறமும் குறிக்கப்படுகின்றன. அம்புக்குறியானது வினை நிகழும் திசையைக்
குறிக்கிறது. இவ்வாறாக மேற்கூறிய வினையை பின்வருமாறு எழுதலாம்.
CH4 + O2 → CO2 +
H2O
ஆனால் இதுவும் கூட முழுமையற்ற
வேதிச் சமன்பாடாகும் ஏனெனில் பொருண்மை அழியாவிதிப்படி பொருண்மையை ஆக்கவோ அழிக்கவோ
முடியாது. ஒரு வேதி வினையின் மூலம் புதிய அணுக்களை நாம் உருவாக்க இயலாது. மாறாக
வேதி வினை மூலம் பல்வேறு வழிகளில் அணுக்களை மாற்றியமைத்து புதிய சேர்மத்தினை
உருவாக்கலாம். எனவே ஒரு வேதிச் சமன்பாட்டில் வினைபடு பொருள்களின் அணுக்களின்
எண்ணிக்கையும், வினை விளை பொருள்களிலுள்ள அணுக்களின் எண்ணிக்கையும் சமமாக இருக்க
வேண்டும். மேற்கண்ட சமன்பாட்டில் ஹைட்ரஜன் மற்றும் ஆக்சிஜன் அணுக்களின் எண்ணிக்கை
சமமாக இல்லை . இதனை சரி செய்யும் பொழுது கீழ்க்கண்ட சமன்படுத்தப்பட்ட சமன்பாடு
கிடைக்கிறது.
CH4 + 2O2 → CO2 +
2H2O
மேலும் ஒரு வேதிச் சமன்பாடானது
அவ்வினையில் ஈடுபடும் பொருள்களில் இயல்புநிலையையும், வினை நடைபெறும் சூழ்நிலைகளைப் பற்றிய விவரத்தையும்
தருகிறது.
CH4(g) +
2O2(g) → CO2(g) +
2H2O(g)
மீத்தேன்
ஆக்சிஜன் கார்பன் டைஆக்சைடு நீர்
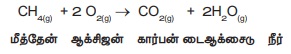
"சமன்படுத்தப்பட்ட வேதிச் சமன்பாடு என்பது ஒரு வேதிவினையின் வேதி இயைபு, வினைபடு மற்றும் வினை விளைபொருள்களின் இயற்பியல் நிலைமை மற்றும் வினை நடைபெறும் சூழ்நிலைகளை குறிக்கும் எளிய (குறிப்பு) குறியீடாகும்".
மேலும் அறிந்துக் கொள்வோம்:
ஒரு
வேதிவினையில் ஈடுபடும் பொருள்களின் நிலை மற்றும் இயற்பியல் நிலையை ஒரு
அடைப்புக்குறிக்குள் சுருக்க குறியீடுகளைப் பயன்படுத்தி குறிப்பிடலாம்.
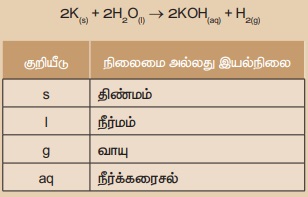
எடுத்துக்காட்டாக, திண்ம பொட்டாசியம், நீருடன் வினை புரிந்து பொட்டாசியம் ஹைட்ராக்சைடையும், ஹைட்ரஜன் வாயுவையும் தருகிறது. இவ்வினை சார்ந்த அனைத்து தகவல்களும்
கீழ்கண்டவாறு வேதிச்சமன்பாட்டில் குறிக்கப்படுகின்றன.