கலவினைகளின் வெப்ப இயக்கவியல் | மின் வேதியியல் - மின்னாற்பகுத்தல் பற்றிய ஃபாரடே விதிகள் | 12th Chemistry : UNIT 9 : Electro Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 9 : மின் வேதியியல்
மின்னாற்பகுத்தல் பற்றிய ஃபாரடே விதிகள்
மின்னாற்பகுத்தல் பற்றிய ஃபாரடே விதிகள்:
முதல் விதி
i.e maQ
மின்னோட்டத்தின் அளவானது, மின்னேற்றத்துடன் பின்வரும் சமன்பாட்டின் மூலம் தொடர்பு படுத்தப்படுகிறது என்பதை நாம் அறிவோம். I = Q/t ⇒ Q = It
ஃ m α It (or) m = Z It ...... (9.33)
இங்கு Z என்பது மின்முனையில் விடுவிக்கப்பட்ட பொருளின் மின்வேதிச் சமானம் ஆகும்.
I = 1A மற்றும் t = 1 விநாடி, Q = 1C , எனில் அத்தகைய நேர்வுகளில் சமன்பாடு (9.33) ஆனது சமன்பாடு (9.34) போல மாறுகிறது
⇒ m = Z ... (9.34)
அதாவது, மின்வேதிச் சமானம் என்பது 1 கூலூம் மின்னூட்டத்தால் மின்முனையில் விடுவிக்கப்பட்ட பொருளின் அளவு என வரையறுக்கப்படுகிறது.
மின்வேதிச் சமான நிறை மற்றும் மோலார் நிறை
பின்வரும் பொதுவான மின்வேதி ஆக்ஸிஜனேற்ற ஒடுக்க வினையை கருதுக. Mn+ (aq) + ne– → M(s)
மேற்காண் சமன்பாட்டிலிருந்து 1 மோல் . Mn+ அயனிகளை M(S) ஆக வீழ்படிவாக்குவதற்கு n மோல்கள் எலக்ட்ரான்கள் தேவைப்படும் என்பதை அறியலாம்.
1 மோல் Mn+ அயனிகளை வீழ்படிவாக்க தேவைப்படும் மின்னூட்டம்
= 'n' மோல் எலக்ட்ரான்களின் மின்சுமை
= nF
ஒரு கூலூம் மின்னூட்டத்தினால் வீழ்படிவாக்கப்பட்ட பொருளின் நிறை Mn+ ன் மின்வேதிச் சமான நிறை = Mன் மோலார் நிறை / n (96500) (அல்லது)
Z = Mன் சமான நிறை / 96500 ... (9.35)

இரண்டாம் விதி
ஒரே அளவு மின்னோட்டத்தை வெவ்வேறு மின்பகுளிக் கரைசல்களின் வழியே செலுத்தும்போது, மின்முனைகளில் விடுவிக்கப்படும் பொருளின் அளவானது அவற்றின் மின்வேதிச் சமானங்களுக்கு நேர்விகிதத்திலிருக்கும்.
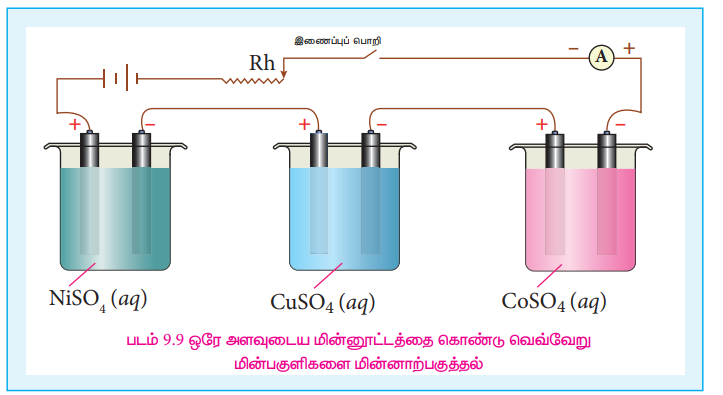
படம் 9.9ல் காட்டியுள்ளவாறு ஒரே DC மின்மூலத்துடன் தொடர் இணைப்பில் இணைக்கப்பட்டுள்ள மூன்று மின்னாற்பகுப்புக் கலன்களை கருதுவோம். ஒவ்வொரு மின்கலமும் வெவ்வேறு மின்பகுளிகளை முறையே NiSO4 CuSO4 மற்றும் CoSO4 கரைசல்களைக் கொண்டு நிரப்பப்பட்டுள்ளன.
Q கூலூம் மின்னூட்டத்தை மின்னாற்பகுப்புக் கலன்களின் வழியே செலுத்தும்போது அந்தந்த மின்முனைகளில் விடுவிக்கப்பட்ட உலோகங்கள் நிக்கல், காப்பர் மற்றும் கோபால்ட் ஆகியவற்றின்
நிறைகள் முறையே mNi; mCu, மற்றும் mCo
ஃபாரடேயின் இரண்டாம் விதிப்படி
mNi α ZNi , mCo α ZCu மற்றும் mCo α ZCo
(அல்லது)
mNi / ZNi = mCu / ZCu = mCo / ZCo ......(9.36)
எடுத்துக்காட்டு
2 ஆம்பியர் மின்னோட்டத்தைக் கொண்டு, சில்வர் நைட்ரேட் கரைசலானது 20 நிமிடங்களுக்கு மின்னாற்பகுக்கப்படுகிறது எனில், எதிர்மின்முனையில் வீழ்படிவாகும் சில்வரின் நிறையை கணக்கிடுக.
எதிர்மின்முனையில் நிகழும் மின்வேதி வினை Ag+ +e- → Ag (ஒடுக்கம்)
m = Zlt
m = (108 gmol-1 / 96500 C mol-1 ) × 2400C
m = 2.68 g.
Z = Ag ன் மோலார் நிறை / (96500) =108/1 × 96500
I = 2A
t = 20 × 60S = 1200 S
It = 2A × 1200S = 2400C
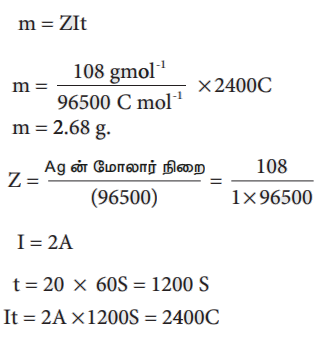
தன் மதிப்பீடு
0.15 ஆம்பியர் மின்னோட்டத்தை கொண்டு, ஒரு உலோக உப்புக் கரைசலானது 15 நிமிடங்களுக்கு நீராற்பகுக்கப்படும்போது, எதிர்மின்முனையில் விடுவிக்கப்பட்ட உலோகத்தின் நிறை 0.783 கிராம் எனில், அந்த உலோகத்தின் சமான நிறையை கணக்கிடுக.