Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ»єЯ«фЯ»ЇЯ«ф Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї | Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї - Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я»Ї | 12th Chemistry : UNIT 9 : Electro Chemistry
12 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«цЯ»ЇЯ«цЯ«┐Я«»Я«ЙЯ«»Я««Я»Ї 9 : Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї
Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я»Ї
Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я»Ї
Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«фЯ«▒Я»ЇЯ«▒Я«┐ Я«еЯ«ЙЯ««Я»Ї Я«еЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«Ћ Я«ЁЯ«▒Я«┐Я«хЯ»ІЯ««Я»Ї. Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ«┐Я«цЯ»ЇЯ«цЯ«│Я»ѕ Я«фЯ«ЙЯ«цЯ»ЇЯ«цЯ«┐Я«░Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я»ђЯ«цЯ»Ђ Я«фЯ«џЯ»ЇЯ«џЯ»ѕ Я«еЯ«┐Я«▒ Я«фЯ«ЪЯ«▓Я««Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«хЯ«цЯ»ѕ Я«еЯ»ђЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ«хЯ«ЕЯ«┐Я«цЯ»ЇЯ«цЯ«цЯ»ЂЯ«БЯ»ЇЯ«ЪЯ«Й? Я«ЄЯ«хЯ»ЇЯ«хЯ«┐Я«░Я«БЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї, Я«ѕЯ«░Я«фЯ»ЇЯ«фЯ«цЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«еЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«џЯ»ђЯ«░Я»ЇЯ«ЋЯ»ЂЯ«▓Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«ЁЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЋЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЪЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї, Я«фЯ«ЙЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒Я«хЯ»ѕ Я«џЯ»ЄЯ«цЯ««Я«ЪЯ»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я«јЯ«ЕЯ«хЯ»Є, Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«хЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«цЯ«ЕЯ»ѕ Я«јЯ«хЯ»ЇЯ«хЯ«ЙЯ«▒Я»Ђ Я«цЯ«ЪЯ»ЂЯ«фЯ»ЇЯ«фЯ«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«ЁЯ«▒Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«│Я»ЂЯ«цЯ«▓Я»Ї Я«єЯ«ЋЯ«┐Я«»Я«Е Я««Я«┐Я«Ћ Я««Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я««Я«ЙЯ«ЕЯ«хЯ»ѕЯ«ЋЯ«│Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«џЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«ЁЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я«┐Я«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐ Я«хЯ«┤Я«┐Я««Я»ЂЯ«▒Я»ѕ:
Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«цЯ»ЇЯ«цЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я»ЂЯ««Я»Ї Я«ЁЯ«хЯ«џЯ«┐Я«»Я««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ««Я»ЂЯ«▒Я»ѕ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«хЯ»єЯ«хЯ»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«цЯ»ЄЯ«хЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я«┐ Я«єЯ«ЋЯ«┐Я«»Я«Е Я«фЯ«ЪЯ««Я»Ї (9.14)Я«▓Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«хЯ«ЙЯ«▒Я»Ђ Я«њЯ«░Я»Ђ Я«еЯ»ЂЯ«БЯ»ЇЯ«БЯ«┐Я«» Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«еЯ»ђЯ«░Я«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«џЯ»ѓЯ«┤Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«цЯ«│Я«хЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«хЯ»єЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я««Я»ђЯ«цЯ««Я»ЂЯ«│Я»ЇЯ«│ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ«│Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ«│Я«хЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«єЯ«цЯ«▓Я«ЙЯ«▓Я»Ї, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї, Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«еЯ»ђЯ«░Я«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«џЯ»ѓЯ«┤Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я«ЋЯ»ђЯ«┤Я»Є Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«хЯ«ЙЯ«▒Я»Ђ Я«ЁЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
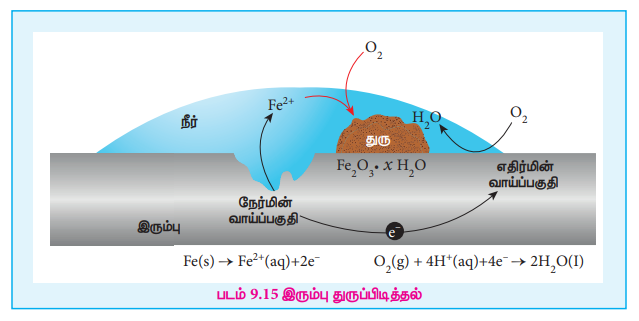
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ (Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї) Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«ЋЯ«░Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2Fe(s) Рєњ 2Fe2+(aq) + 4e- E┬░ = 0.44V.
Я«ЄЯ«еЯ»ЇЯ«ц Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«еЯ«ЋЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«еЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«еЯ»ђЯ«░Я«ЙЯ«Ћ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ (Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї)
Я«хЯ«│Я«┐Я««Я«БЯ»ЇЯ«ЪЯ«▓ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»Ї Я«ЪЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ««Я«┐Я«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«цЯ»ЄЯ«хЯ»ѕЯ«»Я«ЙЯ«Е H+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕ Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
O2 (g) + 4H+ (aq) + 4e- Рєњ 2H2O (l ) E┬░ = 1.23V
Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«еЯ«ЋЯ«░Я»ЇЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я»Ђ Я««Я»ЂЯ«┤Я»ЂЯ««Я»ѕЯ«»Я«ЪЯ»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї,
2Fe(s) + O2(g) + 4H+ (aq) Рєњ 2Fe2+ (aq) + 2H2O(l ) E = 0.444 +1.23 = 1.67V
Я«хЯ«┐Я«ЕЯ»ѕ Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕЯ«»Я«ЙЯ«Ћ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«еЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЂЯ«▒Я«┐ emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Fe2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Fe+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я«ЄЯ«хЯ»ѕ Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«цЯ»ЂЯ«░Я»Ђ (rust) Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
4Fe2+ (aq)+O2(g)+4H+ (aq) Рєњ 4Fe3+ (aq)+2H2O(l)
2Fe3+ (aq)+4H2O(I) Рєњ Fe2O3.H2O(s) + 6H+(aq)
Я«ЁЯ«▓Я»ЂЯ««Я«┐Я«ЕЯ«┐Я«»Я««Я»Ї, Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«фЯ«┐Я«▒ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї, Я«џЯ«┐Я«▓Я»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«ЁЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЄЯ«хЯ»ѕ Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»ѕ Я«хЯ«┐Я«Ъ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«хЯ«ЙЯ«Е Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЁЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ, Я«ЁЯ«▓Я»ЂЯ««Я«┐Я«ЕЯ«┐Я«»Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«цЯ»ЇЯ«цЯ»ѕ Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ»ІЯ««Я»Ї.
Al(s) Рєњ Al3+ (aq)+3e-
Al3+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЋЯ«ЙЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Al2O3 Я«јЯ«ЕЯ»ЂЯ««Я»Ї Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«ЅЯ«│Я»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»ѕ Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЅЯ«▒Я»ѕЯ«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я«јЯ«ЕЯ«хЯ»Є Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЁЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«хЯ«цЯ»Ђ Я«цЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЁЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«ЄЯ«цЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«џЯ«ЙЯ«цЯ»ЇЯ«цЯ«┐Я«»Я««Я«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
i. Я«ЅЯ«▓Я»ІЯ«Ћ Я«фЯ«░Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я»ђЯ«цЯ»Ђ Я«хЯ«░Я»ЇЯ«БЯ««Я»Ї Я«фЯ»ѓЯ«џЯ»ЂЯ«цЯ«▓Я»Ї.
ii. Я«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«еЯ«ЙЯ«Ћ Я««Я»ЂЯ«▓Я«ЙЯ««Я»Ї Я«фЯ»ѓЯ«џЯ»ЂЯ«цЯ«▓Я»Ї: Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я««Я«▒Я»ЇЯ«▒ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я««Я»ЂЯ«▓Я«ЙЯ««Я»Ї Я«фЯ»ѓЯ«џЯ»ЂЯ«цЯ«▓Я»Ї. Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»ѕ Я«хЯ«┐Я«Ъ Я«хЯ«▓Я«┐Я««Я»ѕЯ««Я«┐Я«ЋЯ»ЂЯ«еЯ»ЇЯ«ц Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї, Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«фЯ«цЯ«┐Я«▓Я«ЙЯ«Ћ Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
iii. Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ»Ђ : Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«▓Я«ЙЯ««Я»Ї Я«фЯ»ѓЯ«џЯ»ЂЯ«цЯ«▓Я»ѕЯ«фЯ»Ї Я«фЯ»ІЯ«▓Я«▓Я»ЇЯ«▓Я«ЙЯ««Я«▓Я»Ї, Я«ЄЯ«еЯ»ЇЯ«ц Я«цЯ»іЯ«┤Я«┐Я«▒Я»ЇЯ«еЯ»ЂЯ«ЪЯ»ЇЯ«ф Я«ЅЯ«цЯ»ЇЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ«┐Я«» Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я»Ї Я««Я»ЂЯ«┤Я»ЂЯ«хЯ«цЯ»ЂЯ««Я»Ї Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ»ѓЯ«џЯ«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ«┐Я«» Я«ЁЯ«хЯ«џЯ«┐Я«»Я««Я«┐Я«▓Я»ЇЯ«▓Я»ѕ .Я««Я«ЙЯ«▒Я«ЙЯ«Ћ, Mg Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»ѕЯ«хЯ«┐Я«Ъ Я«јЯ«│Я«┐Я«цЯ«┐Я«▓Я»Ї Я«ЁЯ«░Я«┐Я««Я«ЙЯ«ЕЯ««Я«ЪЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«┤Я«фЯ»ЇЯ«фЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ (sacrificial anode) Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«ц Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї. Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я«ЙЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»Ђ Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Mg Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Zn Я«ЁЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«│Я»ЇЯ«│Я«ЙЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«џЯ»єЯ«»Я«▓Я«▒Я»ЂЯ«цЯ»ЇЯ«цЯ«▓Я»Ї (Passivation):
Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«ЁЯ«ЪЯ«░Я»Ї HNO3 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«хЯ«▓Я«┐Я««Я»ѕЯ««Я«┐Я«ЋЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«ЋЯ«ЙЯ«░Я«БЯ«┐Я«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«» Я«ЁЯ«ЕЯ»ЂЯ««Я«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї, Я«ЅЯ«▓Я»ІЯ«Ћ Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ЇЯ««Я»ђЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ»Ђ Я«ЁЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЅЯ«▓Я»ІЯ«Ћ Я«ЋЯ«▓Я«хЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї
Я««Я«▒Я»ЇЯ«▒ Я«ЁЯ«цЯ«┐Я«Ћ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«▓Я»ІЯ«Ћ Я«ЋЯ«▓Я«хЯ»ѕЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЄЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«цЯ«┐Я«▒Я«ЕЯ»ѕ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ»ЇЯ«Ћ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»Ђ, Я«цЯ»ЂЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«Й Я«јЯ«ЃЯ«ЋЯ»Ђ - Fe Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Cr Я«џЯ»ЄЯ«░Я»ЇЯ«еЯ»ЇЯ«ц Я«ЅЯ«▓Я»ІЯ«Ћ Я«ЋЯ«▓Я«хЯ»ѕ.