மின் வேதியியல் - சுருக்கமாக விடையளி | 12th Chemistry : UNIT 9 : Electro Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 9 : மின் வேதியியல்
சுருக்கமாக விடையளி
II. சுருக்கமாக விடையளி
1. நேர்மின்முனை மற்றும் எதிர்மின்முனைகளை வரையறு.

நேர்மின் முனை
(i) ஆக்சிஜனேற்றம் நிகழும் மின்முனை
(ii) கால்வனிக் கலனில் இது எதிர்குறியைப் பெறுகிறது.
எதிர்மின் முனை
(i) ஆக்சிஜன் ஒடுக்கம் நிகழும் மின்முனை
(ii) கால்வனிக் கலனில் இது நேர்க்குறியைப் பெறுகிறது.
2. நீர்த்தல் அதிகரிக்கும்போது கரைசலின் கடத்துத்திறன் குறைகிறது ஏன்?
ஓரலகு பருமனிலுள்ள மின்பகுளிக் கரைசலில் அயனிகளின் எண்ணிக்கையானது நீர்த்தலின் போது குறைவதால் கரைசலின் கடத்துத்திறன் குறைகிறது.
3. கோல்ராஷ் விதியை கூறு. அளவிலா நீர்த்தலில் ஒரு வலிமைகுறைந்த மின்பகுளியின் மோலார் கடத்துத்திறன் நிர்ணயித்தலில் கோல்ராஷ் விதி எவ்வாறு பயன்படுகிறது?
• கோல்ராஷ் விதி : அளவிலா நீர்த்தலில், ஒரு மின்பகுளியின் வரம்புநிலை மோலார் கடத்துத் திறன் மதிப்பானது, அதன் பகுதிக்கூறு அயனிகளின் வரம்புநிலை மோலார் கடத்துத்திறன்களின் கூடுதலுக்கு சமமாக இருக்கும்.
• அளவிலா நீர்த்தலில் ஒரு வலிமைகுறைந்த மின் பகுளியின் மோலார் கடத்து திறனை கோல்ராஷ் விதியை பயன்படுத்தி கணக்கிட முடியும்.
• CH3COOH மோலார் கடத்து திறன் மதிப்பை சோதனை மூலம் கண்டறியப்பட்ட வலிமைமிகு மின்பகுளிகள் HCI, NaCl மற்றும் CH3COONa ஆகியவற்றின் மோலார் கடத்துத்திறன் மதிப்புகளி லிருந்து பின்வருமாறு கணக்கிட முடியும்.
ΛoCH3COONa = λoNa+ + λoCH3COO- -------(1)
ΛoCHl = λoH+ + λoCl -------(2)
ΛoNaCl = λoNa+ + λoCl- -----(3)
சமன்பாடு (1) + (2) - (3) .
(ΛoCH3COONa) + (ΛoCHl) – (ΛoNaCl) = λoH+ + λoCH3COO-
= λoCH3COOH
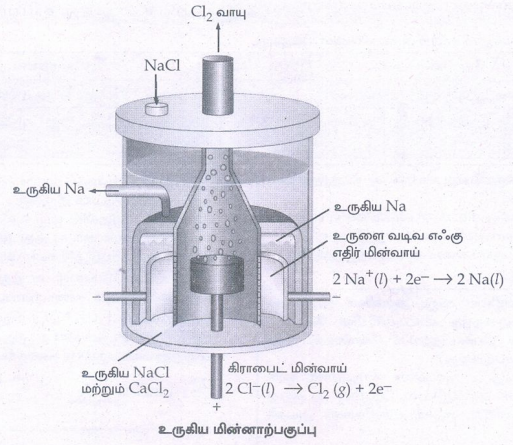
4. வினையுறா மின்முனைகளைப் பயன்படுத்தி உருகிய NaCl ஐ மின்னாற்பகுத்தல் பற்றி விளக்குக.
• மின்னாற்பகுப்புக் கலனில் இரண்டு இரும்பு மின் முனைகள் உருகிய சோடியம் குளோரைடினுள் மூழ்க வைக்கப்பட்டுள்ளன.
• அவை DC மின் மூலத்துடன் சாவியின் உதவி யால் இணைக்கப்பட்டுள்ளன.
• மின்மூலத்துடன் நேர் மற்றும் எதிர் மின்முனைகள் இணைக்கப்பட்டுள்ளன.
• சாவி கொண்டு மூடிய உடன் வெளிப்புற DC மின்மூலமானது, எதிர்மின்முனை வழியே எலக்ட்ரான்களை பாய்ச்சுகிறது. அதே நேரத்தில், நேர்மின்முனை வழியே எலக்ட்ரான்களை இழுக்கிறது.
கல வினைகள் :
• Na+ அயனிகள் எதிர்மின் முனையில் திரவ சோடியமாக ஒடுக்கமடைகின்றன.
எதிர்மின்முனை (ஒடுக்கம்) :
Na+(1) +e – → Nan(l) E° = -2.71V
• Cl- அயனிகள் நேர்மின்முனையில் ஆக்சிஜனேற்றமடைந்து குளோரின் வாய்வாக மாறுகின்றன.
நேர்மின் முனை (ஆக்சிஜனேற்றம்) :
2Cl-(l) → Cl2(g) + 2e- Eo = -1.36 V
• ஒட்டு மொத்த வினை :
2Na+(l) + 2Cl-(l) → 2Na(l) Cl2(g)
E° = - 4.07 V
E° மதிப்பு எதிர்குறி, எனவே மேற்காண் வினை தன்னிச்சையற்றது.
• எனவே, உருகிய சோடியம் குளோரைடின் மின்னாற்பகுத்தலை நிகழ்த்த 4.07 V ஐ விட அதிகமான மின்னழுத்தத்தை செலுத்த வேண்டும்.
• மின்னாற் பகுப்புகலனில், கால்வானிக் மின் கலத்தில் நிகழ்வதைப் போலவே நேர்மின் முனையில் ஆக்சிஜனேற்றமும், எதிர்மின்முனை யில் ஒடுக்கமும் நிகழ்கின்றன.
• ஆனால் மின்முனைகளின் குறி எதிரெதிரானது. அதாவது மின்னாற் பகுப்புக் கலனில் எதிர்மின் முனையின் குறி -ve மற்றும் நேர்மின்முனையின் குறி +ve.
5. மின்னாற்பகுத்தல் பற்றிய ஃபாராடே விதிகளைக் கூறு.
முதல் விதி :
• மின்னாற் பகுத்தலின் போது மின்முனைகளில் விடுவிக்கப்படும் பொருளின் நிறையானது (m) மின்கலத்தின் வழியே பாயும் மின்னோட்டத்தின் அளவிற்கு (Q) நேர்விகிதத்தில் இருக்கும்.
m ɑ Q, m ɑ. It, (Q = It), m = Zlt
இரண்டாம் விதி :
• ஒரே அளவு மின்னோட்டத்தை வெவ்வேறு மின் பகுளிக் கரைசல்களின் வழியே செலுத்தும்போது, மின் முனைகளில் விடுவிக்கப்படும் பொருளின் அளவானது அவற்றின் மின்வேதிச் சமானங் களுக்கு நேர்விகிதத்தில் இருக்கும்.
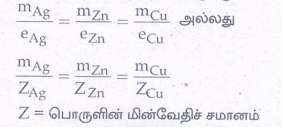
Z = பொருளின் மின்வேதிச் சமானம்
6. டேனியல் மின்கல கட்டமைப்பை விளக்குக. கலவினையை எழுதுக.
• டேனியல் மின்கலம் இரண்டு அரை மின்கலங் களை கொண்டு உள்ளது.
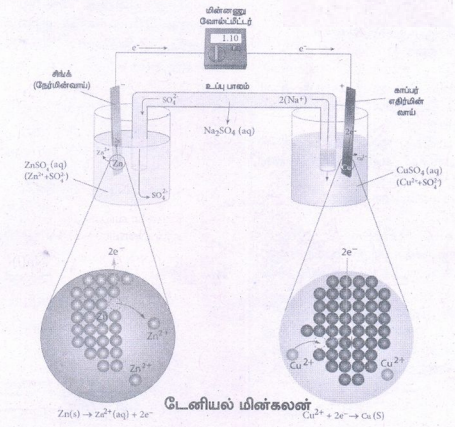
• ஆக்சிஜனேற்ற அரை மின்கலன் - முகவை யிலுள்ள நீர்த்த ஜிங்க் சல்பேட் கரைசலில் ஜிங்க் உலோகப்பட்டை மூழ்க வைக்கப்பட்டுள்ளது.
• ஒடுக்க அரை மின்கலன் - முகவையிலுள்ள நீர்த்த காப்பர் சல்பேட் கரைசலில் காப்பர் உலோகப் பட்டை மூழ்க வைக்கப்பட்டுள்ளது.
• அரை மின்கலன்களை இணைத்தல் :
ஜிங்க் மற்றும் காப்பர் பட்டைகள் வெளிப்புறமாக ஒரு கம்பி மூலம் ஒரு இணைப்பியும் (K) ஒரு மின் மூலமும் இணைக்கப்பட்டுள்ளன. (எ.கா வோல்ட் மீட்டர்)
• எதிர்மின் முனை மற்றும் நேர்மின் முனைப் பகுதிகளிலுள்ள மின்பகுளிக் கரைசல்கள் தலைகீழாக கவிழ்த்து வைக்கப்பட்டுள்ள U வடிவ குழாய் மூலம் இணைக்கப்பட்டுள்ளன இந்த U வடிவ குழாயில், அகார் - அகார் ஜெல்லுடன் KCl, Na2SO4 போன்ற வினையுறா மின்பகுளிகள் கலந்த பசை வைக்கப்பட்டுள்ளது. இது உப்பு பாலமாக செயல்படுகிறது.
• இணைப்பி (K) மூலம் மின்சுற்றை மூடும்போது, எலக்ட்ரான்கள் ஜிங்க் பட்டையிலிருந்து காப்பர் பட்டைக்கு பாய்கின்றன. இதற்கு காரணம் அந்தந்த மின்முனைகளில் நிகழும் ஆக்சிஜ னேற்ற ஒடுக்க வினைகளே ஆகம்.
நேர்மின் வாய் ஆக்சிஜனேற்றம் :
• ஜிங்க் பட்டை நேர்மின்முனை ஆகும்.
• இங்கு ஆக்சிஜனேற்றம் நடைபெறுகிறது.
• ஜிங்க் Zn2+ அயனிகளாகவும், எலக்ட்ரான்களாகவும் ஆக்சிஜனேற்றமடைகிறது.
• Zn2+ அயனிகள் கரைசலுக்குள் நுழைகின்றன, எலக்ட்ரான்கள் கம்பியின் வழியே வெளிச் சுற்றிற்கு பாய்ந்து காப்பர் பட்டைக்குள் நுழைகின்றன.
• ஜிங்க் மின் முனையில் எலக்ட்ரான்கள் வெளிப் படுவதால் எதிர்குறியை பெறுகிறது.
Zn(s) → Zn2+(aq) + 2e-
(எலக்ட்ரான் இழப்பு ஆக்சிஜனேற்றம்)
எதிர்மின்வாய் ஒடுக்கம் :
• காப்பர் பட்டை எதிர்மின் வாய் ஆகும்
• இங்கு ஆக்சிஜன் ஒடுக்கம் நடைபெறுகிறது.
• மின்சுற்று வழியே ஜிங்க் பட்டையிலிருந்து எலக்ட்ரான்கள் காப்பர் பட்டைக்கு பாய்கின்றன.
• கரைசலிலுள்ள Cu2+ அயனிகள் எலக்ட்ரான் களை ஏற்று காப்பர் உலோகமாக ஒடுக்கமடை கின்றன.
• இவை காப்பர் மின்முனை மீதே படிகின்றன.
• காப்பர் மின்முனை எலக்ட்ரான்களை உட்கொள் வதால் நேர்குறியை பெறுகிறது
Cu2+ + 2e- → Cu(s) (எலக்ட்ரான் ஏற்பு ஒடுக்கம்)
உப்புப்பாலம் :
• இரண்டு அரை மின்கலன்களிலுள்ள மின்பகுளிக் கரைசல்கள் உப்புப்பாலத்தை பயன்படுத்தி இணைக்கப்படுகின்றன.
• மின் நடுநிலைத் தன்மையை பராமரிக்க உப்புப் பாலத்திலிருந்து Cl- அயனிகள் (KCl ல் இருந்து) நேர்மின்முனை பகுதிக்குள் நுழைகின்றன.
• எதிர்மின்முனை ஒடுக்கத்தால் எதிர்மின்முனைப் பகுதி கரைசல் அதிகளவு SO42- அயனியை கொண்டுள்ளது. எனவே அது அதிக எதிர்மின் சுமையைப் பெறுகிறது.
• மின் நடுநிலைத் தன்மையை பராமரிக்க உப்புப் பாலத்திலிருந்து K+ அயனிகள் (KC1 ல் இருந்து) எதிர்மின்முனை பகுதிக்குள் நுழைகின்றன.
மின்சுற்று முழுமையடைதல் :
• எதிர்மின் சுமை கொண்ட ஜிங்க் மின் முனையி லிருந்து, நேர்மின்சுமை கொண்ட காப்பர் மின் முனையை நோக்கி வெளிச்சுற்றின் வழியே எலக்ட்ரான்கள் பாய்கின்றன.
• அதே நேரம் எதிரயனிகள் நேர்மின் முனை பகுதிக்கும், நேரயனிகள் எதிர்மின் முனை பகுதிக்கும் நகருகின்றன.
• இதனால் மின்சுற்று முழுமையடைகிறது.
மின்முனைகள் அழிதல் :
• டேனியல் மின்கலம் செயல்பட, ஜிங்க் மின்முனையில் நிறை தொடர்ந்து குறைகிறது. ஆனால் காப்பர் மின்முனையின் நிறை தொடர்ந்து அதிகரிக்கிறது.
• எனவே ஜிங்க் மின்முனை முற்றிலும் Zn2+ அயனிகளாக மாறும் வரையிலோ அல்லது மொத்த Cu2+ அயனிகளும் உலோக காப்பராக மாறும் வரையிலோ மின்கலன் வேலை செய்யும்.
மொத்த கல வினை :
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
கால்வானிக் மின்கல குறியீடு
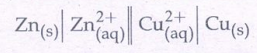
7. கால்வானிக் மின்கலத்தில் நேர்மின்முனையானது எதிர்குறி கொண்டதாகவும், எதிர்மின் முனை யானது நேர்குறி கொண்டதாகவும் கருதப்படுகிறது ஏன்?
• கால்வானிக் மின் கலத்தில் நேர்மின் வாய் உலோகம், உலோக அயனிகளாகவும், எலக்ட்ரான் களாகவும் ஆக்சிஜனேற்றமடைகின்றன.
• உலோக அயனிகள் கரைசலுக்குள் செல்கின்றன. எலக்ட் ரான்கள் நேர்மின் முனை வழியே வெளிச்சுற்றிற்கு பாய்கின்றன.
• நேர் மின் முனையில் எலக்ட்ரான்கள் விடுவிக்கப்படுவதால் எதிர்குறியை பெறுகிறது.
• மின்சுற்று வழியே எலக்ட்ரான்கள் எதிர்மின் முனைக்கு பாய்கின்றன.
• கரைசலிலுள்ள உலோக அயனிகள் எதிர்மின் முனையை சூழ்ந்து அங்கு ஒடுக்கமடைந்து உலோகமாக மாறுகிறது.
•எதிர் மின்முனையில் எலக்ட்ரான்கள் உட்கொள்ளப்படுவதால் நேர்க்குறியைப் பெறுகிறது.
8. 298K வெப்பநிலையில் 0.01M செறிவு கொண்ட 1:1 வலிமை குறைந்த மின்பகுளி கரைசலின் கடத்துத்திறன் மதிப்பு 1.5 × 10-4 Scm-1 எனில்,
i) கரைசலின் மோலார் கடத்துத்திறன்
ii) வலிமை குறைந்த மின்பகுளியின் பிரிகை வீதம் மற்றும் பிரிகை மாறிலி ஆகியவற்றை கணக்கிடுக.
குறிப்பு : நேரயனி = 248.2 S cm2 mol-1; எதிரயனி = 51.8 S cm2 mol-1
K = 1.5 × 10-4Scm-1
= 1.5 × 10-4s (10-2m)-1
=1.5 × 10-4 × 10-2 Sm-1
M = 0.01 M = 1.5 × 10-2 Sm-1
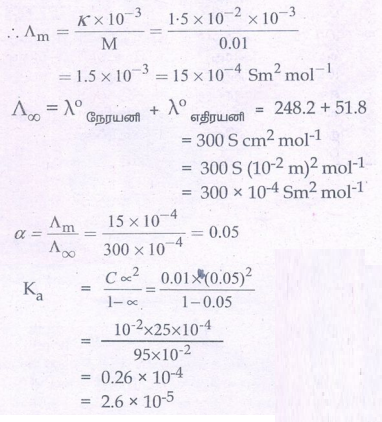
9. 0.1 M HC) மற்றும் 0.1 MKCI இந்த இரண்டு கரைசல்களில் எது அதிக கடத்துத்திறனை கொண்டது? ஏன்?
• 0.1MKCI ஐ விட 0.1M HCl ![]() அதிக கடத்து திறனை கொண்டது.
அதிக கடத்து திறனை கொண்டது.
• காரணம் - (i) H+ அயனி மிகவும் சிறியது, இலேசானது மற்றும் அதன் நிறை மற்ற அயனிகளுடன் (K+ அயனி) ஒப்பிடும்போது மிகக்குறைவு.
(ii) எனவே மற்ற அயனிகளுடன் (K+ அயனி) ஒப்பிடும் போது H+ அயனியின் நகரும் திறன் அதிகம்.
10. பின்வரும் கரைசல்களை அவற்றின் நியம கடத்துத் திறன்களின் இறங்குவரிசையில் வரிசைப்படுத்துக.
i) 0.01 MKCl
ii) 0.005 MKCl
iii)0.1 MKCI
iv) 0.25 MKCI
v) 0.5 MKCI
• நியம கடத்துத்திறன். செறிவு ɑ (1/ நீர்த்தல்)
• செறிவு குறையும் போது நியம கடத்துத்திறன் குறைகிறது.
• நியம கடத்துத்திறன்களின் இறங்குவரிசை
0.5MKCl> 0.25 MKCl> 0.1 M KCl> 0.01 MKCl> 0.005 MKCl
11. மின்பகுளிக் கடத்துத்திறன் அளவிடுதலில் DC மின்னோட்டத்திற்கு பதிலாக AC மின்னோட்டம் பயன்படுத்தப்படுகிறது ஏன்?
• மின் கடத்துக் கலன் வழியே DC மின்சாரத்தை செலுத்தும் போது, கலனில் உள்ள கரைசல் மின்னாற்பகுத்தலுக்கு உள்ளாகிறது.
• எனவே மின்னாற்பகுத்தலை தடுக்கும் பொருட்டு, மின்பகுளிக் கடத்துத்திறன் அளவிடு தலில் AC மின்னோட்டம் பயன்படுத்தப்படுகிறது.
12. முறையே 0.5 மற்றும் 0.25 cm-1 எனும் கலமாறிலி மதிப்புகளைக் கொண்ட இரண்டு வெவ்வேறு மின்கலன்களில் 0.1 M NaCl கரைசல் வைக்கப் பட்டுள்ளது. இந்த இரண்டில் எது அதிக நியம கடத்துத்திறன் மதிப்பை கொண்டிருக்கும்?
• நியம கடத்துத்திறன்

• கல மாறிலி அதிகரிக்கும் போது, நியம கடத்துத் திறன் அதிகரிக்கிறது.
• எனவே கலமாறிலி மதிப்பு 0.5cm-1 கொண்ட மின்கலன் அதிக நியம கடத்துத் திறன் மதிப்பை கொண்டிருக்கும்.
24. நெர்ன்ஸ்ட் சமன்பாட்டைத் தருவி
• நெர்ன்ஸ்ட் சமன்பாடு என்பது மின்கல மின்னழுத்தம் மற்றும் மின்வேதி வினையில் ஈடு படும் கூறுகளின் செறிவு ஆகியவற்றை தொடர்பு படுத்தும் சமன்பாடாகும்.
• ஒரு மின் வேதிக்கலனின் ஆக்சிஜனேற்ற ஒடுக்க வினை பின்வருமாறு
xA + yB ⇌ lC + mD

இது நெர்ன்ஸ்ட் சமன்பாடு எனப்படும்.
T = 298 K, R = 8.314 JK-1 mol-1, F = 96500 C, ஆகியவற்றை சமன்பாடு (4)ல் பிரதியிட
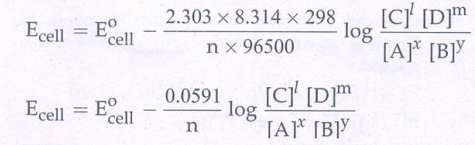
25. தன்னிழப்பு பாதுகாப்பு பற்றி குறிப்பு வரைக.
• மின்முலாம் பூசுதல் போல அல்லாமல், இம் முறையில் பாதுகாக்கப்பட வேண்டிய உலோகம் முழுவதும் பாதுகாப்பு உலோகத்தை பூச வேண்டிய அவசியமில்லை.
• இரும்பைவிட எளிதில் அரிமானமடையும் Mg அல்லது ஜிங்க் போன்ற உலோகங்கள் தன்னிழப்பு நேர்மின்முனையாக பயன்படுகிறது.
• இரும்பு எதிர்மின்முனையாக செயலாற்றுகிறது. எனவே இரும்பு பாதுகாக்கப்படுகிறது.
• ஆனால் Mg அல்லது Zn அரித்தலுக்கு உள்ளாகின்றன.
• இம்முறை எதிர்முனை பாதுகாப்பு அல்லது தன்னிழப்பு பாதுகாப்பு எனப்படுகிறது.
26. H2 –O2, எரிபொருள் மின்கலத்தின் செயல்பாடுகளை விளக்குக.
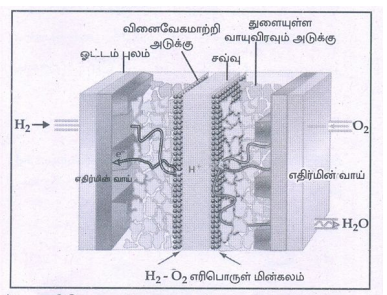
• எரிபொருள் மின்கலம் எரிபொருட்களை எரிப்பதால் உருவாகும் ஆற்றலை மின்னாற்றலாக மாற்றக் கூடிய கால்வானிக் மின்கலமானது எரிபொருள் மின்கலம் எனப்படும்.
• இது தொடர்ந்து வேலை செய்வதற்கு, வினை பொருள் தொடர்ந்து வழங்கப்பட வேண்டும்.
• எரிபொருள் மின்கலம் பின்வருமாறு குறிப்பிடப் படுகிறது. எரிபொருள்/ மின்முனை / மின்பகுளி / மின்முனை/ ஆக்சிஜனேற்றி
• ஹைட்ரஜன் - ஆக்சிஜன் எரிபொருள் மின்கலம் எரிபொருள் - ஹைட்ரஜன் ஆக்சிஜனேற்றி - ஆக்சிஜன்
மின்பகுளி - நீர்த்த KOH கரைசல்
வெப்பநிலை - 200°C
அழுத்தம் - 20 - 40 atm
வினையுறா மின்முனை - Ni மற்றும் NiO ஆகியவற்றைக் கொண்டுள்ள நுண்துளைகளை யுடைய கிராஃபைட் மின்முனை ஹைட்ரஜன் நேர்மின் முனையில் குமிழிகளாக செலுத்தப்படுகின்றன
நேர்மின்முனையில் ஆக்சிஜனேற்றம் நிகழ்கிறது
2H2(g) + 4OH- (aq) → 4H2O(l) + 4e-
• ஆக்சிஜன் எதிர்மின் முனையில் குமிழிகளாக செலுத்தப்படுகிறது.
• எதிர்மின் முனையில் ஒடுக்கம் நிகழ்கிறது.
O2(g) + 4H2O(l) + 4e – → 4OH- (aq)
• ஒட்டு மொத்த வினை :
2H2(g) + O2(g) → 4H2O(l)
27. அளவிலா நீர்த்தலில் Al3+ மற்றும் SO42- ஆகிய அயனிகளின் அயனிக் கடத்துத்திறன் மதிப்புகள் முறையே 189 மற்றும் 160 மோ செ.மீ2 சமானம்-1. அளவிலா நீர்த்தலில் Al2(SO4)3 மின்பகுளியின் சமான மற்றும் மோலார் கடத்துத்திறனை கணக்கிடுக.
λoAl3=189 மோ செ.மீ.2 சமானம்-1
λo SO42-= 160 மோ செ.மீ2 சமானம்-1
λom = ? ; λo = ?
தீர்வு : Al2(SO4)3 – 2Al3+ + 3SO42-
சமான கடத்துத்திறன்

மோலார் கடத்துத்திறன்
(∧m°) Al2(SO4)3 =2 λoAl3 +3λo SO42-
= 2 × 189 + 3 × 160
= 378 + 480
(∧m°) Al2(SO4)3 = 858 mho cm2 mol-1