Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї - Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї | 12th Chemistry : UNIT 9 : Electro Chemistry
12 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«цЯ»ЇЯ«цЯ«┐Я«»Я«ЙЯ«»Я««Я»Ї 9 : Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї
Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї
Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї
Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї, Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я«хЯ»ЄЯ«цЯ«┐ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я««Я«ЙЯ«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«њЯ«░Я»Ђ Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ«┐Я«▓Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«хЯ»єЯ«хЯ»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«цЯ«ЕЯ«┐ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е. Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я«ЙЯ«Ћ Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
1. Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї (Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ«Й Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї): Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕЯ«»Я«ЙЯ«Е Я«хЯ»ЄЯ«цЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ІЯ«ЪЯ»ЇЯ«ЪЯ««Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я«хЯ»ЄЯ«цЯ«┐ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«ЄЯ«хЯ»ѕ Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«јЯ«Е Я«ЁЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
2. Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«фЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«хЯ»єЯ«│Я«┐ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ѓЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ»єЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ІЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»ЇЯ«цЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕЯ«»Я«▒Я»ЇЯ«▒ Я«хЯ«┐Я«ЕЯ»ѕ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ, Я«хЯ»ЄЯ«цЯ«┐ Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
1. Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї
Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«ЅЯ«▓Я»ІЯ«Ћ Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«»Я»ѕ, Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«џЯ«▓Я»ЇЯ«фЯ»ЄЯ«ЪЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«ЕЯ»Ї Я«еЯ»ђЯ«▓ Я«еЯ«┐Я«▒Я««Я»Ї Я«хЯ»єЯ«│Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ, Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я««Я»ђЯ«цЯ»Ђ Я«џЯ«┐Я«хЯ«фЯ»ЇЯ«фЯ»Ђ - Я«фЯ«┤Я»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«еЯ«┐Я«▒Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ«ЪЯ«┐Я«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«еЯ«ЙЯ««Я»Ї, XI Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«▓Я»ЄЯ«»Я»Є Я«ЋЯ«▒Я»ЇЯ«▒Я«▒Я«┐Я«еЯ»ЇЯ«цЯ»ІЯ««Я»Ї. Я«ЄЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«ЋЯ«ЙЯ«░Я«БЯ««Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Zn(s) + CuSO4(aq) Рєњ ZnSO4(aq) + Cu(s)
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«БЯ»ЇЯ«Ъ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«хЯ»єЯ«фЯ»ЇЯ«ф Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«Ћ Я«џЯ»ѓЯ«┤Я«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЄЯ«┤Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«БЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї, Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ««Я»Ї, Cu2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я«ЪЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«▓Я»ІЯ«Ћ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»ЂЯ««Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ«░Я»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
Zn(s) Рєњ Zn2+(aq) +2e- (Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї)
Cu2+(aq) + 2eРђЊ Рєњ Cu (s) (Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї)
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«» Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«░Я»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»ѕ Я«фЯ«ЪЯ««Я»Ї 9.5 Я«▓Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«хЯ«ЙЯ«▒Я«ЙЯ«Е Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▓Я»Ї Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«цЯ«ЕЯ«┐Я«»Я«ЙЯ«Ћ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я«┐Я«ЕЯ»Ї Я«њЯ«░Я»Ђ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ«ЋЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ««Я»Ї. Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї. Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«» Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«ЄЯ«еЯ»ЇЯ«ц Я«ЁЯ«░Я»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»ѕ Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«цЯ«ЕЯ«┐Я«»Я«ЙЯ«Ћ Я«еЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ«▓Я»Є Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я«ЋЯ«ЪЯ»ЇЯ«ЪЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕ Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»Ђ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї
Я«фЯ«ЪЯ««Я»Ї 9.5 Я«▓Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«хЯ«ЙЯ«▒Я»Ђ Я««Я»ЂЯ«ЋЯ«хЯ»ѕЯ«»Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«џЯ«▓Я»ЇЯ«фЯ»ЄЯ«ЪЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ«фЯ»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я««Я»ѓЯ«┤Я»ЇЯ«Ћ Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї
Я«фЯ«ЪЯ««Я»Ї 9.5Я«▓Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«хЯ«ЙЯ«▒Я»Ђ Я««Я»ЂЯ«ЋЯ«хЯ»ѕЯ«»Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«џЯ«▓Я»ЇЯ«фЯ»ЄЯ«ЪЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ«фЯ»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я««Я»ѓЯ«┤Я»ЇЯ«Ћ Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЄЯ«БЯ»ѕЯ«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«ЋЯ«│Я»Ї Я«хЯ»єЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«▒Я««Я«ЙЯ«Ћ Я«њЯ«░Я»Ђ Я«ЋЯ««Я»ЇЯ«фЯ«┐ Я««Я»ѓЯ«▓Я««Я»Ї Я«ЄЯ«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«цЯ«ЕЯ»ѓЯ«ЪЯ»Є Я«њЯ«░Я»Ђ Я«ЄЯ«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«»Я»ЂЯ««Я»Ї (k) Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ѓЯ«▓Я««Я»ЂЯ««Я»Ї Я«ЄЯ«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е. (Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»Ђ: Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я««Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«░Я»Ї). Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ«│Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї, Я«цЯ«▓Я»ѕЯ«ЋЯ»ђЯ«┤Я«ЙЯ«Ћ Я«ЋЯ«хЯ«┐Я«┤Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ U Я«хЯ«ЪЯ«┐Я«х Я«ЋЯ»ЂЯ«┤Я«ЙЯ«»Я»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЄЯ«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е. Я«ЄЯ«еЯ»ЇЯ«ц U Я«хЯ«ЪЯ«┐Я«х Я«ЋЯ»ЂЯ«┤Я«ЙЯ«»Я«┐Я«▓Я»Ї, Я«ЁЯ«ЋЯ«ЙЯ«░Я»Ї-Я«ЁЯ«ЋЯ«ЙЯ«░Я»Ї Я«юЯ»єЯ«▓Я»ЇЯ«▓Я»ЂЯ«ЪЯ«ЕЯ»Ї KCl, Na2SO4 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ«▒Я«Й Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ«│Я»Ї Я«ЋЯ«▓Я«еЯ»ЇЯ«ц Я«фЯ«џЯ»ѕ Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«ЄЯ«еЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ«▒Я«Й Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я««Я«▒Я»ЇЯ«▒ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ, Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЁЯ«хЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»І Я«ЁЯ«ЪЯ»ѕЯ«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ. Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»ЇЯ«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»Ї Я«хЯ«┤Я«┐Я«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї, Я«ЄЯ«еЯ»ЇЯ«ц Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»ЇЯ«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«│Я»ЇЯ«│Я»ЄЯ«»Я»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«»Я»І Я«џЯ»єЯ«▓Я»ЇЯ«▓ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
Я«ЄЯ«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐ (k) Я««Я»ѓЯ«▓Я««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я»ѕ Я««Я»ѓЯ«ЪЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«фЯ«ЙЯ«»Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«ЋЯ«ЙЯ«░Я«БЯ««Я»Ї Я«ЁЯ«еЯ»ЇЯ«цЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Є Я«єЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЁЯ«хЯ»ѕ Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
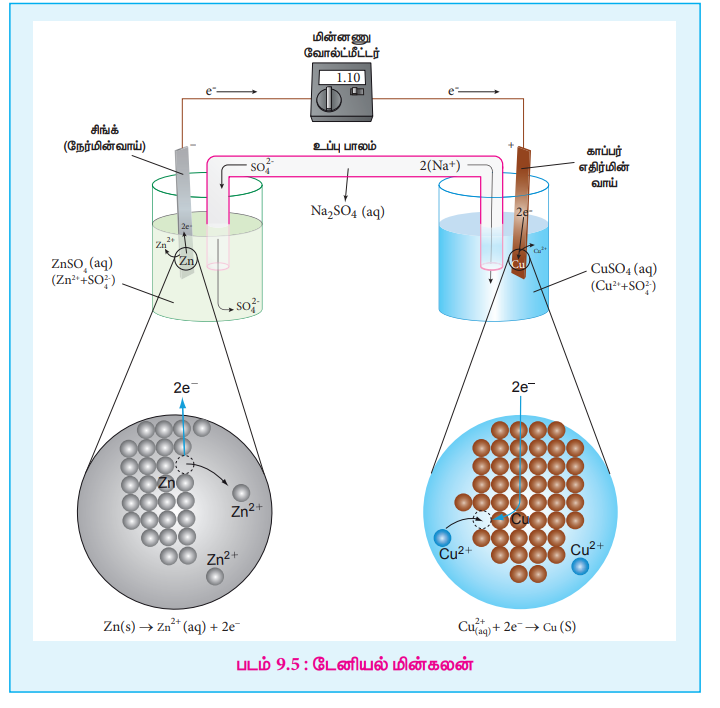
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«хЯ«ЙЯ«»Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї
Я«јЯ«еЯ»ЇЯ«цЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»І Я«ЁЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї, Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«єЯ«ЕЯ«цЯ»Ђ Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї, Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«еЯ»ЇЯ«ц Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«│Я»Ї Я«еЯ»ЂЯ«┤Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї, Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ««Я»ЇЯ«фЯ«┐Я«»Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«хЯ»єЯ«│Я«┐Я«џЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«фЯ«ЙЯ«»Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я«фЯ«┐Я«ЕЯ»ЇЯ«ЕЯ«░Я»Ї Я«ЁЯ«хЯ»ѕ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«│Я»Ї Я«еЯ»ЂЯ«┤Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«хЯ«┐Я«ЪЯ»ЂЯ«хЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї, Я«јЯ«цЯ«┐Я«░Я»ЇЯ«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ѕ ( - ve) Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Zn(s) Рєњ Zn2+ (aq) + 2e- (Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЄЯ«┤Я«фЯ»ЇЯ«фЯ»Ђ- Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї)
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«хЯ«ЙЯ«»Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї
Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ«░Я»Є Я«хЯ«┐Я«хЯ«ЙЯ«цЯ«┐Я«цЯ»ЇЯ«цЯ«фЯ«ЪЯ«┐, Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я»Ђ Я«хЯ«┤Я«┐Я«»Я»Є Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«фЯ«ЙЯ«»Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Cu2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЈЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«ЅЯ«▓Я»ІЯ«ЋЯ««Я«ЙЯ«Ћ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я«ЪЯ»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЄЯ«хЯ»ѕ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»Ї Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я««Я»ђЯ«цЯ»Є Я«фЯ«ЪЯ«┐Я«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«ЪЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«│Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ѕ (+ve) Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Cu2+ (aq) 2e- Рєњ Cu (s) (Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ»Ђ- Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї)
Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»Ї Я«фЯ«ЙЯ«▓Я««Я»Ї
Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»Ї Я«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЄЯ«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«цЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«џЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«еЯ«ЙЯ««Я»Ї Я«ЋЯ«▒Я»ЇЯ«▒Я«▒Я«┐Я«еЯ»ЇЯ«цЯ»ІЯ««Я»Ї. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, SO42- Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«њЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ«│Я«хЯ«┐Я«▓Я»Ї Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«┐Я«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЁЯ«цЯ«┐Я«Ћ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«»Я»ѕ Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ»ЄЯ«фЯ»ІЯ«▓, Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Cu2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я«ЙЯ«Ћ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«цЯ«┐Я«Ћ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕЯ«»Я»ѕ Я«фЯ»єЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Cu2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«њЯ«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ SO42- Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Ћ Я«ЅЯ«│Я»ЇЯ«│Я«Е.
Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ«│Я«┐Я«▓Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«еЯ«ЪЯ»ЂЯ«еЯ«┐Я«▓Я»ѕЯ«цЯ»ЇЯ«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ѕ Я«фЯ«░Я«ЙЯ««Я«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЪЯ»Ђ, Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ«▒Я«Й Я«јЯ«цЯ«┐Я«░Я«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Cl- (Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»Ї Я«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ KCl Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ) Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»Ї Я«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«│Я»Ї Я«еЯ»ЂЯ«┤Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ«цЯ»Є Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї K+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»ЇЯ«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«│Я»Ї Я«еЯ«ЋЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я»Ђ Я««Я»ЂЯ«┤Я»ЂЯ««Я»ѕЯ«»Я«ЪЯ»ѕЯ«цЯ«▓Я»Ї
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ , Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ««Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐ Я«хЯ»єЯ«│Я«┐Я«џЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ«ЙЯ«»Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЁЯ«цЯ»Є Я«еЯ»ЄЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї, Я«јЯ«цЯ«┐Я«░Я«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я»ЂЯ««Я»Ї, Я«еЯ»ЄЯ«░Я«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«фЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«»Я»ЂЯ««Я»Ї Я«еЯ«ЋЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я»Ђ Я««Я»ЂЯ«┤Я»ЂЯ««Я»ѕЯ«»Я«ЪЯ»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«ЁЯ«┤Я«┐Я«цЯ«▓Я»Ї
Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«Ъ, Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«▒Я»ѕ Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є Я«юЯ«┐Я«ЎЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я««Я»ЂЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»ЂЯ««Я«ЙЯ«Ћ Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЂЯ««Я»Ї Я«хЯ«░Я»ѕЯ«»Я«┐Я«▓Я»І Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я««Я»іЯ«цЯ»ЇЯ«ц Cu2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«Ћ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЂЯ««Я»Ї Я«хЯ«░Я»ѕЯ«»Я«┐Я«▓Я»І Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї Я«хЯ»ЄЯ«▓Я»ѕ Я«џЯ»єЯ«»Я»ЇЯ«»Я»ЂЯ««Я»Ї.
Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я«фЯ»ІЯ«▓Я«▓Я»ЇЯ«▓Я«ЙЯ««Я«▓Я»Ї, Я«џЯ«┐Я«▓ Я«еЯ»ЄЯ«░Я»ЇЯ«хЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї, Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ«ЪЯ»ЂЯ«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ«┐Я«│Я»ѕ Я«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ, Я«ЁЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я«еЯ»ЄЯ«░Я»ЇЯ«хЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЋЯ«┐Я«░Я«ЙЯ«ЃЯ«фЯ»ѕЯ«ЪЯ»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ«▒Я«Й Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я«ЄЯ«хЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ІЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»ЇЯ«цЯ»ѕ Я«хЯ»єЯ«│Я«┐Я«џЯ»ЇЯ«џЯ»ЂЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
2. Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»Ђ
Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Zn (s) | Zn2+ (aq) || Cu2+ (aq) |Cu (s)
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«БЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї, Я«њЯ«▒Я»ЇЯ«▒Я»ѕ Я«џЯ»єЯ«ЎЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ»ІЯ«ЪЯ«ЙЯ«ЕЯ«цЯ»Ђ (Рћѓ) Я«еЯ«┐Я«▓Я»ѕЯ««Я»ѕ Я«јЯ«▓Я»ЇЯ«▓Я»ѕЯ«»Я»ѕЯ«»Я»ЂЯ««Я»Ї, Я«ЄЯ«░Я«ЪЯ»ЇЯ«ЪЯ»ѕ Я«џЯ»єЯ«ЎЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»ІЯ«ЪЯ«ЙЯ«ЕЯ«цЯ»Ђ (||) Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»Ї Я«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»ЇЯ«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЄЯ«ЪЯ«цЯ»Ђ Я«фЯ»ЂЯ«▒Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї, Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«фЯ»ЇЯ«фЯ«ЙЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«хЯ«▓Я«цЯ»Ђ Я«фЯ»ЂЯ«▒Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«јЯ«┤Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є Я«ЄЯ«ЪЯ«цЯ»Ђ Я«ЊЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї, Я«хЯ«▓Я«цЯ»Ђ Я«ЊЯ«░Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«јЯ«┤Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«хЯ«▓Я«цЯ»Ђ Я«фЯ»ЂЯ«▒Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«јЯ«┤Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»Ђ
Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«░ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.
2 Cr (s) + 3Cu2+ (aq) Рєњ 2Cr3+ (aq) + 3Cu (s)
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«Ћ, Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЁЯ«░Я»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»ѕ Я«јЯ«┤Я»ЂЯ«цЯ»ЂЯ«Ћ.
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«хЯ«ЙЯ«»Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї: 2Cr (s) Рєњ 2Cr3+ (aq) + 6e- ....(1)
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«хЯ«ЙЯ«»Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї: 3Cu2+ (aq) + 6e- Рєњ 3 Cu (s) ..... (2)
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«»Я»ђЯ«ЪЯ»Ђ
Cr (s) | Cr3+ (aq) || Cu2+ (aq) | Cu(s)
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ
Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«њЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«Ћ Я«ЄЯ«БЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕЯ«»Я«ЙЯ«Е Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ«ЙЯ«»Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«хЯ»єЯ«│Я«┐Я«цЯ»ЇЯ«цЯ«│Я»ЇЯ«│Я«хЯ»ЂЯ««Я»Ї, Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐ Я«ЄЯ«┤Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Е Я«хЯ«┐Я«џЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┐Я«»Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«┐Я«џЯ»ѕ (emt) Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї SI Я«ЁЯ«▓Я«ЋЯ»Ђ Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї (V).
Я«еЯ»ЄЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«њЯ«░Я»Ђ Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«ц Я«хЯ»ЄЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»Ђ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«▒Я»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«њЯ«хЯ»ЇЯ«хЯ»іЯ«░Я»Ђ Я«ЋЯ»ѓЯ«▓Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ѓЯ«ЪЯ»ЇЯ«ЪЯ««Я»Ї Я«еЯ«ЋЯ«░Я»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»ЂЯ««Я»Ї Я«њЯ«░Я»Ђ Я«юЯ»ѓЯ«▓Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«хЯ»єЯ«│Я«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
i.e., 1J = 1C ├Ќ 1V .....(9.18)
Я«ЋЯ«▓ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ, Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ Я«єЯ«ЋЯ«┐Я«»Я«хЯ«▒Я»ЇЯ«▒Я»ѕ Я«фЯ»іЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»Ђ.
Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ 25┬░C Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«ЪЯ»ЄЯ«ЕЯ«┐Я«»Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ 1.107 Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я«єЯ«ЋЯ»ЂЯ««Я»Ї.
Zn (s) | Zn2+ (aq,1M) || Cu2+ (aq,1M) | Cu ( s ) E0 = 1.107 V
Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«ЁЯ«│Я«хЯ«┐Я«ЪЯ«▓Я»Ї
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я««Я»іЯ«цЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ - Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«░Я»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«цЯ«▓Я«ЙЯ«Ћ Я«ЋЯ«░Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї. Я«ЄЯ«цЯ»ЄЯ«фЯ»ІЯ«▓, Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ««Я»Ї, Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«цЯ«▓Я«ЙЯ«Ћ Я«ЋЯ«░Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Ecell = (E ox ) anode + (Ered ) cathode .....(9.19)
Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ђ, (Eox)anode Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕЯ«»Я»ЂЯ««Я»Ї, (Ered)cathode Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«њЯ«░Я»Ђ Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ЂЯ«цЯ«▓Я»Ї Я«џЯ«ЙЯ«цЯ»ЇЯ«цЯ«┐Я«»Я««Я«▒Я»ЇЯ«▒Я«цЯ»Ђ. Я«єЯ«ЕЯ«ЙЯ«▓Я»Ї, Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я««Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«░Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«ц Я«хЯ»ЄЯ«▒Я»ЂЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ѕ (Ecell) Я«еЯ««Я»ЇЯ««Я«ЙЯ«▓Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЈЯ«цЯ»ЄЯ«ЕЯ»ЂЯ««Я»Ї Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«еЯ««Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«цЯ»єЯ«░Я«┐Я«еЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«│Я«хЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«ц (Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ 9.19) Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»іЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«еЯ««Я»ЇЯ««Я«ЙЯ«▓Я»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є, emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«цЯ»єЯ«░Я«┐Я«еЯ»ЇЯ«ц Я«њЯ«░Я»Ђ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«еЯ««Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«цЯ»Ї Я«цЯ»ЄЯ«хЯ»ѕ.
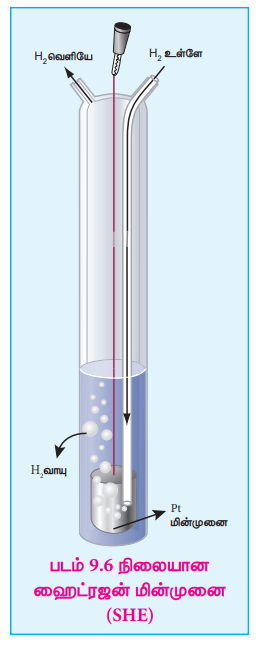
Я«ЄЯ«еЯ»ЇЯ«ц Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ«ЙЯ«Ћ, Я«цЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ (SHE) Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ (reference electrode) Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕЯ«»Я«ЙЯ«Ћ Я«фЯ»ѓЯ«юЯ»ЇЯ«юЯ«┐Я«»Я««Я»Ї Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я«јЯ«Е Я«еЯ«┐Я«░Я»ЇЯ«БЯ«»Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«ЄЯ«цЯ»Ђ, 1M HCl Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї 1 atm Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«Е Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«фЯ«ЪЯ««Я»Ї 9.6 Я«▓Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│Я«хЯ«ЙЯ«▒Я»Ђ 25oC Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«ЋЯ»ЂЯ««Я«┐Я«┤Я«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. SHE Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї, Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї. Я«ЁЯ«░Я»ѕЯ«ЋЯ»Ї Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
SHE Я«єЯ«ЕЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«хЯ«ЙЯ«»Я«ЙЯ«Ћ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕ
2H+ (aq,1M)+2eРђЊ Рєњ H2 (g, 1 atm)
E┬░ = 0 volt
SHE Я«єЯ«ЕЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«хЯ«ЙЯ«»Я«ЙЯ«Ћ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«хЯ«┐Я«ЕЯ»ѕ
H2 (g, 1 atm) Рєњ 2H+ (aq,1M)+2eРђЊ E┬░ = 0 volt
Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ««Я»Ї
Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«џЯ«▓Я»ЇЯ«фЯ»ЄЯ«ЪЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я««Я»ѓЯ«┤Я»ЇЯ«ЋЯ«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ SHE Я«љ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«еЯ«ЙЯ««Я»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ЂЯ«хЯ»ІЯ««Я»Ї.
Я«фЯ«ЪЯ«┐: 1 SHE Я«љ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я«ЋЯ«ЪЯ»ЇЯ«ЪЯ««Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
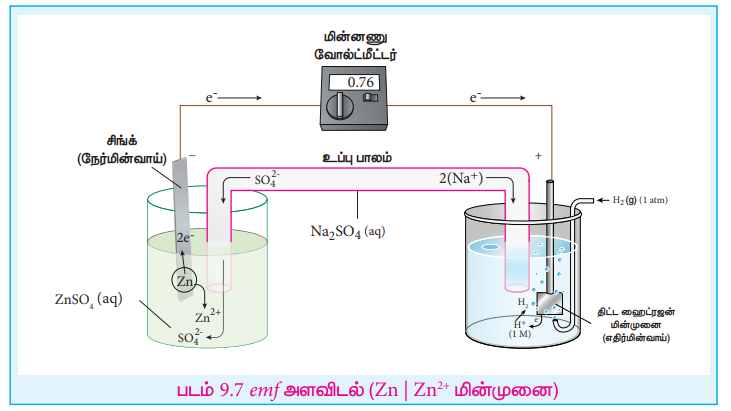
Zn (s) | Zn2+ (aq, 1M) || H+ (aq, 1M) | H2 (g, 1atm) | Pt (s)
Я«фЯ«ЪЯ«┐: 2 Я««Я»ЄЯ«▓Я»Є Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я««Я»ђЯ«ЪЯ»ЇЯ«ЪЯ«░Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЁЯ«│Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«еЯ»ЇЯ«ц Я«еЯ»ЄЯ«░Я»ЇЯ«хЯ«┐Я«▓Я»Ї Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«БЯ»Ї Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«│Я«еЯ»ЇЯ«цЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ 0.76V.
Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»Ђ
Я«еЯ«ЙЯ««Я«▒Я«┐Я«еЯ»ЇЯ«ц Я«фЯ«ЪЯ«┐,
Eocell = (E oxo) znРћѓZn2+ + (Eo red) SHE [Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ 9.19 Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ]
Eocell = 0.76 and (Eo red) SHE = 0V . Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Я««Я»ЄЯ«▓Я»Є Я«ЅЯ«│Я»ЇЯ«│ Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«фЯ«┐Я«░Я«цЯ«┐Я«»Я«┐Я«Ъ
РЄњ 0.76 V= (Eo Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐) Zn | Zn2+ + 0
РЄњ (Eo Я«єЯ«ЋЯ«ИЯ«┐) Zn | Zn2+ = 0.76 V
Я«ЄЯ«еЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ђЯ«┤Я»Є Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«ЁЯ«░Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«▓ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ»ЂЯ«ЪЯ»ѕЯ«»Я«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Zn Рєњ Zn2+ + 2e- (Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї)
Я«ЄЯ«цЯ«ЕЯ»Ї Я««Я«▒Я»ЂЯ«цЯ«▓Я»ѕ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Zn2+ + 2e- Рєњ Zn; Eo = - 0.76V
РѕЎ (Eo red) Zn2+Рћѓ Zn = - 0.76V
IUPAC Я«хЯ«░Я»ѕЯ«»Я«▒Я»ѕ
Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї (E) Я«цЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я»ѕ Я«ЄЯ«ЪЯ«цЯ»ЂЯ«фЯ»ЂЯ«▒ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї, Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я»ѕ Я«хЯ«▓Я«цЯ»ЂЯ«фЯ»ЂЯ«▒ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┐Я«»Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«┐Я«џЯ»ѕ
Я«цЯ«┐Я«ЪЯ»ЇЯ«Ъ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї E Я«ЄЯ«ЪЯ«цЯ»ЂЯ«фЯ»ЂЯ«▒ Я«ЁЯ«░Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«цЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«еЯ»ђЯ«░Я»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«фЯ»єЯ«▒Я»ЇЯ«▒ Я«фЯ»ЂЯ«░Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я««Я«ЪЯ»ѕЯ«»Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«цЯ«┐Я«ЪЯ»ЇЯ«Ъ emf.
Я«цЯ«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ђЯ«ЪЯ»Ђ
1. 25┬░C Я«▓Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ 0.34V. Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«ц Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ЂЯ«Ћ.
Pt (s) | H2 (g, latm) | H+ (aq, 1M) || Cu2+ (aq, IM)| Cu (s)
2. Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐, 25┬░C Я«▓Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«ЋЯ«ЙЯ«БЯ»ЇЯ«Ћ.
Zn (s) | Zn2+ (aq, 1M) || Cu2+ (aq, 1M) | Cu (s)
Я«цЯ«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ђЯ«ЪЯ»Ђ
Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѕ Я«јЯ«┤Я»ЂЯ«цЯ»ЂЯ«Ћ.
Pt(s) | Fe2+ (aq),Fe3+ (aq) || MnO-4 (aq), H+ (aq),Mn2+ (aq) | Pt(s)