மின் வேதியியல் | வேதியியல் - சரியான விடையைத் தேர்வு செய்க | 12th Chemistry : UNIT 9 : Electro Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 9 : மின் வேதியியல்
சரியான விடையைத் தேர்வு செய்க
வேதியியல் : மின் வேதியியல்
I. சரியான விடையைத் தேர்வு செய்க
1. மொத்தமாக 9650 கூலூம்கள் மின்னூட்டத்தை பெற்றுள்ள எலக்ட்ரான்களின் எண்ணிக்கை,
அ) 6.22 × 1023
ஆ) 6.022 × 1024
இ)6.022 × 1022
ஈ) 6.022 × 10-34
விடை : இ) 6.022 × 1022
தீர்வு :
1F = 96500 C = 1 மோல் எலக்ட்ரான்கள் = 6.023 × 1023e-
9650 C = (6.22 × 1023) / (96500) × 9650 = 6.022 × 1022
2. பின்வரும் அரைக்கல வினைகளை கருதுக.
Mn2+ + 2e- →Mn E° = -1.18V
Mn2+ → Mn3+ +e- E° = -1.51V
3Mn2+ → Mn + 2Mn3+ என்ற வினையின் E° மதிப்பு மற்றும் முன்னோக்கு வினையின் சாத்தியக் கூறு முறையே
அ) 2.69 V மற்றும் தன்னிச்சையானது
ஆ) -2.69V மற்றும் தன்னிச்சையற்றது
இ) 0.33 V மற்றும் தன்னிச்சையானது
ஈ) 4.18 V மற்றும் தன்னிச்சையற்றது
விடை : ஆ) -2.69V மற்றும் தன்னிச்சையற்றது
தீர்வு :
Mn2+ + 2e- → Mn (E°red) = -1.18 V
2[Mn2+ → Mn3+ + e-] (Eoox) = - 1.51 V
3Mn2+ = Mn + 2Mn3+ Eocell = ?
Eocell = (Eoox) + (Eored)
= - 1.51 – 1.18 = - 2.69 V
மற்றும் தன்னிச்சையானதல்ல
Eo எதிர் குரியானதால் ∆G நேர்க்குறி மற்றும் முன்னோக்கு மின்கலவினை தன்னிச்சையானது அல்ல
3. கை கடிகாரங்களில் பயன்படும் பட்டன் மின்சேமிப்புக் கலன்கள் பின்வருமாறு செயல்புரிகின்றன.
Zn (s) + Ag2O (s) + H2O (l) = 2Ag (s) + Zn2+ (aq) + 2OH- (aq) E° = 0.76V
Ag2O (s) + H2O (l) + 2e – → 2Ag (s) + 2 OH- (aq) E° = 0.34 V எனில் மின்கல மின்னழுத்தம்
அ) 0.84 V
ஆ) 1.34 V
இ) 1.10 V
ஈ) 0.42 V
விடை : இ) 1.10V
தீர்வு :
நேர்மின்வாய் ஆக்சிஜனேற்றம் :
(E°ox) = 0.76 V கொடுக்கப்பட்ட வினையின்
எதிர்வினை
E°cell = (E°ox) + (E°red)
= 0.76 + 0.34 = 1.1 V
4. 298 K வெப்பநிலையில் 0.5 mol dm-3 செறிவுடைய AgNO3 கரைசலின் மின்பகுளிக் கடத்துத் திறன் மதிப்பு 5.76 × 10-3 Scm-1 எனில், அதன் மோலார் கடத்துத்திறன் மதிப்பு
அ) 2.88Scm2 mol-1
ஆ)11.52Scm2 mol-1
இ) 0.086 Scm2mol-1
ஈ) 28.8Scm2 mol-1
விடை : ஆ)11.52Scm2 mol-1
தீர்வு :
Λ = κ/M ×10−3 mol−1 m3
= [( 5.76 × 10−3 S cm−1 ×10−3 ) / (0. 5)] mol−1m3
= [(5.76 × 10−3 × 10−3 ×106 ) / (0.5)] S cm−1mol−1 cm3 .
= 11.52 S cm2 mol−1
5. 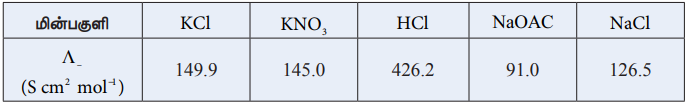
அளவிலா நீர்த்தலில், 25°C வெப்பநிலையில், மின் பகுளிகளின் மோலார் கடத்துத்திறன் மதிப்புகள் மேலேயுள்ள அட்டவணையில் கொடுக்கப் பட்டுள்ளன. அவற்றிலிருந்து தகுந்த மதிப்புகளை பயன்படுத்தி Λo HOAC மதிப்பை கணக்கிடுக.
அ) 517.2
ஆ) 552.7
இ) 390.7
ஈ) 217.5
விடை : இ) 390.7
தீர்வு :
(Λ∞) HOAC = [Λo Hcl + Λo NaOACl] – (Λo) NaCl
= (426.2 + 91) - (126.5) = 390.7
6. ஃபாரடே மாறிலி ........... என வரையறுக்கப் படுகிறது
அ) 1 எலக்ட்ரானால் சுமந்து செல்லப்படும் மின்னூட்டம்
ஆ) 1 மோல் எலக்ட்ரான்களால் சுமந்து செல்லப்படும் மின்னூட்டம்.
இ) ஒரு மோல் பொருளை விடுவிக்க தேவைப்படும் மின்னூட்டம்
ஈ) 6.22 × 1010 எலக்ட்ரானால் சுமந்து செல்லப்படும் மின்னூட்டம்
விடை : ஆ) 1 மோல் எலக்ட்ரான்களால் சுமந்து செல்லப்படும் மின்னூட்டம்
தீர்வு :
1F = 96500 C = 1 மோல் எலக்ட்ரான்களின் மின்சுமை = 6.022 × 1023 எலக்ட்ரானின் மின்சுமை
7. பின்வரும் வினை நிகழ எவ்வளவு ஃபாரடே மின்னோட்டம் தேவைப்படும்?
MnO4- → Mn2+
அ) 5F
ஆ) 3F
இ) IF
ஈ) 7F
விடை: அ) 5F
தீர்வு :
7Mno4- + 5e- → Mn2+ + 4H2O
தேவைப்படும் 5 மோல் எலக்ட்ரான்கள் அதாவது 5F மின்சுமை
8. உருகிய கால்சியம் ஆக்சைடு கரைசலின் வழியே, 3.86 A அளவுள்ள மின்னோட்டமானது, 41 நிமிடங்கள் மற்றும் 40 விநாடிகளுக்கு செலுத்தப் படுகிறது. எதிர்மின் முனையில் வீழ்படிவாகும் கால்சியத்தின் நிறை கிராமில் கணக்கிடுக. (Ca ன் அணு நிறை 40 கிராம் / மோல் மற்றும் 1F = 96500C)
அ) 4
ஆ)2
இ) 8
ஈ) 6
விடை : ஆ) 2
தீர்வு :
m = ZIt 41 நிமிடங்கள் 40 வினாடிகள்
= 2500 வினாடிகள்
= (40 × 3.86 × 2500) / (2 × 96500) ;
Z = m / (n × 96500) = (40) / (2 × 96500)
= 2g
9. உருகிய சோடியம் குளோரைடு மின்னாற்பகுத்தலில், 3A மின்னோட்டத்தை பயன்படுத்தி 0.1 மோல் குளோரின் வாயுவை உருவாக்க தேவைப்படும் நேரம்
அ) 55 நிமிடங்கள்
ஆ) 107.2 நிமிடங்கள்
இ) 220 நிமிடங்கள்
ஈ) 330 நிமிடங்கள்
விடை : ஆ) 107.2 நிமிடங்கள்
தீர்வு :
m = ZIt (ஒரு மோல் C12 வாயுவின் நிறை =71)
t = m/ZI (ஃ 0.1 மோல் குளோரின் வாயுவின் நிறை = 7.1 g mol-1)
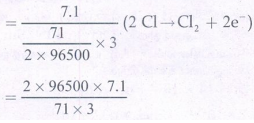
= 6433.33 வினாடிகள் = 107.2 நிமிடங்கள்
10. 1A மின்னோட்டத்தை பயன்படுத்தி மின்னாற் பகுக்கும் போது 60 விநாடிகளில், எதிர்மின் முனையில் விடுவிக்கப்படும் எலக்ட்ரான்களின் எண்ணிக்கை (எலக்ட்ரானின் மின்சுமை = 1.6 x 10-19 C)
அ) 6.22 × 1023
ஆ) 6.022 × 1020
இ) 3.75 × 1020
ஈ) 7.48 × 1023
விடை : இ) 3.75 × 1020
தீர்வு :
Q = It
= 1A × 60S
96500 C மின்சுமை = 6.022 × 1023 எலக்ட்ரான்
60 C மின்சுமை = (6.022 × 1023) / 96500 × 60
= 3.744 × 1020 எலக்ட்ரான்
11. பின்வரும் மின்பகுளிக் கரைசல்களில் குறைந்தபட்ச நியம கடத்துத்திறனைப் பெற்றுள்ளது எது?
அ) 2N
ஆ) 0.002N
இ) 0.02 N
ஈ) 0.2N
விடை : ஆ) 0.002N
தீர்வு :
பொதுவாக ஒரு மின்பகுளியின் நியம மின் கடத்து திறன் நீர்த்தலின் போது குறைகின்றது. எனவே 0.002 N கரைசல் மிக குறைந்த நியம மின்கடத்து திறன் கொண்டுள்ளது.
12. லெட் சேமிப்புக் கலனை மின்னேற்றம் (Charging) செய்யும் போது
அ) எதிர்மின்முனையில் PbSO4 ஆனது Pb ஆக ஒடுக்கமடைகிறது.
ஆ) நேர்மின்முனையில் PbSO4 ஆனது Pb ஆக ஆக்ஸிஜனேற்றமடைகிறது
இ) நேர்மின்முனையில் PbSO4 ஆனது Pb ஆக ஒடுக்கமடைகிறது.
ஈ) எதிர்மின்முனையில் PbSO4 ஆனது Pb ஆக ஆக்ஸிஜனேற்றமடைகிறது.
விடை : இ) நேர்மின்முனையில் PbSO4 ஆனது Pb ஆக ஒடுக்கமடைகிறது.
தீர்வு :
மின்னேற்றம் அடையும் போது நேர் மின்வாய்
PbSO4 (s) + 2e- → Pb (s) + SO4-2 (aq)
எதிர் மின்வாய்
PbsO4 (s) + 2H20 (l) → PbO2 (s) + SO4-2 (aq) + 2e-
13. பின்வரும் மின்கலங்களில்
I) லெக்லாஞ்சே மின்கலம்
II) நிக்கல்-காட்மியம் மின்சேமிப்புக்கலம்
III) லெட் சேமிப்புக் கலம்
IV) மெர்குரி மின்கலம்
எவை முதன்மை மின்கலங்களாகும்?
அ) I மற்றும் IV
ஆ) I மற்றும் III
இ) III மற்றும் IV
ஈ) II மற்றும் III
விடை : அ) 1 மற்றும் IV
தீர்வு : I மற்றும் IV
14. இரும்பின் மீது ஜிங்க் உலோகத்தை பூசி முலாம் பூசப்பட்ட இரும்பு தயாரிக்கப்படுகிறது, இதன் மறுதலை சாத்தியமற்றது. ஏனெனில்
அ) இரும்பை விட ஜிங்க் லேசானது
ஆ) இரும்பைவிட ஜிங்க் குறைந்த உருகுநிலையை பெற்றுள்ளது.
இ) இரும்பை விட ஜிங்க் குறைந்த எதிர்குறி மின்முனை -மின்னழுத்த மதிப்பை பெற்றுள்ளது.
ஈ) இரும்பை விட ஜிங்க் அதிக எதிர்குறி மின்முனை மின்னழுத்த மதிப்பை பெற்றுள்ளது.
விடை : ஈ) இரும்பை விட ஜிங்க் அதிக எதிர்குறி மின்முனை மின்னழுத்த மதிப்பை பெற்றுள்ளது.
தீர்வு :
EoZn+/Zn = -0.76V மற்றும் EoFe+/Fe = - 0.44 ஜிங்கின் எதிர்மின்முனை மின் அழுத்தமானது இரும்பினை விட அதிகம். எனவே இரும்பினால் பூசப்படுதல் இயலாது.
15. கூற்று : தூய இரும்பை உலர்ந்த காற்றில் வெப்பப் படுத்தும்போது துருவாக மாறுகிறது.
காரணம் : துருவின் இயைபு Fe3O4
அ) கூற்று மற்றும் காரணம் இரண்டும் சரி, மேலும் காரணம் கூற்றிற்கான சரியான விளக்கமாகும்.
ஆ) கூற்று மற்றும் காரணம் இரண்டும் சரி, ஆனால் காரணம் கூற்றிற்கான சரியான விளக்கமல்ல
இ) கூற்று சரி ஆனால் காரணம் தவறு
ஈ) கூற்று மற்றும் காரணம் இரண்டும் தவறு
விடை : ஈ) கூற்று மற்றும் காரணம் இரண்டும் தவறு இரண்டும் தவறு
i) இரும்பின் மீது உலர் காற்றுக்கு எவ்வித வினையும் இல்லை .
ii) துருவின் வாய்ப்பாடு Fe2O3.x H2O
16. H2 – O2 எரிபொருள் மின்கலத்தில் எதிர்மின் முனையில் நிகழும் வினை
அ) O2(g) + 2H2O (l)+ 4e - → 4OH - (aq)
ஆ) H+(aq) + OH- (aq) → H2O (1)
இ) 2H2 (g) + O2(g) → 2H2O(g)
ஈ) H+ + e- → ½ H2
விடை : அ) O2(g) + 2H2O (l) + 4e-→ 40H-(aq)
தீர்வு :
அ) O2(g) + 2H2O (l) + 4e- → 4OH-(aq)
17. M / 36 செறிவு கொண்ட வலிமைகுறைந்த ஒற்றைக்கார அமிலத்தின் சமான கடத்துத்திறன் மதிப்பு 6mho cm2 மற்றும் அளவிலா நீர்த்தலில் அதன் சமான கடத்துத்திறன் மதிப்பு 400 mho cm2 மதிப்பு
அ) 1.25 × 10-6
ஆ)6.25 × 10-6
இ) 1.25 × 10-4
ஈ) 6.25 × 10-5
விடை : ஆ) 6.25 × 10-6
தீர்வு :
α = Λ / Λo = 6/400
Ka =α2C
= 6/400 × 6/400 × 1/36
= 6.25 ×10−6
18. நியம கடத்துத்திறன் மதிப்பு K = 1.25 × 10-3 S cm-1 கொண்டுள்ள 0.01M செறிவுடைய 1 : 1 மின்பகுளிக் கரைசலை மின்கலத்தில் நிரப்பி ஒரு மின் கடத்து மின்கலனானது அளவுத்திருத்தம் செய்யப்படுகிறது 25°C வெப்பநிலையில் இதன் அளந்தறியப்பட்ட மின் தடை 8000 எனில் கலமாறிலி மதிப்பு
அ) 10-1cm-1
ஆ) 101 cm-1
இ) 101 cm-1
ஈ) 5.7 × 10-12
விடை : இ) 101 cm-1
தீர்வு :
R = ρ. l/A
மின்கலமாறிலி = R / ρ
= κ.R (1/ ρ =κ )
= 1.25 × 10−3 Ω−1cm−1 × 800 Ω
= 1 cm−1
19. 298K வெப்பநிலையில், AB எனும் சொற்ப அளவு கரையும் உப்பின் (1 : 1. மின்பகுளி) தெவிட்டிய கரைசலின் கடத்துத்திறன் 1.85 × 10-5 Sm-1. 298K வெப்பநிலையில், AB உப்பின் கரைதிறன் பெருக்க மதிப்பை கணக்கிடுக
(Ai)As = 14 × 10-3 Sm' mol-1.
அ) 5.7 × 10-12
ஆ) 1.32 × 10-12
இ) 7.5 × 10-12
ஈ) 1.74 × 10-12
விடை : ஈ) 1.74 × 10-12
தீர்வு :
k = 1.85 × 10-5 Sm-1
Λ°m = 14 × 10–3 Sm2mol-1
Ksp = ?
Ksp =
(k × 10-3/Λo)2
= (1.85 × 10-5 × 10-3)2
(14 × 10-3)
= (0.1321 × 10-5)2
= 0.01745 × 10-10
Ksp = 1.745 × 10-12
20. Zn|ZnSO4 (0.01 M) ||CusO4 (1.0 M) |Cu, எனும் மின்வேதிக்கலனை கருதுக. இந்த டேனியல் மின்கலத்தின் emf மதிப்பு E1. ZnSO4 ன் செறிவை 1.0M ஆகவும், CuSO4 ன் செறிவை 0.01 M, ஆகவும் மாற்றும்போது அதன் emf E2 ஆக மாறுகிறது. பின்வருவனவற்றுள் எந்த ஒன்று E1 மற்றும் E2 க்கு இடையேயுள்ள தொடர்பாக இருக்கும்?
அ) E1 < E2
ஆ) E1 > E2
இ) E2 > E1
ஈ) E1= E2
விடை : ஆ) E1 > E2
தீர்வு :
Zn(s) → Zn2+ (aq) + 2e-
Cu2+ (aq)+2e- → Cu(s)
Zn(s) +Cu2+ (aq) → Zn2+ (aq) + Cu(s)
Ecell =Eºமின்கலம் –
(0.0591/2) log ( [zn2+]/ [Cu2+] )
E1 =Eºமின்கலம் - 0.0591/2 log (10-2/1)
E1 =Eoமின்கலம் + 0.0591 ........(1)
E2 =Eºமின்கலம் - 0.0591/2 log (1/10-2)
E2 =Eoமின்கலம் - 0.0591
.........(2)
E1>E2
21. கீழே கொடுக்கப்பட்டுள்ள படத்தில் காட்டியுள்ள வாறு வெவ்வேறு emf மதிப்புகளைச் சார்ந்து புரோமினின் ஆக்ஸிஜனேற்ற நிலைகளில் ஏற்படும் மாற்றத்தை கருத்திற் கொள்க.
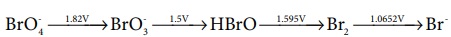
இவற்றில் விகிதச் சிதைவு அடையும் கூறு எது?
அ) Br2
ஆ) BrO4-
இ) BrO3-
ஈ) HBrO
விடை : ஈ) HBrO
தீர்வு :
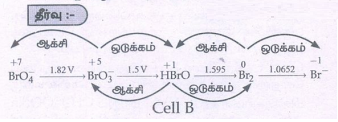
(Eமின்கலம்) A = -1.82 + 1.5=-0.32 V
(Eமின்கலம்) B = -1.5+ 1.595 = + 0.095 V
(Eமின்கலம்) C = -1.595 + 1.0652 = - 0.529 V
ஃவிகிதச் சிதைவடைவது HBrO.
22. பின்வரும் கலவினைக்கு 2Fe3+(aq) + 21-(aq) → 2Fe2+(aq) + I2(aq) 298K வெப்பநிலையில் E° கலம் = 0.24V எனில், கலவினையின் திட்ட கட்டிலா ஆற்றல் மாற்ற (∆G°) மதிப்பு
அ) -46.32 KJ mol-1
ஆ) -23.16 KI mol-1
இ) 46.32 KJ mol-1
ஈ) 23.16 KJ mol-1
விடை : அ) -46.32 KJ mol-1
தீர்வு :-
n= 2; E°cell = 0.24V; ∆G° = ?; F= 96500C
∆G° = - nFE°
∆G° = -2 x 96500 × 0.24
∆G° = - 46320 J mol-1
∆G° = - 46.32 KJ mol-1
23. ஒரு குறிப்பிட்ட அளவு மின்னோட்டமானது 2 மணி நேரத்தில் 0.504 கிராம் ஹைட்ரஜனை விடுவிக்கிறது. அதே அளவு மின்னோட்டத்தை அதே அளவு நேரத்திற்கு காப்பர் சல்பேட் கரைசலின் வழியே செலுத்தினால் எவ்வளவு கிராம் காப்பர் வீழ்படிவாக்கப்படும்?
அ) 31.75
ஆ) 15.8
இ) 7.5
ஈ) 63.5
விடை : ஆ) 15.8
தீர்வு :
m1 = 0.504g m2 = ?
e1 = 1.008 e2 = 31.77
m1 / m2 = e1 / e2
m2 = m1 / e1 = 0.504 × 31.77 / 1.008
= 15.885 g
24. 25°C வெப்பநிலையில் 1MY- மற்றும் 1MZ- ஆகியவற்றை கொண்டுள்ள கரைசலின் வழியே 1 atm அழுத்தத்தில் X எனும் வாயு குமிழிகளாக செலுத்தப்படுகிறது. அவற்றின் ஒடுக்க
மின்னழுத்தங்கள் Z > Y > X எனில்,
அ) Y ஆனது X ஐ ஆக்ஸிஜனேற்றம் செய்யும் ஆனால் Z ஐ ஆக்ஸிஜனேற்றம் செய்யாது.
ஆ) Y ஆனது Z ஐ ஆக்ஸிஜனேற்றம் செய்யும் ஆனால் X ஐ ஆக்ஸிஜனேற்றம் செய்யாது. –
இ) Y ஆனது X மற்றும் Z இரண்டையும் ஆக்ஸிஜனேற்றம் செய்யும்.
ஈ)Y ஆனது X மற்றும் Z இரண்டையும் ஒடுக்க மடையச் செய்யும்.
விடை : அ) Y ஆனது X ஐ ஆக்ஸிஜனேற்றம் செய்யும் ஆனால் Z ஐ ஆக்ஸிஜனேற்றம் செய்யாது
தீர்வு :
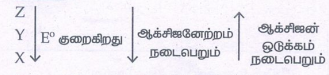
Z ஆனது Y மற்றும் X ஐ ஆக்சிஜனேற்றமடையச் செய்கிறது
Y ஆனது X ஐ ஆக்சிஜனேற்றமடையச் செய்கிறது Zஐ ஒடுக்கமடையச் செய்கிறது
X ஆனது Y மற்றும் Z ஐ ஒடுக்கமடையச் செய்கிறது
25. கலவினை : A + 2B+ → A2+ + 2B;
A2+ + 2e- → A E° = + 0.34 V மற்றும் 300K வெப்பநிலையில் இந்தகலவினைக்கு log10K = 15.6 at 300K எனில் B+ + e- → B எனும் கலவினைக்கு E° மதிப்பை காண்க (AIIMS – 2018)
அ) 0.80
ஆ) 1.26
இ) - 0.54
ஈ) - 10.94
விடை : அ) 0.80
தீர்வு :
A + 2B+ + A2+ → 2B E°cell =?
அரைமின்கலவினை :
நேர்மின்வாய் A→ A2+ + 2e-
E°ox =-0.34V [Given : A2+ + 2e-→ A
E°=+0.34V]
எதிர்மின்வாய் 2B+ + 2e- → 2B Eored =?
log10 K = 15.6; T= 300K; n = 2;
R = 8.314 JK-1 mol-1
∆G° =-nFE°
∆G° =-2.303 RT log K
ஃ - nFEo = - 2.303 RT log K
ஃ Eocell = 0.4643 V
Eocell = Eooxid + Eored
ஃ Eored Eocell = Eooxid
= 0.4643 – (-0.34)
= 0.4643 + 0.34
Eored = 0.8043 V = 0. 80 V