மின்வேதிக் கலன் - மின்முனை மின்னழுத்தத்தை அளவிடல் | 12th Chemistry : UNIT 9 : Electro Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 9 : மின் வேதியியல்
மின்முனை மின்னழுத்தத்தை அளவிடல்
மின்முனை மின்னழுத்தத்தை அளவிடல்
ஒட்டு மொத்த ஆக்ஸிஜனேற்ற - ஒடுக்க வினையானது இரண்டு அரை வினைகளின் கூடுதலாக கருதப்படுகிறது. அதாவது, ஆக்ஸிஜனேற்றம் மற்றும் ஒடுக்கம். இதேபோல, மின்கலத்தின் emf மதிப்பும், எதிர்மின்முனை மற்றும் நேர்மின்முனைகளில் உள்ள மின்முனை மின்னழுத்தங்களின் கூடுதலாக கருதப்படுகிறது.
Ecell = (E ox ) anode + (Ered ) cathode .....(9.19)
இங்கு, (Eox)anode என்பது நேர்மின்முனையின் ஆக்ஸிஜனேற்ற மின்னழுத்தத்தையும், (Ered)cathode என்பது எதிர்மின்முனையின் ஒடுக்க மின்னழுத்தத்தை குறிப்பிடுகிறது. ஒரு தனித்த மின்முனையின் emf மதிப்பை கணக்கிடுதல் சாத்தியமற்றது. ஆனால், வோல்ட் மீட்டரை பயன்படுத்தி இரண்டு மின்முனைகளுக்கிடைப்பட்ட மின்னழுத்த வேறுபாட்டை (Ecell) நம்மால் அளவிட முடியும்.மின்கலத்திலுள்ள ஏதேனும் ஒரு மின்முனையின் emf மதிப்பு நமக்கு தெரிந்தால், அளவிடப்பட்ட மின்கல மின்னழுத்த (சமன்பாடு 9.19) மதிப்பைக் கொண்டு மற்றொரு மின்முனையின் emf மதிப்பை நம்மால் கணக்கிட முடியும். எனவே, emf மதிப்பு தெரிந்த ஒரு நோக்கீட்டு மின்முனை நமக்குத் தேவை.
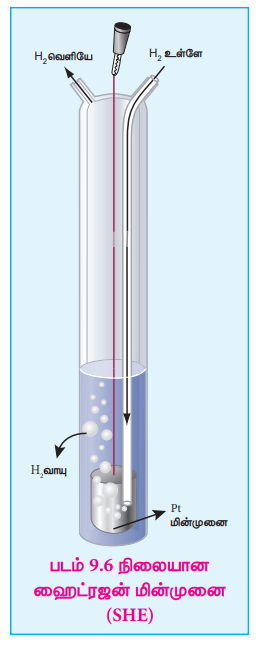
இந்த நோக்கத்திற்காக, திட்ட ஹைட்ரஜன் மின்முனையானது (SHE) நோக்கீட்டு மின்முனையாக (reference electrode) பயன்படுத்தப்படுகிறது. இதன் emf மதிப்பு தன்னிச்சையாக பூஜ்ஜியம் வோல்ட் என நிர்ணயிக்கப்பட்டது. இது, 1M HCl கரைசல் மற்றும் 1 atm ஹைட்ரஜன் வாயுவுடன் தொடர்பிலுள்ள பிளாட்டின மின்முனையை கொண்டுள்ளது. படம் 9.6 ல் காட்டியுள்ளவாறு 25oC வெப்பநிலையில் ஹைட்ரஜன் வாயுவானது கரைசலின் வழியே குமிழிகளாக செலுத்தப்படுகிறது. SHE எதிர்மின்முனையாகவும், நேர்மின்முனையாகவும் செயல்பட முடியும். அரைக் கலவினைகள் கீழே கொடுக்கப்பட்டுள்ளன.
SHE ஆனது எதிர்மின்வாயாக பயன்படுத்தப்பட்டால் நிகழும் ஒடுக்கம் வினை
2H+ (aq,1M)+2e– → H2 (g, 1 atm)
E° = 0 volt
SHE ஆனது நேர்மின்வாயாக பயன்படுத்தப்பட்டால் நிகழும் ஆக்ஸிஜனேற்ற வினை
H2 (g, 1 atm) → 2H+ (aq,1M)+2e– E° = 0 volt
விளக்கம்
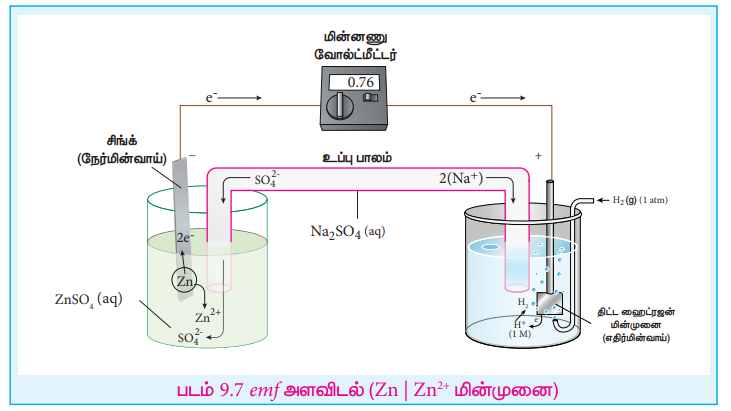
ஜிங்க் சல்பேட் கரைசலில் மூழ்கவைக்கப்பட்டுள்ள ஜிங்க் மின்முனையின் ஒடுக்க மின்னழுத்தத்தை SHE ஐ பயன்படுத்தி நாம் கணக்கிடுவோம்.
படி: 1 SHE ஐ பயன்படுத்தி பின்வரும் கால்வானிக் மின்கலம் கட்டமைக்கப்படுகிறது.
Zn (s) | Zn2+ (aq, 1M) || H+ (aq, 1M) | H2 (g, 1atm) | Pt (s)
படி: 2 மேலே குறிப்பிட்ட கால்வானிக் மின்கலத்தின் emf மதிப்பானது வோல்ட் மீட்டரை பயன்படுத்தி அளக்கப்படுகிறது. இந்த நேர்வில் மேற்காண் கால்வானிக் மின்கலத்தின் அளந்தறியப்பட்ட emf மதிப்பு 0.76V.
கணக்கீடு
நாமறிந்த படி,
Eocell = (E oxo) zn│Zn2+ + (Eo red) SHE [சமன்பாடு 9.19 லிருந்து]
Eocell = 0.76 and (Eo red) SHE = 0V . இந்த மதிப்புகளை மேலே உள்ள சமன்பாட்டில் பிரதியிட
⇒ 0.76 V= (Eo ஆக்ஸி) Zn | Zn2+ + 0
⇒ (Eo ஆகஸி) Zn | Zn2+ = 0.76 V
இந்த ஆக்ஸிஜனேற்ற மின்னழுத்தமானது கீழே குறிப்பிடப்பட்டுள்ள எதிர்மின்முனையில் நிகழும் அரைக்கல வினையுடன் தொடர்புடையதாகும்.
Zn → Zn2+ + 2e- (ஆக்ஸிஜனேற்றம்)
இதன் மறுதலை வினையில் emf மதிப்பானது ஒடுக்க மின்னழுத்தத்தை தருகிறது.
Zn2+ + 2e- → Zn; Eo = - 0.76V
∙ (Eo red) Zn2+│ Zn = - 0.76V
IUPAC வரையறை
மின்முனை மின்னழுத்தம் (E) திட்ட ஹைட்ரஜன் மின்முனையை இடதுபுற அரை மின்கலமாகவும், கொடுக்கப்பட்ட மின்முனையை வலதுபுற அரை மின்கலமாகவும் கொண்டுள்ள மின்கலத்தின் மின்னியக்குவிசை
திட்ட மின்முனை மின்னழுத்தம் E இடதுபுற அரை மின்கலத்தில் திட்ட அழுத்தநிலையில் மூலக்கூறு ஹைட்ரஜன் ஆக்ஸிஜனேற்றமடைந்து நீரேற்றம் பெற்ற புரோட்டான்களாக மாற்றமடையும் மின்கலத்தின் திட்ட emf.