Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ»єЯ«фЯ»ЇЯ«ф Я«ЄЯ«»Я«ЋЯ»ЇЯ«ЋЯ«хЯ«┐Я«»Я«▓Я»Ї | Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї - Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї | 12th Chemistry : UNIT 9 : Electro Chemistry
12 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«цЯ»ЇЯ«цЯ«┐Я«»Я«ЙЯ«»Я««Я»Ї 9 : Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї
Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї :
Я«еЯ«хЯ»ђЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«БЯ»Ђ Я«ЅЯ«▓Я«ЋЯ«┐Я«▓Я»Ї Я««Я«┐Я«ЕЯ»Ї Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ«ЕЯ»ЇЯ«▒Я«┐Я«»Я««Я»ѕЯ«»Я«ЙЯ«цЯ«хЯ»ѕЯ«ЋЯ«│Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ, Я«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ»ЄЯ«џЯ«┐Я«ЋЯ«│Я«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Li - Я«ЁЯ«»Я«ЕЯ«┐ Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї, Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«хЯ«┐Я«│Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«фЯ«џЯ»ѕЯ««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒Я«хЯ»ѕ Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»Ї Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї Я«еЯ«┐Я«▓Я»ѕЯ«»Я«ЙЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ІЯ«ЪЯ»ЇЯ«Ъ Я««Я»ѓЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«ЙЯ«Ћ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«еЯ«ЙЯ««Я»Ї Я«ЄЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»Ї Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я««Я»ЂЯ«цЯ«ЕЯ»ЇЯ««Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї (Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«» Я«ЄЯ«»Я«▓Я«ЙЯ«цЯ«хЯ»ѕ - non-rechargable) Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«цЯ»ЂЯ«БЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї (Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«» Я«ЄЯ«»Я«▓Я»ЂЯ«фЯ«хЯ»ѕ - rechargable) Я«јЯ«Е Я«ЄЯ«░Я»ЂЯ«хЯ«ЋЯ»ѕЯ«ЋЯ«│Я«ЙЯ«Ћ Я«хЯ«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«▓Я«ЙЯ««Я»Ї. Я«ЄЯ«еЯ»ЇЯ«ц Я«фЯ«ЙЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«»Я«┐Я«▓Я»Ї Я«џЯ«┐Я«▓ Я««Я«┐Я«ЕЯ»Ї Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»ѕЯ«фЯ»Ї Я«фЯ«▒Я»ЇЯ«▒Я«┐ Я«џЯ»ЂЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я«ЙЯ«Е Я«хЯ«┐Я«хЯ«ЙЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ»ІЯ««Я»Ї.
Я«▓Я»єЯ«ЋЯ»ЇЯ«▓Я«ЙЯ«ъЯ»ЇЯ«џЯ»Є Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : MnO2 Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЋЯ«┐Я«░Я«ЙЯ«ЃЯ«фЯ»ѕЯ«ЪЯ»Ї Я«цЯ«БЯ»ЇЯ«ЪЯ»Ђ
Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ : Я«еЯ»ђЯ«░Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я««Я»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЈЯ«▒Я«цЯ»ЇЯ«цЯ«ЙЯ«┤ 1.5V
Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї :
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї
Zn (s) Рєњ Zn2+ (aq) + 2e- ... (1)
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї
2 NH4+ (aq) + 2e- Рєњ 2NH3 (aq) + H2 (g) ... (2)
Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ MnO2 Я«хЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«еЯ»ђЯ«░Я«ЙЯ«Ћ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ
H2 (g) + 2 MnO2 (s) Рєњ Mn2O3 (s) + H2O (кќ) ... (3)
Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї (1) + (2) + (3) Я«љ Я«ЋЯ»ѓЯ«ЪЯ»ЇЯ«Ъ Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕ
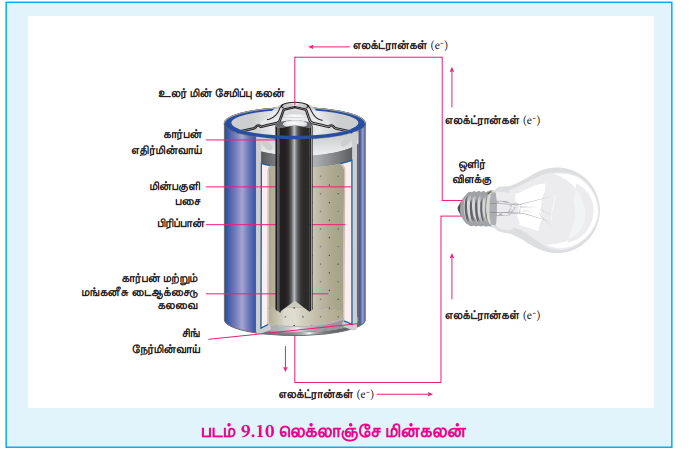
Zn (s) + 2NH4+ (aq) + 2 MnO2(s) Рєњ Zn2+ (aq) + Mn2O3 (s) + H2O (кќ)+2NH3 ...... (4)
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«ЙЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ Zn2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ [Zn (NH3)4]2+ (aq) Я«јЯ«ЕЯ»ЂЯ««Я»Ї Я«ЁЯ«БЯ»ѕЯ«хЯ»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«хЯ«┐Я«ЕЯ»ѕ Я«еЯ«┐Я«ЋЯ«┤, Я«еЯ«┐Я«ЋЯ«┤ NH4+ Я«ЁЯ«»Я«ЕЯ«┐Я«џЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Є Я«џЯ»єЯ«▓Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я«┐Я«» NH3 Я«ЁЯ«цЯ«┐Я«ЋЯ«░Я«┐Я«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Є Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ«┐Я«ЕЯ»Ї emf Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«фЯ«ЙЯ«цЯ«░Я«џ Я«фЯ«ЪЯ»ЇЯ«ЪЯ«ЕЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЋЯ«▓Я««Я»Ї
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : Я«фЯ«ЙЯ«цЯ«░Я«џЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«░Я«џЯ«ЋЯ»ЇЯ«ЋЯ«▓Я«хЯ»ѕЯ«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«юЯ«┐Я«ЎЯ»ЇЯ«ЋЯ»Ї
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : Я«ЋЯ«┐Я«░Я«ЙЯ«ЃЯ«фЯ»ѕЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЋЯ«▓Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ HgO
Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ : KOH Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї ZnO Я«ЋЯ«▓Я«еЯ»ЇЯ«ц Я«фЯ«џЯ»ѕ
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ : 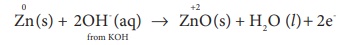
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ: 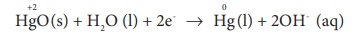
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕ : Zn (s) + HgO (s) Рєњ ZnO (s) + Hg (кќ)
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ emf : Я«ЈЯ«▒Я«цЯ»ЇЯ«цЯ«ЙЯ«┤ 1.35V.
Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї : Я«ЄЯ«цЯ»Ђ Я«ЁЯ«цЯ«┐Я«Ћ Я«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ»ђЯ«БЯ»ЇЯ«Ъ Я«єЯ«»Я»ЂЯ«│Я»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«фЯ»ЄЯ«ИЯ»ЇЯ««Я»ЄЯ«ЋЯ»ЇЯ«ЋЯ«░Я»Ї, Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«БЯ»Ђ Я«ЋЯ«ЪЯ«┐Я«ЋЯ«ЙЯ«░Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї, Я«ЋЯ»ЄЯ««Я«░Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
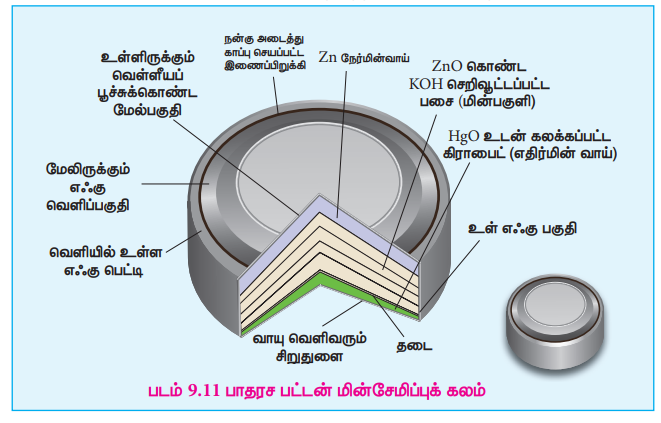
Я«цЯ»ЂЯ«БЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї:
Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«хЯ»ЄЯ«цЯ«┐ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»ѕ, Я«ЁЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«» emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«хЯ«┐Я«Ъ Я«џЯ«▒Я»ЇЯ«▒Я»Є Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«хЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ«цЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я«џЯ»ЇЯ«џЯ»єЯ«»Я»ЇЯ«»Я«▓Я«ЙЯ««Я»Ї Я«јЯ«Е Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ«░Я»Є Я«ЋЯ«▒Я»ЇЯ«▒Я«▒Я«┐Я«еЯ»ЇЯ«цЯ»ІЯ««Я»Ї. Я«ЄЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«цЯ»ЂЯ«БЯ»ѕЯ««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«▓Я»Ї, Я«єЯ«░Я««Я»ЇЯ«ф Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»ѕ Я««Я»ђЯ«│Я»ЂЯ«▒Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«Ћ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«▓Я»єЯ«ЪЯ»Ї Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»ѕ Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я«цЯ»ЂЯ«БЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я«еЯ«ЙЯ««Я»Ї Я«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї.
Я«▓Я»єЯ«ЪЯ»Ї Я«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЋЯ«▓Я«ЕЯ»Ї
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : Я««Я«┐Я«░Я»ЂЯ«цЯ»ЂЯ«хЯ«ЙЯ«Е Я«▓Я»єЯ«ЪЯ»Ї
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : PbO2 Я«фЯ»ѓЯ«џЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«▓Я»єЯ«ЪЯ»Ї Я«цЯ«ЋЯ«ЪЯ»Ђ
Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ : 38% Я«еЯ«┐Я«▒Я»ѕ Я«џЯ«цЯ«хЯ»ђЯ«цЯ««Я»ЂЯ«ЪЯ»ѕЯ«», 1.2g / mL Я«ЁЯ«ЪЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«┐ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ H2SO4-
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ
Pb(s) Рєњ Pb2+ (aq) + 2e- ......(1)
Pb2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї SO4-2 Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ PbSO4 Я«хЯ»ђЯ«┤Я»ЇЯ«фЯ«ЪЯ«┐Я«хЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Pb2+ (aq) + SO4-2 (aq) Рєњ PbSO4 (s) ......(2)
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ
PbO2 (s) + 4 H+ (aq) + 2eРђЊ Рєњ Pb2+ (aq) + 2H2O (кќ) ......(3)
Я«ЄЯ«еЯ»ЇЯ«ц Pb2+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї H2SO4 Я«ЄЯ«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ SO4-2 Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ PbSO4 Я«хЯ»ђЯ«┤Я»ЇЯ«фЯ«ЪЯ«┐Я«хЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Pb2+ (aq) + SO4-2 (aq) Рєњ PbSO4(s) ......(4)
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї
Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї (1) + (2) + (3) + (4)
Pb (s) + PbO2 (s) + 4H+ (aq) + 2 SO4-2 (aq) Рєњ 2 PbSO4 (s) + 2H2O (кќ)
Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«ЈЯ«▒Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«▒Я»ѕЯ«» 2V Я«хЯ«┤Я«ЋЯ»ЇЯ«ЋЯ««Я«ЙЯ«Ћ Я«єЯ«▒Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ»іЯ«ЪЯ«░Я»Ї Я«хЯ«░Я«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«БЯ»ѕЯ«цЯ»ЇЯ«цЯ»Ђ 12 Я«хЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї emf Я«єЯ«ЕЯ«цЯ»Ђ H2SO4 Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї SO4-2 Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«хЯ«┐Я«ЪЯ»ЂЯ«хЯ«цЯ«ЙЯ«▓Я»Ї H2SO4 Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я«ЈЯ«▒Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ«▒Я»ѕЯ«» 1.8V Я«єЯ«Ћ Я«ЋЯ»ЂЯ«▒Я»ѕЯ«»Я»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я«фЯ»ЇЯ«фЯ«Ъ Я«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ»ЂЯ««Я»Ї.
Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї (recharge) Я«џЯ»єЯ«»Я»ЇЯ«цЯ«▓Я»Ї
Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ«░Я»Ї Я«ЋЯ»ѓЯ«▒Я«┐Я«»Я«хЯ«ЙЯ«▒Я»Ђ, 2V Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┐Я«▒Я«ЋЯ»ЇЯ«Ћ (discharge) Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«еЯ»ЇЯ«ц Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я«цЯ«▒Я»ЇЯ«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ«цЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«»Я»ЂЯ««Я»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«фЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«цЯ«▓Я»ѕЯ«ЋЯ»ђЯ«┤Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї H2SO4 Я««Я»ђЯ«│Я»ЂЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ (Я«цЯ«▒Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ)
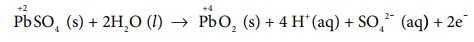
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ (Я«цЯ«▒Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ)
PbSO4 (s) + 2e- Рєњ Pb(s) + SO42- (aq)
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕ
2PbSO4 (s) + 2H2O (кќ) Рєњ Pb (s) + PbO2 (s) + 4H+ (aq) + 2 SO4-2 (aq) + 2e-
Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ, Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┐Я«▒Я«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«еЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ«цЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЂЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї.
Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї:
Я«цЯ«ЙЯ«ЕЯ«┐Я«»Я«ЎЯ»ЇЯ«ЋЯ«┐ Я««Я»ІЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«░Я»Ї Я«хЯ«ЙЯ«ЋЯ«ЕЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї, Я«ЄЯ«░Я«»Я«┐Я«▓Я»ЇЯ«ЋЯ«│Я»Ї, Я««Я«ЙЯ«▒Я»ЂЯ«цЯ«┐Я«џЯ»ѕЯ««Я«┐Я«ЕЯ»ЇЯ««Я«ЙЯ«▒Я»ЇЯ«▒Я«┐ Я«єЯ«ЋЯ«┐Я«»Я«хЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«▓Я«┐Я«цЯ»ЇЯ«цЯ«┐Я«»Я««Я»Ї - Я«ЁЯ«»Я«ЕЯ«┐ Я««Я«┐Я«ЕЯ»ЇЯ«џЯ»ЄЯ««Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ«▓Я«ЕЯ»Ї
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : Я«цЯ»ЂЯ«│Я»ѕЯ«ЋЯ«│Я»ЂЯ«ЪЯ»ѕЯ«» Я«ЋЯ«┐Я«░Я«ЙЯ«ЃЯ«фЯ»ѕЯ«ЪЯ»Ї
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ : CoO2 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЄЯ«ЪЯ»ѕЯ«еЯ«┐Я«▓Я»ѕ Я«ЅЯ«▓Я»ІЯ«Ћ Я«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»Ђ.
Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ : Я«ЋЯ«░Я«┐Я«« Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«еЯ»ЇЯ«ц Я«▓Я«┐Я«цЯ»ЇЯ«цЯ«┐Я«»Я««Я»Ї Я«ЅЯ«фЯ»ЇЯ«фЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ
Li (s) РђЊ Li+ (aq) + e-

Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ
Li+ + CoO2 (s) Рєњ e- Li CoO2 (s)
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї
Li (s) + CoO2 Рєњ Li CoO2 (s)
Я«ЄЯ«еЯ»ЇЯ«ц Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«цЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«│Я»ЇЯ«│Я»ЄЯ«»Я»ЂЯ««Я»Ї Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«»Я»ЂЯ««Я»Ї Я«џЯ»єЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«хЯ«░ Li+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»ѕ Я«ЁЯ«ЕЯ»ЂЯ««Я«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┐Я«▒Я«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Li+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЋЯ«░Я«┐Я«« Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ Я«хЯ«┤Я«┐Я«»Я«ЙЯ«Ћ Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐ Я«еЯ«ЋЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ emf Я«љЯ«хЯ«┐Я«Ъ Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Е Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ, Я««Я«┐Я«ЕЯ»Ї Я««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«ЋЯ«▓Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ«цЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЄЯ«фЯ»ЇЯ«фЯ»ІЯ«цЯ»Ђ Li+ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я«еЯ»ІЯ«ЋЯ»ЇЯ«ЋЯ«┐ Я«еЯ«ЋЯ«░Я»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е, Я«ЁЯ«ЎЯ»ЇЯ«ЋЯ»Ђ Я«ЁЯ«хЯ»ѕ Я«еЯ»ЂЯ«БЯ»ЇЯ«цЯ»ЂЯ«│Я»ѕЯ«ЋЯ«│Я»ЂЯ«ЪЯ»ѕЯ«» Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»Ї Я««Я»ђЯ«цЯ»Ђ Я«џЯ»єЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«фЯ«ЪЯ«┐Я«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«еЯ»ЇЯ«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«џЯ»ЇЯ«џЯ«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«іЯ«ЪЯ»ЂЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«▓Я»Ї (intercalation) Я«јЯ«Е Я«ЁЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї :
Я«ЄЯ«хЯ»ѕ Я«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ»ЄЯ«џЯ«┐, Я««Я«ЪЯ«┐Я«ЋЯ«БЯ«┐Я«ЕЯ«┐, Я«ЋЯ«БЯ«┐Я«ЕЯ«┐Я«ЋЯ«│Я»Ї, Я«ЋЯ»ЄЯ««Я«░Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я»ІЯ«ЕЯ»ЇЯ«▒Я«хЯ«▒Я»ЇЯ«▒Я«┐Я«▓Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї :
Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»ѕ Я«јЯ«░Я«┐Я«фЯ»ЇЯ«фЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«▒Я«▓Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ«┐Я«» Я«ЋЯ«ЙЯ«▓Я»ЇЯ«хЯ«ЙЯ«ЕЯ«┐Я«ЋЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я»Ї Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ»Ђ Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«хЯ»ЄЯ«▓Я»ѕ Я«џЯ»єЯ«»Я»ЇЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ, Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«Ъ Я«хЯ»ЄЯ«БЯ»ЇЯ«ЪЯ»ЂЯ««Я»Ї. Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ, Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я««Я«ЙЯ«ЕЯ«цЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї РћѓЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕРћѓ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐ РћѓЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ РћѓЯ«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐
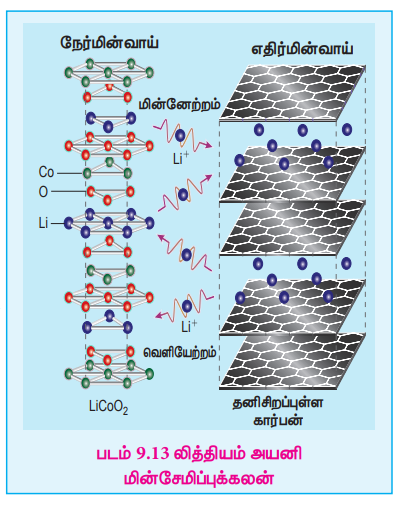
Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї - Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я«еЯ«ЙЯ««Я»Ї Я«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«хЯ»ІЯ««Я»Ї. Я«ЄЯ«еЯ»ЇЯ«ц Я«еЯ»ЄЯ«░Я»ЇЯ«хЯ«┐Я«▓Я»Ї, Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї, Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«»Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї, 200┬░C Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї 20 РђЊ 40 atm Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«фЯ«░Я«ЙЯ««Я«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц KOH Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Ni Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї NiO Я«єЯ«ЋЯ«┐Я«»Я«хЯ«▒Я»ЇЯ«▒Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«еЯ»ЂЯ«БЯ»ЇЯ«цЯ»ЂЯ«│Я»ѕЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«» Я«ЋЯ«┐Я«░Я«ЙЯ«ЃЯ«фЯ»ѕЯ«ЪЯ»Ї Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ЂЯ«▒Я«Й Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЋЯ»ЂЯ««Я«┐Я«┤Я«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ:
2H2(g) + 4 OH- (aq) Рєњ 4 H2O (кќ) + 4e-
Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ O2(g) + 2 H2O (l) + 4e- 4 OH- (aq)
Я«њЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ««Я»іЯ«цЯ»ЇЯ«ц Я«хЯ«┐Я«ЕЯ»ѕ 2H2 (g) + O2 (g) Рєњ 2H2O (l)
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«БЯ»ЇЯ«Ъ Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я«јЯ«░Я«┐Я«цЯ«▓Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я»ѕ Я«њЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«јЯ«ЕЯ«┐Я«ЕЯ»ЂЯ««Я»Ї, Я«ЁЯ«хЯ»ѕ Я«еЯ»ЄЯ«░Я«ЪЯ«┐Я«»Я«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«хЯ«цЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ, Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я»Ї Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є Я«еЯ»ЄЯ«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«јЯ«цЯ«┐Я«░Я»ЇЯ««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«цЯ«ЕЯ«┐Я«»Я«ЙЯ«Ћ Я«еЯ«┐Я«ЋЯ«┤Я»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. H2-O2 Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«ЋЯ«▓Я«цЯ»ЇЯ«цЯ»ѕЯ«фЯ»Ї Я«фЯ»ІЯ«▓Я«хЯ»Є Я«фЯ»ЂЯ«░Я«фЯ»ЇЯ«фЯ»ЄЯ«ЕЯ»Ї -O2Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я»ђЯ«цЯ»ЇЯ«цЯ»ЄЯ«ЕЯ»Ї -O2, Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.