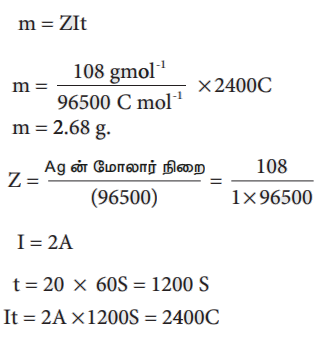கேள்வி பதில்கள், தீர்வுகள் | மின் வேதியியல் - எண்ணியல் கணக்குகள் | 12th Chemistry : UNIT 9 : Electro Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 9 : மின் வேதியியல்
எண்ணியல் கணக்குகள்
புத்தகவினாக்கள்
8. 298K வெப்பநிலையில் 0.01M செறிவு கொண்ட 1:1 வலிமை குறைந்த மின்பகுளி கரைசலின் கடத்துத்திறன் மதிப்பு 1.5 × 10-4 Scm-1 எனில்,
i) கரைசலின் மோலார் கடத்துத்திறன்
ii) வலிமை குறைந்த மின்பகுளியின் பிரிகை வீதம் மற்றும் பிரிகை மாறிலி ஆகியவற்றை கணக்கிடுக.
குறிப்பு : நேரயனி = 248.2 S cm2 mol-1; எதிரயனி = 51.8 S cm2 mol-1
K = 1.5 × 10-4Scm-1
= 1.5 × 10-4s (10-2m)-1
=1.5 × 10-4 × 10-2 Sm-1
M = 0.01 M = 1.5 × 10-2 Sm-1
Ʌom = [ k ×10−3 / M ] = (1.5 × l0-2 × l0−3 / 0.01 )
= 1.5 × 10−3 15 × 10−4 S m2 mol−1
1 Ʌ = Ʌ° நேரயனி + Ʌ° எதிரயனி = 248.2 + 51.8
= 300 S cm2 mol−1
= 300 S(10-2 m)2 mol−1
= 300 × 10−4 S m2 mol−1
α = Ʌom / Ʌo∞ = (1.5 × 10−4 ) / (300 × 10-4 )
= 0.05
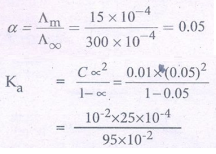
= 02.6 × 10−4
= 2.6 × 10−5
13. 1.608A அளவுள்ள மின்னோட்டமானது 250 mL. கன அளவுள்ள 0.5M காப்பர் சல்பேட் கரைசல் வழியே 50 நிமிடங்களுக்கு செலுத்தப்படுகிறது. கன அளவு மாறாமல் உள்ளது எனவும் மின்திறன் 100% எனவும் கருதி மின்னாற்பகுத்தல் முடிந்த பிறகு மீதமுள்ள கரைசலில் Cu2+ அயனிச் செறிவை கணக்கிடுக.
கொடுக்கப்பட்டது,
I = 1.608 A; t = 50 நிமிடங்க ள் = 50 × 60
= 3000S V = 250 mL
n = 100% C = 0.5M
CuSO4 கரைசலில் செலுத்தப்படும் பாரடேக்களின் எண்ணிக்கையை கணக்கிடுதல்
⇒ Q = It
Q = 1.608 × 3000
Q = 4824C
ஃமின்னோட்டத்திலுள்ள பாரடேக்களின்
எண்ணிக்கை = (4824 C / 96500) = 0.05F
CusO4 ஐ மின்னாற்பகுத்தல்
Cu2+ (aq) + 2e- → Cu(s)
மேற்கண்ட சமன்பாட்டிலிருந்து 2F மின்னோட்டத்தினால் 1 மோல் Cu2+ வீழ்படிவு உருவாகும் ஃ 0.05 F மின்னோட்டத்தினால் உருவாகும்
வீழ்படிவு ( 1 mol / 2F ) × 0.5 F
= 0.025 mol
250 ml கரைசலிலுள்ள Cu2+ அயனிகளின் ஆரம்பமோல்களின் எண்ணிக்கை
( 0.1 / 250 mL ) × 1000 mL
= 0.125 mol
ஃ Cu2+ ல் மின்னாற்பகுப்பின் பின் உள்ள மோல் களின் எண்ணிக்கை = 0.125 - 0.025 = 0.1 mol
0.5 ஃCu2+ ன் செறிவு = (0.5 / 1000 mL ) × 250 mL = 0.4M
14. Fe3+ அயனிகள் திட்ட நிலைமைகளில் புரோமைடை புரோமினாக ஆக்ஸிஜனேற்றம் அடையச் செய்யுமா?
கொடுக்கப்பட்டது :
EFe 3+|Fe2+ = 0.771
தேவையான அரைமின்கல வினை
(Eoox) = - 1. 09 V
(Eored) = + 0. 771 V
(Eocell) = ?
2Br → Br2 + 2e-
2Fe3+ + 2e- → 2Fe2+
2Fe3+ + 2Br → 2Fe2+ + Br2
Eoமின்கலம் = (Eoஆக்சி) + (Eoஒடுக்)
= - 1.09 + 0.771 = - 0.319V
Eoமின்கலம் எதிர்குறியுடையது
∆G நேர்க் குறியுடையது மற்றும் மின்கலவினை தன்னிச்சையானது அல்ல. எனவே Fe3+ ஆனது Br-ஐ Br2, ஆக ஆக்சிஜனேற்றம் அடையச் செய்ய இயலாது.
15. நீண்ட காலத்திற்கு காப்பர் சல்பேட்டை இரும்புக் கலனில் சேமித்து வைக்க இயலுமா?
கொடுக்கப்பட்டது:
ECu 2+|Cu = 0.34 V and E°Fe 2+|Fe = −0.44V
(E°ox)Fe | Fe2+ = 0.44V and (E°red)Cu2+ | Cu = 0.34V
இரும்பானது ஆக்சிஜனேற்றமடையும் மற்றும் காப்பர் ஒடுக்கமடையும் என்பதை இத்தகைய நேர்குறிக்கொண்ட மின்கல அழுத்த மதிப்புகள் குறிக்கின்றன.
• அதாவது கலனானது கரையும் எனவே இரும்பு கலனினுள் காப்பர் சல்பேட் கரைசலை சேகரித்து வைக்க முடியாது.
16. M1 மற்றும் M2 ஆகிய உலோகங்களின் ஒடுக்க மின்னழுத்தங்கள் முறையே -XV மற்றும் +yV எது லிருந்து H2 வாயுவை ஐ விடுவிக்கும்?
அதிக ஆக்சிஜனேற்ற மின் அழுத்தம் கொண்ட உலோகங்கள் H2SO4ல் இருந்து வெளியிடும். எனவே +XV என்ற ஆக்சிஜனேற்ற மின்னழுத்தம் கொண்ட M1 என்ற உலோகம் H2 ஐ H2 SO4 ல் இருந்து விடுவிக்கும்.
17. M1 மற்றும் M2 ஆகிய இரண்டு உலோகங்களின் ஒடுக்க மின்னழுத்தங்கள் முறையே
EºM12+|M1 = − 2.3V மற்றும் E EºM22+|M2 = 0.2V
இவை இரண்டில் எந்த ஒன்று இரும்பின் புறப்பரப்பின் மீது பூசுவதற்கு சிறந்தது?
கொடுக்கப்பட்டுள்ளது:
E Fe2+ |Fe = −0.44V
M1 ஆக்சிஜனேற்ற மின்னழுத்தம் Fe விட அதிக நேர் குறி உடையது. எனவே இது இரும்பினை துருப்பிடித்தலிருந்து பாதுகாக்கும் என்பதை குறிக்கிறது.
18. Cd|cd2+||Cu2+|Cu எனும் மின்கலத்தின் திட்ட emf ஐ கணக்கிடுக. Cu2+|Cu மற்றும் Cd2+| Cd ஆகியவற்றின் திட்ட ஒடுக்க மின்னழுத்த மதிப்புகள் முறையே 0.34 V மற்றும் - 0.40 V. கலவினைவின் நிகழும் தன்மையினை கண்டறிக.
மின்கல வினைகள் :
நேர்மின்வாயில் ஆக்சிஜனேற்றம் :
Cd (s) → Cd2+ (aq) + 2e- (Eoஆக்சி)CdCd2+ = 0.4V
எதிர்மின்வாயில் ஒடுக்கம் :
Cu2+(aq) + 2e− → Cu(s)
(E°ஒடுக்) Cu2+ | Cu= 0.34V

= 0.4 + 0.34
= 0.74V
இயக்க மின்கல அழுத்தம் நேர்க்குறி உடையது. எனவே ∆G எதிர்குறியைப் பெறுகிறது. அதனால் வினை சாத்தியமான ஒன்றாகின்றது.
19. எரிபொருள் மின்கலத்தில் H2 மற்றும் O2, வினை புரிந்து மின்னோட்டத்தை உருவாக்கு கின்றன. இந்த செயல் முறையில், H2 வாயு நேர்மின் முனையில் ஆக்ஸிஜனேற்ற மடைகிறது. எதிர்மின் முனையில் O2 ஒடுக்கமடைகிறது. 25°C வெப்ப நிலை மற்றும் 1 atm அழுத்தத்தில் 44.8 லிட்டர் H2 வாயு 10 நிமிடங்களுக்கு செலுத்தப் படுகிறது. உருவாக்கப்பட்ட சராசரி மின்னோட்ட அளவு யாது? மொத்த மின்னோட்டத் தையும் Cu2+ லிருந்து Cu ஐ மின்வீழ்படி வாக்கலுக்கு பயன்படுத் தினால், எவ்வளவு கிராம் காப்பர் வீழ்படிவாகும்?
நேர் மின்வாயில் ஆக்சிஜனேற்றம்
2H2 (g) + 4OH- (aq) → 4H2O (1) + 4eO(l)+ 4e-
1atm அழுத்தத்தில் ஒரு மோல் ஹைட்ரஜன் வாயு பெற்றுள்ள கன அளவு 22.4 லிட்டர்
ஃ உருவாகும் ஹைட்ரஜன் வாயுவின் மோல்களின்
எண்ணிக்கை = (1 மோல் / 22/4 L) × 44.8L
ஃ எனவே 2 மோல் ஹைட்ரஜன் வாயு 4 மோல். அதாவது 4F மின்சுமையை உருவாக்கும். Q = It என நாம் அறிவோம்
I = Q / t
= 4F/ 10 நிமிடங்கள்
= (4 × 96500 C) / (10 × 60s )
I = 643.33A
காப்பரில் மின்படிதல்
Cu2+ (aq) + 2e- → Cu (s)
படிதலுக்கு தேவைப்படும் மின்சுமை 2F ஆகம். ஒரு மோல் காப்பர் i.e., 63.5g
மொத்த மின்னோட்டமும் எரிமின்கலமியக்க பயன்படுத்தப்பட்டால் அதாவது 4F வும் மின்னாற்பகுத்தலுக்கு பயன்படுத்தப்பட்டால் 2 × 63.5 அதாவது 127.0 g காப்பர் எதிர்மின் வாயில் படியும்.
20. முறையே நிக்கல் நைட்ரேட் மற்றும் குரோமியம் நைட்ரேட் கரைசல்களை கொண்டுள்ள இரண்டு தனித்தனி மின்னாற்பகுப்புக் கலன்களில் ஒரே அளவுள்ள மின்னோட்டம் செலுத்தப்படுகிறது. முதல் மின்கலத்தில் 2.935 கிராம் Ni வீழ்படி வாகிறது எனில் மற்றொரு மின்கலத்தில் வீழ்படி வாகும் குரோமியத்தின் அளவு என்ன?
கொடுக்கப்பட்டுள்ளது : நிக்கல் மற்றும் குரோமி யத்தின் மோலார் நிறைகள் முறையே 58.74 மற்றும் 52 கிராம் மோல்-1
mNi = 2.935 கி mCr +?
eNi2+ = அணுநிறை / இணைதிறன் = 58.74 / 2 = 29.37
eCr3+ = அணுநிறை / இணைதிறன் = 52 / 3 = 17.33
பாரடேயின் இரண்டாம் விதிப்படி mCr / mNi = eCr3+ / eNi2+
ஃ mCr = eCr3+ / eNi2+ . mNi = 17.33 × 2.935 / 29.37
= 1.732g
21. 25°C வெப்பநிலையிலுள்ள 0.1 M காப்பர் சல்பேட் கரைசலில் காப்பர் மின்முனை மூழ்க வைக்கப் பட்டுள்ளது. காப்பரின் மின்முனை மின்னழுத்தத்தை கணக்கிடுக.
(குறிப்பு : E°Cu2+ ∣ Cu = 0.34)
கொடுக்கப்பட்டது
[Cu2+] = 0.1M ;
E°Cu2+ ∣ Cu = 0.34
Ecell = ?
கலவினை
Cu2+ (aq) + 2e− → Cu(s)
Ecell = E°cell – { 0.0591/n log ([Cu] / [Cu2+]) }
= 0.34 – {(0.0591/2) log (1/0.1)}
= 0.34 – 0.0296
Ecell = 0.31 V
22. Mg (s)|Mg2+ (aq) || Ag+ (aq) | Ag(s), எனும் மின்கலத்திற்கு, 25°C வெப்பநிலையில், சமநிலை மாறிலி மற்றும் மின்கலம் செயல்படும்போது அதிலிருந்து கிடைக்கப்பெறும் அதிகபட்ச வேலையை கணக்கிடுக.
குறிப்பு :
Eº Mg 2+ | Mg = −2.37V மற்றும் EºAg2 + | Ag = 0.80V.
நேர் மின்முனையில் ஆக்சிஜனேற்றம்
Mg → Mg2+ + 2e- -----(1) (Eoஆக்ஸி) = 2. 37 V
எதிர் மின்முனையில் ஒடுக்கம்
Ag+ + e- → Ag ----(2) (Eo ஒடுக்கம்) = 0.80 V
Eoமின்கலம் = (Eoஆக்ஸி) நேர்மின்வாய் (Eo ஒடுக்கம்)எதிர்மின்வாய்
= 2.37 + 0.80
= 3.17 V
ஒட்டு மொத்த வினை
சமன்பாடு (1) + 2 × சமன்பாடு (2) P
Mg + 2Ag+→ Mg2+ + 2Ag
ΔG° = -nFE°
= -2 × 96500 × 3.17
= -611810 J
ΔG°= -6.12 × 105J
W = 6.12 × 105J
ΔG° = -2.303 RT log Kc
⇒logK c = (6.12 × 105 ) / (2.303 × 8.314 × 298)
Kc = Antilog of (107.2)
Kc = 1.5849
23. ஒரு ஏரியில் 8.2 × 1012 லிட்டர் நீர் நிரம்பியுள்ளது. ஒரு திறன் அணு உலையானது தகுந்த மின்னழுத் தத்தில் ஏரியிலுள்ள நீரை மின்னாற் பகுத்து 2 × 106 Cs-1 வேகத்தில் மின்சாரத்தை உற்பத்தி செய்கிறது. ஏரியிலுள்ள நீர்முழுவதும் மின்னாற் பகுத்தலுக்கு உட்பட எவ்வளவு வருடங்களாகும்? மின்னாற்பகுத்தலைத் தவிர வேறெந்த வகையிலும் நீர் இழக்கப்படவில்லை என கருதுக.
நீரைநீராற்பகுத்தல்
நேர்மின்வாயில் வினை
2H2O → 4H+ + O2 + 4e- .............. (1)
எதிர்மின்வாயில் வினை
2H2O + 2e-→ H2 + 2OH-
ஒட்டுமொத்த வினை
6H2O → 4H+ + 4OH- + 2H2 + O2
அல்லது
சமன்பாடு (1) + (2) × 2 ⇒ 2H2O → 2H2 + O2
பாரடேயின் முன்னாற்பகுத்தல் விதியின்படி இரு மோல் நீரை மின்னாற்பகுக்க உருவாகும் மின் சுமை (36g ≈ 36 mL of H2O),36ml நீரை மின்னாற்பகுக்க 4F மின்சுமை தேவைப்படும் = 4 × 96500 C ஏரியிலிருந்து பெறக்கூடிய மொத்த நீரையும் மின்னாற் பகுத்தலால் வெளியிடப்படுவது
= [ 4 × 96500C / 36 × 10−3L ] × 9 × 1012 L
= [ (4 × 96500 × 9 × 1012) / (36 × 10−3)] × C
= 96500 × 1015
1 வினாடியில் 2 × 106 C மின்சாரம் உருவாகிறது.
ஃ 96500 × 15C மின்சாரம் உருவாக தேவைப்படும் நேரம்.
[ 1S / 2×106C ] × 96500 × 1015 C
= 48250 × 109s
வருடங்களின் எண்ணிக்கை = [ 48250 × l0 9 ] / [365 × 24 × 60 × 60]
= 1.5299 × 106 வருடம்
எடுத்துக்காட்டு
ஒரு மின்கடத்துக் கலனிலுள்ள இரண்டு பிளாட்டின மின்முனைகளுக்கு இடைப்பட்ட தூரம் 1.5 செ.மீ. ஒவ்வொரு மின்முனையும் குறுக்குப் பரப்பும் 4.5 ச.செ.மீ என்க. 0.5 N மின்பகுளிக் கரைசலுக்கு மின்கலத்தை பயன்படுத்தி கண்டறியப்பட்ட மின்தடை மதிப்பு 15 Ω எனில், கரைசலின் நியம கடத்துத்திறன் மதிப்பை காண்க.
தீர்வு
K = 1/R (Ɩ/A)
K = 1/15Ω × 1.5 × 10-2m / 4.5 × 10-4 m2
= 2.22 Sm-1
Ɩ = 1.5 cm = 1.5 × 10-2m
A = 4.5 cm2 = 4.5× (10-4) m2
R = 15Ω
எடுத்துக்காட்டு
25oC. வெப்பநிலையில் 0.025M செறிவுடைய நீர்த்த கால்சியம் குளோரைடு கரைசலின் மோலார் கடத்துத்திறனை கணக்கிடுக. கால்சியம் குளோரைடு கரைசலின் நியம கடத்துத்திறன் மதிப்பு 12.04 × 10-2 Sm-1
மோலார் கடத்துத்திறன் = Am = K (Sm-1) × 10-3 / (M) mol-1-m3
(12.04 × 10-2 Sm-1 ) × 10-3 (mol-1m3 ) / 0.025
481.6 × 10-5 Sm2mol-1
எடுத்துக்காட்டு
0.1M KCl கரைசலை பயன்படுத்தி கண்டறியப்பட்ட மின்கடத்து கலனின் மின்தடை 190Ω (0.1M KCl கரைசலின் நியம் கடத்துத்திறன் மதிப்பு 1.3 Sm-1 ). அதே கலனில் 0.003M செறிவுள்ள சோடியம் குளோரைடு கரைசலை நிரப்பும் போது, அளவிடப்பட்ட மின்தடை மதிப்பு 6.3KΩ. இவை இரண்டும் ஒரே குறிப்பிட்ட வெப்பநிலையில் கண்டறியப்பட்ட அளவீடுகளாகும். NaCl கரைசலின் நியம் மற்றும் மோலார் கடத்துத்திறன் மதிப்புகளை கணக்கிடுக.
கொடுக்கப்பட்டது
K = 1.3 Sm-1 (0.1M KCl கரைசலுக்கு )
R = 190Ω
(Ɩ/A) =K . R = (1.3 Sm-1) (190Ω)
= 247 m-1
K(NaCl) = 1/R(NaCl) (l /A)
= 1 / 6.3K Ω (247 m-1) 6.3K Ω = 6.3 × 10-3 Ω
= 39.2 × 10-3 Sm-1
Ʌm = K × 10-3 mol-1 m3 / M
= 39.2 × 10-3 (Sm-1 ) × 10-3( mol-1 m3) / 0.003

Ʌm = 13.04 × 10-3 Sm-2 mol-1
எடுத்துக்காட்டு
2 ஆம்பியர் மின்னோட்டத்தைக் கொண்டு, சில்வர் நைட்ரேட் கரைசலானது 20 நிமிடங்களுக்கு மின்னாற்பகுக்கப்படுகிறது எனில், எதிர்மின்முனையில் வீழ்படிவாகும் சில்வரின் நிறையை கணக்கிடுக.
எதிர்மின்முனையில் நிகழும் மின்வேதி வினை Ag+ +e- → Ag (ஒடுக்கம்)
m = Zlt
m = (108 gmol-1 / 96500 C mol-1 ) × 2400C
m = 2.68 g.
Z = Ag ன் மோலார் நிறை / (96500) =108/1 × 96500
I = 2A
t = 20 × 60S = 1200 S
It = 2A × 1200S = 2400C