Я«џЯ»єЯ«▒Я«┐Я«хЯ»ЂЯ«хЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ«┐Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«ЙЯ«▒Я»ЇЯ«▒Я««Я»Ї | Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї - Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«»Я«┐Я«ЕЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї | 12th Chemistry : UNIT 9 : Electro Chemistry
12 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«цЯ»ЇЯ«цЯ«┐Я«»Я«ЙЯ«»Я««Я»Ї 9 : Я««Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї
Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«»Я«┐Я«ЕЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐
Я«хЯ«░Я««Я»ЇЯ«фЯ»ЂЯ«еЯ«┐Я«▓Я»ѕ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї ╔Ёom Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«ЙЯ«Ћ Я«хЯ«┐Я«│Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«│Я«хЯ«┐Я«▓Я«Й Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї, Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я«хЯ«░Я««Я»ЇЯ«фЯ»ЂЯ«еЯ«┐Я«▓Я»ѕ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«цЯ»Ђ, Я«ЁЯ«цЯ«ЕЯ»Ї Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ«░Я««Я»ЇЯ«фЯ»ЂЯ«еЯ«┐Я«▓Я»ѕ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»ЂЯ«цЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«џЯ««Я««Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЁЯ«цЯ«ЙЯ«хЯ«цЯ»Ђ Я«еЯ»ЄЯ«░Я«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«њЯ«░Я»Ђ Я«цЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»ЂЯ««Я»Ї, Я«јЯ«цЯ«┐Я«░Я«»Я«ЕЯ«┐Я«ЋЯ«│Я»Ї Я«ЁЯ«цЯ«▒Я»ЇЯ«ЋЯ»Ђ Я«јЯ«цЯ«┐Я«░Я»ЇЯ«цЯ«┐Я«џЯ»ѕЯ«»Я«┐Я«▓Я»ЂЯ««Я»Ї Я«њЯ«ЕЯ»ЇЯ«▒Я»ѕЯ«»Я»іЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«џЯ«ЙЯ«░Я«ЙЯ««Я«▓Я»Ї Я«еЯ«ЋЯ«░Я»ЇЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЋЯ«┐Я«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
NaCl Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«њЯ«▒Я»ЇЯ«▒Я»ѕ - Я«њЯ«▒Я»ЇЯ«▒Я»ѕ Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
(╔Ёom) Nacl = (╬╗om) Na+ (╬╗om) Cl-
Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ, Я«ЁЯ«│Я«хЯ«┐Я«▓Я«Й Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї AxBy Я«јЯ«ЕЯ»ЂЯ««Я»Ї Я«хЯ«ЙЯ«»Я»ЇЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»ѕ Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ«┐ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я«јЯ«┤Я»ЂЯ«цЯ«▓Я«ЙЯ««Я»Ї.
(╔Ёom) AxBy = x (╬╗om) Ay+ + y (╬╗om) gx- ...... (9.13)
Я«џЯ»ІЯ«цЯ«ЕЯ»ѕ Я««Я»ЂЯ«ЪЯ«┐Я«хЯ»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«» Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ»ѕ Я«хЯ«░Я»ЂЯ«хЯ«┐Я«цЯ»ЇЯ«цЯ«ЙЯ«░Я»Ї. Я«ЁЯ«цЯ»ЇЯ«цЯ«ЋЯ»ѕЯ«» Я«њЯ«░Я»Ђ Я«џЯ»ІЯ«цЯ«ЕЯ»ѕ Я««Я»ЂЯ«ЪЯ«┐Я«хЯ»Ђ Я«ЁЯ«ЪЯ»ЇЯ«ЪЯ«хЯ«БЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
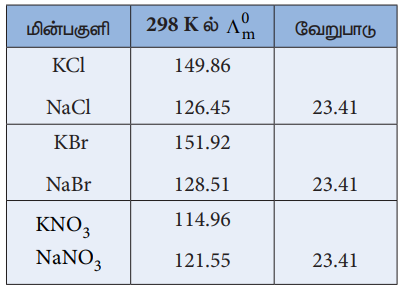
Я«ЁЯ«│Я«хЯ«┐Я«▓Я«Й Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я«њЯ«хЯ»ЇЯ«хЯ»іЯ«░Я»Ђ Я«фЯ«ЋЯ»ЂЯ«цЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«»Я»ЂЯ««Я»Ї Я«ЅЯ«ЪЯ«ЕЯ««Я»ѕЯ«еЯ»ЇЯ«ц Я««Я«▒Я»ЇЯ«▒ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ѕ Я«џЯ«ЙЯ«░Я«ЙЯ««Я«▓Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«еЯ«┐Я«ЋЯ«░ Я«фЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«ЁЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«БЯ»Ї Я««Я»ЂЯ«ЪЯ«┐Я«хЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
(╔Ёom) KCl- (╔Ёom) Nacl = 149.86 - 126.45
{(╬╗om) K+ + (╬╗om) Cl-} РђЊ {(╬╗om) Na + +(╬╗om) Cl- } = 23.41
(╬╗om) K+ - (╬╗om) Na+ = 23.41
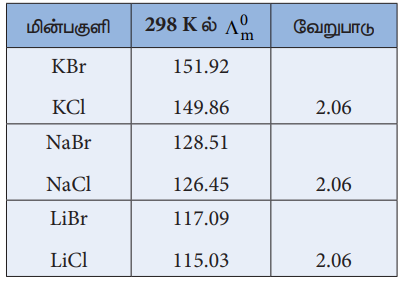
Я«ЄЯ«цЯ»Є Я«фЯ»ІЯ«▓ (╬╗om) Br- - (╬╗om) Cl- = 2.06 Я«јЯ«Е Я«цЯ»ђЯ«░Я»ЇЯ««Я«ЙЯ«ЕЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«▓Я«ЙЯ««Я»Ї
Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«»Я«┐Я«ЕЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї
1. Я«ЁЯ«│Я«хЯ«┐Я«▓Я«Й Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї Я«хЯ«▓Я«┐Я««Я»ѕЯ«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«▓Я»Ї.
Я«ЁЯ«│Я«хЯ«┐Я«▓Я«Й Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї Я«њЯ«░Я»Ђ Я«хЯ«▓Я«┐Я««Я»ѕЯ«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»ѕ Я«џЯ»ІЯ«цЯ«ЕЯ»ѕ Я««Я»ѓЯ«▓Я««Я»Ї Я«еЯ«┐Я«░Я»ЇЯ«БЯ«»Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«џЯ«ЙЯ«цЯ»ЇЯ«цЯ«┐Я«»Я««Я»Є Я«ЄЯ«▓Я»ЇЯ«▓Я«ЙЯ«ц Я«њЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«┐Я«ЕЯ»ЂЯ««Я»Ї, Я«ЁЯ«цЯ»Є Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«ЋЯ»ІЯ«▓Я»ЇЯ«░Я«ЙЯ«иЯ»Ї Я«хЯ«┐Я«цЯ«┐Я«»Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ, HCl, NaCl Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї CH3COONa Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«хЯ«▓Я«┐Я««Я»ѕЯ««Я«┐Я«ЋЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«џЯ»ІЯ«цЯ«ЕЯ»ѕ Я««Я»ѓЯ«▓Я««Я»Ї Я«ЋЯ«БЯ»ЇЯ«ЪЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ CH3COOH Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
╔Ёo CH3COONa = ╬╗ Na+ + ╬╗o CH3COOH- ----- (1)
╔Ёo HCl = ╬╗0H+ + ╬╗o cl- --------- (2)
╔Ёo Nacl = ╬╗o Na+ + + ╬╗o cl- --------- (3)
Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ (1) + Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ (2) - Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ (3) Я«ЋЯ»іЯ«ЪЯ»ЂЯ«фЯ»ЇЯ«фЯ«цЯ»Ђ,
(╔Ёo CH3COONa ) + (╔Ёo HCl ) РђЊ ( ╔Ёo Nacl ) = ╬╗0H+ + ╬╗0CH3COOH
= ╔Ёo CH3COOH
2. Я«хЯ«▓Я«┐Я««Я»ѕЯ«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я«хЯ»ђЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«▓Я»Ї
Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ»ЇЯ«Ъ Я«џЯ»єЯ«▒Я«┐Я«хЯ«┐Я«▓Я»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«▓Я«Й Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я«┐Я«▓Я»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«єЯ«ЋЯ«┐Я«» Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«хЯ«▓Я«┐Я««Я»ѕЯ«ЋЯ»ЂЯ«▒Я»ѕЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я«хЯ»ђЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
╬▒ = ╔Ёm / ╔Ё0m ......(9.14)
╔Ёm Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я««Я«ЙЯ«▒Я«┐Я«▓Я«┐Я«»Я»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«▓Я»Ї. Я«єЯ«ИЯ»ЇЯ«хЯ«ЙЯ«▓Я»ЇЯ«ЪЯ»Ї Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ«▓Я»Ї Я«хЯ«┐Я«цЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ«┐,
Ka = ╬▒2C / (1-╬▒) ......(9.15)
Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«БЯ»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»Ђ (9.15) Я«▓Я»Ї ╬▒ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ѕ Я«фЯ«┐Я«░Я«цЯ«┐Я«»Я«┐Я«Ъ
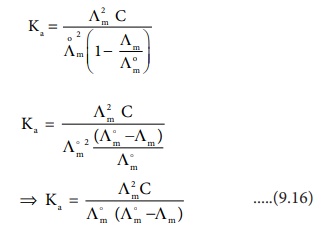
3. Я«џЯ»іЯ«▒Я»ЇЯ«ф Я«ЁЯ«│Я«хЯ»Ђ Я«ЋЯ«░Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ«░Я»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ«▓Я»Ї
AgCl, PbSO4 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЅЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я««Я«┐Я«ЋЯ«џЯ»Ї Я«џЯ«┐Я«▒Я«┐Я«цЯ«│Я«хЯ»Є Я«ЋЯ«░Я»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»ђЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐, Я«ЄЯ«еЯ»ЇЯ«ц Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ«░Я»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«фЯ»єЯ«░Я»ЂЯ«ЋЯ»ЇЯ«Ћ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«Ъ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
AgCl Я«ЅЯ«фЯ»ЇЯ«фЯ»ѕ Я«њЯ«░Я»Ђ Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ Я«ЋЯ«░Я»ЂЯ«цЯ»ЂЯ«хЯ»ІЯ««Я»Ї
AgCl (s) Рєћ Ag+ + ClРѕњ
Ksp = [Ag+ ][Cl- ]
Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ [Ag+] Я«ЄЯ«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»ѕ РђўCРђЎ molL-1 Я«јЯ«ЕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«Ћ.
Я«хЯ«┐Я«ЋЯ«┐Я«цЯ«ЋЯ»Ї Я«ЋЯ»ѓЯ«▒Я»Ђ Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї [Ag+] = C, Я«јЯ«ЕЯ«┐Я«▓Я»Ї, [Cl-] Я«ЄЯ«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ»ЂЯ««Я»Ї 'C' mol L-1 Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я«џЯ««Я««Я«ЙЯ«ЋЯ«хЯ»Є Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї
Ksp = C.C
РЄњ Ksp = C2
Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«ЕЯ»Ї Я«џЯ»єЯ«▒Я«┐Я«хЯ«ЙЯ«ЕЯ«цЯ»Ђ (moldm-3 Я«ЁЯ«▓Я«ЋЯ«┐Я«▓Я»Ї) Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«еЯ«┐Я«»Я«« Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«џЯ««Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ»ЂЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»ѕ Я«еЯ«ЙЯ««Я»Ї Я«ЁЯ«▒Я«┐Я«хЯ»ІЯ««Я»Ї.
╔Ёo = K ├Ќ 10-3 / C (mol L-1)
(Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ)
C = K ├Ќ 10-3 / ╔Ёo
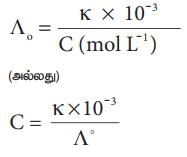
Я«џЯ»єЯ«▒Я«┐Я«хЯ»Ђ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Ksp = C2 Я«јЯ«ЕЯ»ЂЯ««Я»Ї Я«цЯ»іЯ«ЪЯ«░Я»ЇЯ«фЯ«┐Я«▓Я»Ї Я«фЯ«┐Я«░Я«цЯ«┐Я«»Я«┐Я«Ъ
Ksp = (K ├Ќ 10-3 / ╔Ёo)2 ......(9.17)