புறப்பரப்பு வேதியியல் - நொதி வினைவேக மாற்றம் | 12th Chemistry : UNIT 10 : Surface Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 10 : புறப்பரப்பு வேதியியல்
நொதி வினைவேக மாற்றம்
நொதி வினைவேக மாற்றம்
நொதிகள் என்பவை முப்பரிமான அமைப்பு கொண்ட சிக்கலான புரத மூலக்கூறுகளாகும். இவை உயிரினங்களில் நிகழும் வேதி வினைகளுக்கு வினையூக்கிகளாக செயல்படுகின்றன. அநேக நேரங்களில் நொதிகள் கூழ்மநிலையில் காணப்படுகின்றன. மேலும், அவற்றின் வினையூக்க செயல்பாடுகளில் தேர்ந்து செயலாற்றக்கூடியவைகளாக உள்ளன. ஒரு குறிப்பிட்ட உயிருள்ள செல்லில் உருவாகும் ஒவ்வொரு நொதியும், செல்லில் நிகழும் ஒரு குறிப்பிட்ட வினைக்கு வினைவேக மாற்றியாக செயல்பட முடியும்.
நொதிவினைவேக மாற்றத்திற்கான சில பொதுவான எடுத்துக்காட்டுகள்:
1) கிளைசைல் L-குளுட்டமைல் L-தைரோசின் எனும் பெப்டைடானது, பெப்சின் எனும் நொதியால் நீராற்பகுப்படைகிறது.
2) டையஸ்டேஸ் எனும் நொதி ஸ்டார்ச்சை மால்டோசாக நீராற்பகுக்கிறது.
2(C6H10O5)n +nH2O → nC12 H22 O11
3) ஈஸ்ட்களில் உள்ள சைமேஸ் எனும் நொதியானது குளுக்கோஸை எத்தனாலாக மாற்றமடையச்செய்கிறது.
C6H12O6 → 2C2H5OH+2CO2
4) மைக்கோ டெர்மா அசிட்டி எனும் நொதி ஆல்கஹாலை அசிட்டிக் அமிலமாக ஆக்சிஜனேற்றமடையச் செய்கிறது.
C2H5OH + O2 → CH3COOH+H2O
5) சோயாபீன்களில் உள்ள யூரியேஸ் எனும் நொதி யூரியாவை நீராற்பகுக்கிறது.
NH2- CO - NH2 + H2O → 2NH3 + CO2
நொதிவினைவேகமாற்ற வினையின் வினைவழிமுறை
நொதிவினைவேக மாற்றத்தை விளக்குவதற்காக பின்வரும் வினைவழிமுறையானது முன்மொழியப்பட்டது.
E+S ↔ ES → P+E
இங்கு E என்பது நொதி, S என்பது வினைபடுபொருள், ES என்பது கிளர்வு அணைவு, P என்பது விளைபொருள் என குறிப்பிடுகின்றன.
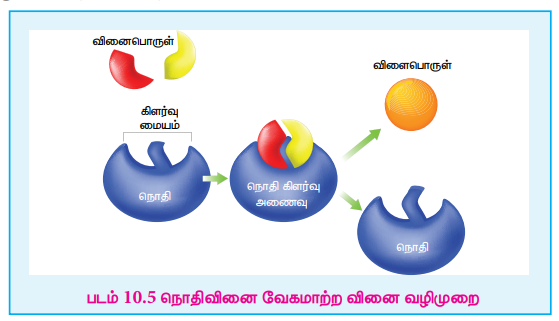
படம் 10.5 நொதிவினை வேகமாற்ற வினை வழிமுறை
நொதிவினைவேகமாற்றவினைகள் சில சிறப்புப் பண்புகளை கொண்டுள்ளன.
(i) பயனுள்ள மற்றும் திறனுள்ள மாற்றம் என்பது நொதி வினைவேக மாற்ற வினைகளில் சிறப்புப் பண்பாகும். ஒரு நொதியானது ஒரு நிமிட நேரத்தில் லட்சக்கணக்கானவினைபடு மூலக்கூறுகளை விளைபொருளாக மாற்றக்கூடியது.
எடுத்துக்காட்டாக 2H2O2 → 2H2O+O2
வினைவேகமாற்றி இல்லாத நிலையில் இவ்வினைக்கான கிளர்வுறு ஆற்றல் மதிப்பு 18k cal / மோல். வினையில் கூழ்மபிளாட்டினத்தை வினவேகமாற்றியாக சேர்த்த பின்பு, வினையின் கிளர்வுறு ஆற்றல் மதிப்பு 11.7kcal / மோல். ஆனால், நொதிவினைவேகமாற்றி முன்னிலையில் இவ்வினையின் கிளர்வுறு ஆற்றல் மதிப்பு 2kcal/மோல் ஐவிட குறைவாக உள்ளது.
(ii) நொதிவினைவேக மாற்றமானது அதிக தேர்ந்து செயலாற்றும் தன்மையை பெற்றுள்ளது.
H2N-CO-NH2+H2O → 2NH3 + CO2
யூரியாவின் நீராற்பகுப்பு வினைக்கு வினைவேகமாற்றியாக செயல்படும் யூரியேஸ் எனும் நொதியானது மெத்தில்யூரியா நீராற்பகுப்பு வினைக்கு வினைவேகமாற்றியாக செயல்படுவதில்லை .
H2N-CO-NH-CH3+H2O → வினை இல்லை
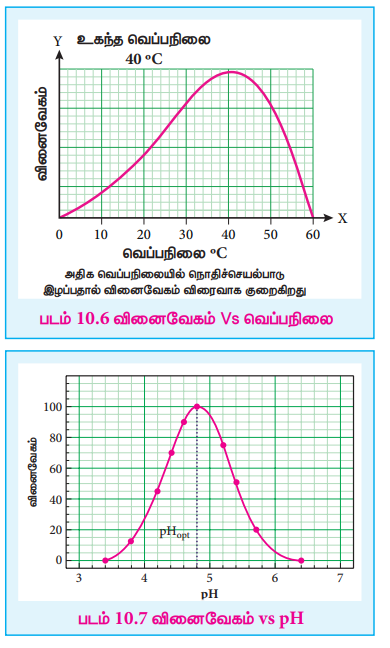
(iii) நொதிவினைவேகமாற்ற வினையானது அதன் உகந்த வெப்பநிலையில் அதிகபட்ச வேகத்தில் நிகழ்கிறது. முதலில், வெப்பநிலை அதிகரிக்கும்போது வினையின் வேகமும் அதிகரிக்கிறது. ஆனால், ஒரு குறிப்பிட்ட வெப்பநிலைக்கு மேல் நொதிச் செயல்பாடு இழக்கப்படுகிறது. இதனால வினையின் வேகம் பூஜ்ஜியமாக கூட குறையலாம்.எந்த குறிப்பிட்ட வெப்பநிலையில் நொதிச் செயல்பாடு அதிகபட்சமாக உள்ளதோ அந்த வெப்பநிலையில் அந்த நொதியின் உகந்த வெப்பநிலை என்றழைக்கப்படுகிறது.
எடுத்துக்காட்டு :
• மனித உடலில் செயல்படும் நொதிகளின் உகந்த வெப்பநிலை 37°C /98°F ஆகும்.
• காய்ச்சலின் போது, உடலின் வெப்பநிலை அதிகரிப்பதால், நொதிச் செயல்பாடு தகர்க்கப்படுவதால், உயிருக்கு ஆபத்தான நிலை உருவாகலாம்.
(iv) அமைப்பின் pH மதிப்பைப் பொருத்து நொதி வினைவேகமாற்ற வினைகளின் வேகம் அமைகிறது. வினைவேகமானது, உகந்த pH இல் அதிகபட்சமாக உள்ளது.
(v) நொதிகளின் செயல்பாட்டை தடுத்து நச்சுப்படுத்த முடியும். ஒரு நொதியின் செயல்பாட்டை ஒரு நச்சுப் பொருளால் குறைக்கவோ அல்லது முற்றிலுமாக இழக்கவோ செய்ய முடியும். மருந்துகளின் உடலியல் செயல்பாடானது, அவற்றின் தடுத்தல் செயல்முறையுடன் தொடர்புபடுத்தப்படுகிறது.
எடுத்துக்காட்டு: சல்பா மருந்துகள்.
பெனிசிலின், பாக்டீரியாக்களின் செயல்பாட்டை தடுப்பதன் காரணமாக நிமோனியா, வயிற்றுப்போக்கு, காலரா மற்றும் மற்ற தொற்று நோய்களை குணப்படுத்த பயன்படுகிறது.
(vi) துணைநொதிகள் அல்லது கிளர்வுறுத்திகளினால் நொதிகளின் வினைவேகமாற்ற செயல்பாடு அதிகரிக்கிறது. துணைநொதி என்றழைக்கப்படும் ஒரு சிறிய புரதமானது (வைட்டமின்) நொதியின் வினைவேகமாற்ற செயல்பாட்டை உயர்த்துகிறது.