புறப்பரப்பு வேதியியல் - ஜியோலைட் வினைவேக மாற்றம் | 12th Chemistry : UNIT 10 : Surface Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 10 : புறப்பரப்பு வேதியியல்
ஜியோலைட் வினைவேக மாற்றம்
ஜியோலைட் வினைவேக மாற்றம்:
ஜியோலைட்டுகள் பற்றி விவரிக்காமல், பலபடித்தான வினைவேக மாற்றத்தின் விளக்கம் முழுமையடையாது. ஜியோலைட்டுகள் நுண்துளைகளையுடைய , படிக வடிவமுடைய, நீரேறிய அலுமினோ சிலிக்கேட்டுகளாகும். இவை சிலிக்கான் மற்றும் அலுமினியம் நான்முகிகளால் ஆனவை. இயற்கையில் காணப்படும் 50 வெவ்வேறு வகை ஜியோலைட்டுகளும், 150 தொகுப்பு ஜியோலைட்டுகளும் காணக்கிடைக்கின்றன.
சிலிக்கான் நான்கு இணைதிறனையும், அலுமினியம் மூன்று இணைதிறனையும் கொண்டிருப்பதால் ஜியோலைட்டு அணிக்கோவையில் மிகையான எதிர்மின்சுமை காணப்படுகிறது. இந்த எதிர்மின்சுமையை நடுநிலையாக்க H+ அல்லது Na+ போன்ற கட்டமைப்புசாரா அயனிகள் காணப்படுகின்றன. புரோட்டான்களைக் கொண்டுள்ள ஜியோலைட்டுகள் திண்ம அமிலங்களாகவும், வினைவேக மாற்றிகளாகவும் பயன்படுத்தப்படுகின்றன. மேலும், இவை பெட்ரோலிய தொழிற்சாலைகளில் உயர் ஹைட்ரோகார்பன்களை சிதைத்து பெட்ரோல், டீசல் போன்றவற்றை பெறுவதிலும் அதிகமாக பயன்படுத்தப்படுகின்றன. Na+ அயனிகளைக் கொண்டுள்ள ஜியோலைட்டுகள் கார வினைவேக மாற்றிகளாக பயன்படுத்தப்படுகின்றன.
ஜியோலைட்டுகளின் முக்கிய பயன்பாடுகளில் ஒன்று அவற்றின் வடிவ தெரிவுத்திறனாகும். ஜியோலைட்டுகளில், கிளர்வு மையங்கள் அதாவது புரோட்டான்கள் நுண்துளைகளினுள் அமைந்துள்ளன. எனவே, ஜியோலைட்டுகளின் நுண் துளைகளுக்குள் மட்டுமே வினைகள் நிகழ்கின்றன.
வினைப்பொருள் தெரிவுத்திறன்:
வினைப்பொருள் கலவையிலுள்ள பெரிய மூலக்கூறுகள், ஜியோலைட் படிகத்தின் கிளர்வு மையங்களை சென்றடையாமல் தடுக்கப்படுகின்றன. இந்த தெரிவுத்திறனானது வினைப்பொருள் வடிவத் தெரிவுத்திறன் என்றழைக்கப்படுகிறது.
இடைநிலைச் சேர்ம தெரிவுத்திறன்:
வினையில் உருவாகும் இடைநிலைச் சேர்மமானது, ஜியோலைட்டுகளின் நுண்துளை அளவை விட பெரியதாக இருந்தால் விளைப்பொருள் உருவாகாது.
விளைப்பொருள் தெரிவுத்திறன்:
சில விளைப்பொருள் மூலக்கூறுகள் ஜியோலைட்டுகளின் நுண்துளைகளிலிருந்து வெளியேற இயலாத அளவிற்கு மிகப்பெரியதாக இருக்கும் போது, இந்த சிக்கல் உருவாகிறது.
நிலைமை மாற்ற வினைவேக மாற்றம்:
வினையில் ஈடுபடும் இரண்டு வினைபடு பொருட்களில் ஒன்று ஒரு கரைப்பானிலும், மற்றொன்று வேறொரு கரைப்பானிலும் கரைந்திருந்து, மேலும் அவ்விரு கரைப்பான்களும் ஒன்றுடன் ஒன்று கலக்காதவைகளாக இருந்தால், வினைபடு பொருட்களுக்கிடையே நிகழக்கூடிய வினை மிக மெதுவாக நிகழும். கரைப்பான்கள் தனித்தனி நிலைமைகளை உருவாக்குவதால், வினைபடு பொருட்கள் எல்லையை தாண்டிச் சென்று வினைபுரிய வேண்டிய சூழல் உருவாகிறது.ஆனால், எல்லை வழியே வினைபடு பொருட்கள் ஊடுருவி செல்லுதல் என்பது அவ்வளவு எளிதல்ல. இத்தகைய சூழ்நிலைகளில், இரண்டு கரைப்பான்களுடனும் கரையக்கூடிய மூன்றாவது கரைப்பான் சேர்க்கப்படுகிறது, இதனால், நிலைமை எல்லை நீக்கப்பட்டு, வினைபடு பொருட்கள் எளிதாக கலந்து, வேகமாக வினைபடுகின்றன. ஆனால், ஏதாவது ஒரு விளைப்பொருளின் மிகையளவு தயாரிப்பில், மூன்றாம் கரைப்பான் பயன்படுத்தப்படுவது விலையுயர்ந்ததாக அமையலாம். இத்தகைய சிக்கல்களை தீர்க்க, நிலைமைமாற்ற வினைவேக மாற்றம் சிறந்த தீர்வை அளிக்கிறது. இதில் கரைப்பான்களின் பயன்பாடு தவிர்க்கப்படுகிறது. இதில் நிலைமைமாற்ற வினைவேகமாற்றியை பயன்படுத்தி, வினைப்பொருளை ஒரு கரைப்பானிலிருந்து, இரண்டாம் வினைப்பொருள் இருக்கும் மற்றொரு கரைப்பானுக்கு நகர வழிவகை செய்யப்படுகிறது. வினைபடு பொருட்கள் இப்பொழுது நெருங்கி வந்துள்ளதால், அதிவேகமாக வினைப்பட்டு விளைப்பொருட்களை உருவாகுகின்றன.
எடுத்துக்காட்டு :
பின்வரும் வினையில் Cl- ஐ CN- கொண்டு பதிலீடு செய்தல்.
R-Cl + NaCN → R-CN + NaCl
கரிம நிலைமை நீர்ம நிலைமை கரிம நிலைமை நீர்ம நிலைமை
R-Cl =1 - குளோரோஆக்டேன்
R-CN =1 - சயனோஆக்டேன்
கரிமநிலைமையிலுள்ள 1-குளோரோஆக்டேன் உடன்நீர்த்த நிலைமையிலுள்ள சோடியம் சயனைடு கலக்கப்பட்ட இருநிலைமை கலவையை பல நாட்களுக்கு நேரடியாக வெப்பப்படுத்தினாலும் 1-சயனோ ஆக்டேன் கிடைப்பதில்லை. ஆனால், சிறிதளவு டெட்ரா ஆல்கைல் அம்மோனியம் குளோரைடு போன்ற நான்கிணைய உப்பை சேர்க்கும்போது, அதிவேகமாக, 100% விளைச்சலுடன் ஓரிரு மணித்துளிகளில் 1- சயனோ ஆக்டேன் உருவாகிறது. இந்த வினையில் நீர்வெறுக்கும் மற்றும் நீர்விரும்பும் முனைகளைக் கொண்டுள்ள டெட்ராஆல்கைல் அம்மோனியம் நேரயனியானது, அதன் நீர்விரும்பும் முனையை பயன்படுத்தி நீர்த்த நிலைமையிலிருக்கும் CN- அயனிகளை கரிமநிலைமைக்கு நகர்த்தி 1-குளோரோ ஆக்டேனுடன் வினைபுரிய தூண்டுகிறது.
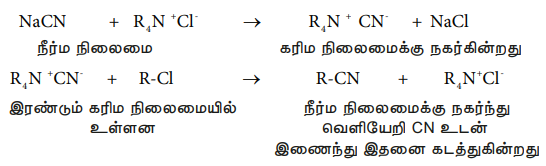
எனவே, நிலைமைமாற்ற வினைவேகமாற்றியானது, ஒரு வினைபடுபொருளை ஒரு நிலைமையிலிருந்து, மற்றொரு நிலைமைக்கு கடத்துவதன் மூலமாக, வினையின் வேகத்தை அதிகரிக்கின்றன.
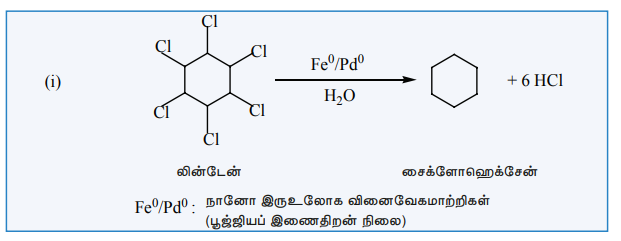
நானோ வினைவேக மாற்றம்:
உலோகம் மற்றும் உலோக ஆக்சைடுகளின் நானோ துகள்கள் பல்வேறு வேதி மாற்றங்களில் வினைவேக மாற்றிகளாக பயன்படுகின்றன. நானோவினைவேக மாற்றிகளானவை, ஒருபடித்தான மற்றும் பலபடித்தான வினைவேக மாற்றிகளைவிட சிறந்தவைகளாக உள்ளன. ஒருபடித்தான வினைவேகமாற்றிகளைப் போலவே, நானோ வினைவேகமாற்றிகளும் 100% தேர்ந்தெடுக்கப்பட்ட மாற்றத்தையும், மேம்பட்ட விளைச்சலையும் தருகின்றன. மேலும், இவை அதிவேக செயல்திறனைக் கொண்டுள்ளன. பலபடித்தான வினைவேகமாற்றிகளைப் போலவே, நானோ வினைவேகமாற்றிகளை மீளப்பெற்று, மறுசுழற்சி செய்ய முடியும்.உண்மையில், நானோ வினைவேகமாற்றிகள் என்பவை கரையும் பலபடித்தான வினைவேக மாற்றிகளாகும். நானோ துகள்களால் வினையூக்கம் பெறும் வினைக்கு எடுத்துக்காட்டு கீழே கொடுக்கப்பட்டுள்ளது.