புறப்பரப்பு வேதியியல் - வினைவேக மாற்றக் கொள்கைகள் | 12th Chemistry : UNIT 10 : Surface Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 10 : புறப்பரப்பு வேதியியல்
வினைவேக மாற்றக் கொள்கைகள்
வினைவேக மாற்றக் கொள்கைகள்
ஒரு வேதி வினைநிகழ வேண்டுமெனில், கிளர்வு அணைவை உருவாக்குவதற்காக வினைபடு பொருட்கள் கிளர்வுறுத்தப்பட வேண்டும். கிளர்வு அணைவை உருவாக்கும் பொருட்டு, வினைபடு பொருட்களுக்கு தேவைப்படும் ஆற்றலானது கிளர்வுறு ஆற்றல் என்றழைக்கப்படுகிறது. வினையின்வெப்பநிலை அதிகரிப்பதன் மூலம், கிளர்வுறு ஆற்றலை குறைக்க முடியும். வினைவேக மாற்றிகள் உள்ளபோது, வினைபடுபொருட்கள் குறைந்த வெப்பநிலையிலேயே கிளர்வுறுத்தப்படுகின்றன, அதாவது கிளர்வுறு ஆற்றல் குறைக்கப்படுகிறது. வினைவேகமாற்றியானது, வினைபடு பொருட்களை பரப்பு கவர்ந்து, அவற்றிலுள்ள பிணைப்புகளை தளர்த்துவதன் மூலம் அவற்றை கிளர்வுறுத்தி, வினைபுரிய அனுமதிப்பதால் விளைபொருட்கள் உருவாகின்றன.
வினைவேக மாற்றிகளின் முன்னிலையில், கிளர்வுறு ஆற்றல் குறைக்கப்படுகிறது, அதிக எண்ணிக்கையிலான மூலக்கூறுகள் வினையில் பங்கேற்கின்றன. எனவே, வினையின் வேகம் அதிகரிக்கிறது.
ஒரு வேதி வினையில் வினைவேக மாற்றியின் செயல்பாட்டை விளக்குவதற்காக இரண்டு முக்கியமான கொள்கைகள் முன்மொழியப்பட்டுள்ளன.அவையாவன,
(i) இடைநிலைச் சேர்மம் உருவாதல் கொள்கை
(ii) பரப்பு கவர்தல் கொள்கை .
1. இடைநிலைச் சேர்மம் உருவாதல் கொள்கை:
வினைவேகமாற்றிகள், குறைந்த கிளர்வு ஆற்றலைக் கொண்ட புதிய வழிமுறையை உருவாக்குகின்றன. ஒருபடித்தான வினைவேக மாற்ற வினைகளில் ஒரு வினைவேகமாற்றியானது ஒன்று அல்லது அதற்கு மேற்பட்ட வினைபடு பொருட்களுடன் இணைந்து ஒரு இடைநிலை சேர்மத்தை உருவாக்குகிறது. இந்த இடைநிலைச் சேர்மமானது , மற்றொரு வினைபடுபொருளுடன் வினைப்பட்டோ அல்லது தாமாக சிதைந்தோ விளைபொருட்களை உருவாக்குகின்றன. மேலும் வினைவேகமாற்றியானது மீள் உருவாக்கம் பெறுகிறது.
பின்வரும் வினைகளை கருதுக
A+B → AB (1)
A+C → AC (இடைநிலை சேர்மம்) (2)
C என்பது வினைவேக மாற்றி
AC+B → AB+C (3)
(2) மற்றும் (3) ஆம் வினைகளுக்கான கிளர்வுறு ஆற்றல்கள்,வினை (1) ஐவிட குறைவாக உள்ளன. எனவே, இடைநிலைச் சேர்மம் உருவாதல் மற்றும் சிதைதல் மூலம் வினையின் வேகம் அதிகரிக்கப்படுகிறது.
எடுத்துக்காட்டு 1
ஃபிரீடல் கிராஃப்ட் வினையின் வினைவழிமுறை கீழே கொடுக்கப்பட்டுள்ளது.

வினைவேக மாற்றியின் செயல்பாடு கீழ்காணுமாறு விளக்கப்படுகிறது.
CH3Ci+AlCl3 → [CH3] + [AlCl4]-
இது ஒரு இடைநிலைச் சேர்மமாகும்.
C6H6 +[CH3+] [AlCl4]- → C6 H5CH3+AlCl3+HCl
எடுத்துக்காட்டு 2
MnO2 முன்னிலையில் KClO3 யின் வெப்பச்சிதைவு வினை பின்வருமாறு நிகழ்கிறது. 2KClO3 → 2KCl+3O2 வினையில் நிகழும் படிகளை பின்வருமாறு எழுதலாம்
2KCIO3 +6MnO2 → 6MnO3+2KCl
இது ஒரு இடைநிலைச் சேர்மமாகும்.
6MnO3 → 6MnO2+3O2
எடுத்துக்காட்டு 3:
Cu முன்னிலையில் H2 மற்றும் O2 ஆகியன வினைபுரிவதால் நீர் உருவாகும் வினை பின்வருமாறு நிகழ்கிறது. 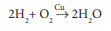 வினையில் நிகழும் படிகளை பின்வருமாறு எழுதலாம்.
வினையில் நிகழும் படிகளை பின்வருமாறு எழுதலாம்.
2Cu+ 1/2 O2 → Cu2O
இது ஒரு இடைநிலைச் சேர்மமாகும்.
Cu2O + H2 → H2O+2Cu
எடுத்துக்காட்டு 4:
CuCl2 முன்னிலையில் காற்றைக் கொண்டு HCl ஐ ஆக்சிஜனேற்றம் அடையும் வினை பின்வருமாறு நிகழ்கிறது. 4HCl+2O2 ppp 2H2O+ 2Cl2 வினையில் நிகழும் படிகள்
2CuCl2 → Cl2 +Cu2Cl2
2Cu2Cl2+O2 → 2Cu2OCl2
இது ஒரு இடைநிலைச் சேர்மமாகும்.
2Cu2OCl2 +4HCl → 2H2O +4CuCl2
(i) வினைவேகமாற்றியின் தேர்ந்து செயலாற்றும் தன்மை.
(ii) வினைவேகமாற்றியின் செறிவு அதிகரிப்பை பொறுத்து வினையின் வேகம் அதிகரித்தல். ஆகியவற்றை இக்கொள்கை விளக்குகிறது.
வரம்புகள்
(i) வினைவேகமாற்ற நச்சு மற்றும் உயர்த்திகளின் செயல்பாடுகளை இடைநிலைச் சேர்மக் கொள்கையால் விளக்க இயலவில்லை.
(ii) பலபடித்தானவினைவேகமாற்ற வினைகளின் வினைவழிமுறையை இக்கொள்கையால் விளக்க இயலவில்லை .
2. பரப்பு கவர்தல்கொள்கை
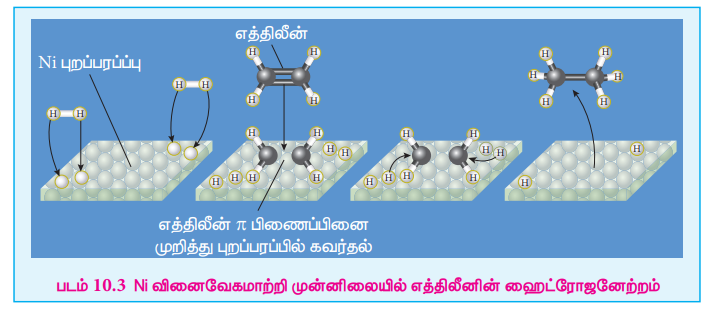
லாங்மியூர் என்பவர் பலபடித்தான வினைவேகமாற்ற வினையில், வினைவேக மாற்றியின் செயல்பாட்டை, பரப்பு கவர்தலை அடிப்படையாக கொண்டு விளக்கினார். வினைபடு மூலக்கூறுகள் வினைவேக மாற்றியின் புறப்பரப்பில் பரப்பு கவரப்படுவதால், இதை தொடர்பு வினைவேக மாற்றம் எனவும் அழைக்கலாம்.
இக்கொள்கையின்படி, வினைபடு மூலக்கூறுகள், வினைவேக மாற்றியின் புறப்பரப்பில் பரப்பு கவரப்பட்டு கிளர்வு அணைவை உருவாக்குகின்றன. இவை உடனே சிதைந்து விளைபொருட்களை தருகின்றன.
பலபடித்தானவினைவேகமாற்ற வினையில் நிகழும் பல்வேறு படிநிலைகள் கீழே கொடுக்கப்பட்டுள்ளன.
1. வினைபடு மூலக்கூறுகள் வினைவேக மாற்றியின் புறப்பரப்பை நோக்கி நகர்கின்றன.
2. வினைபடு மூலக்கூறுகள் வினைவேக மாற்றியின் புறப்பரப்பில் பரப்பு கவரப்படுகின்றன.
3. பரப்புகவரப்பட்டவினைபடு மூலக்கூறுகள் கிளர்வுற்று ”கிளர்வு அணைவு”உருவாகிறது. மேலும், இந்த கிளர்வு அணைவு சிதைவடைந்து, விளைபொருட்களை உருவாக்குகின்றன.
4. விளைபொருள் மூலக்கூறுகள் பரப்பு நீக்கம் அடைகின்றன.
5. விளைபொருளானது வினைவேகமாற்றியின் புறப்பரப்பை விட்டு விலகிச் செல்கின்றன.
கிளர்வு மையங்கள்:
வினைவேக மாற்றியின் புறப்பரப்பானது வழுவழுப்பாக இருப்பதில்லை. அதில், பல்வேறு தடங்கள், விரிசல்கள் மற்றும் முனைகள் காணப்படுகின்றன புறப்பரப்பிலுள்ள இத்தகைய பகுதிகளில் காணப்படும் அணுக்கள் நிறைவுறா பிணைப்புகளை கொண்டுள்ளதால் அதிகளவு எச்ச கவர்ச்சி விசைகளை கொண்டுள்ளன. இத்தகைய மையங்கள் கிளர்வு மையங்கள் என்றழைக்கப்படுகின்றன. எனவே, புறப்பரப்பானது அதிக பரப்பு கட்டிலா ஆற்றலை பெற்றுள்ளது.
இந்த கிளர்வு மையங்கள் வினைபடு மூலக்கூறுகளை பரப்பு கவர்ந்து, அவற்றை கிளர்வுறச் செய்து வினையின் வேகத்தை அதிகரிக்கின்றன.
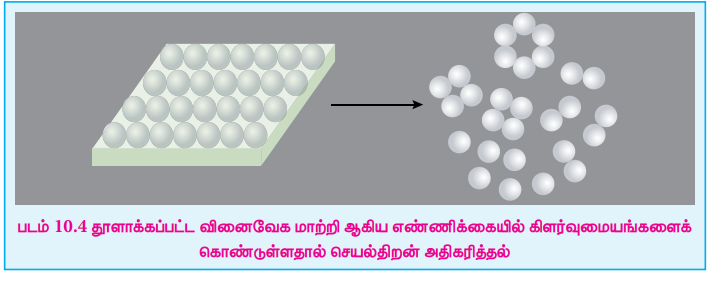
படம் 10.4 தூளாக்கப்பட்ட வினைவேக மாற்றி ஆகிய எண்ணிக்கையில் கிளர்வுமையங்களைக் கொண்டுள்ளதால் செயல்திறன் அதிகரித்தல்
பரப்பு கவர்தல் கொள்கையானது பின்வருவனவற்றை விளக்குகிறது.
i. உலோகங்கள் மற்றும் உலோக ஆக்சைடு துகள்களின் உருவ அளவை குறைக்கும்போது அவற்றின் பரப்பளவு அதிகரிக்கிறது. இதனால், அவற்றின் வினைவேகமாற்றியாக செயல்படும் திறனும், வினையின் வேகமும் அதிகரிக்கின்றன.
ii. வினைவேகமாற்றியின் கிளர்வு மையங்களை நச்சு பொருள் ஆக்கிரமிக்கும் போது வினைவேகமாற்ற நச்சுத் தன்மை உருவாகிறது.
iii. உயர்த்திகள் புறப்பரப்பிலுள்ள கிளர்வு மையங்களின் எண்ணிக்கையை அதிகரிக்கின்றன.