Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї - Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї | 12th Chemistry : UNIT 10 : Surface Chemistry
12 Я«єЯ««Я»Ї Я«хЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї : Я«ЁЯ«цЯ»ЇЯ«цЯ«┐Я«»Я«ЙЯ«»Я««Я»Ї 10 : Я«фЯ»ЂЯ«▒Я«фЯ»ЇЯ«фЯ«░Я«фЯ»ЇЯ«фЯ»Ђ Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї
Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«фЯ»єЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«ЙЯ«▓Я«ЙЯ«Е Я«еЯ»ђЯ«░Я»ЇЯ«хЯ«┐Я«░Я»ЂЯ««Я»ЇЯ«фЯ»ЂЯ««Я»Ї Я«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»ѕ, Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ, Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«░Я«фЯ»ЇЯ«фЯ«░Я»Ї, Я«фЯ»єЯ«ЕЯ»ЇЯ«џЯ»ђЯ«ЕЯ»Ї Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«џЯ»ІЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕ Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«цЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«џЯ»ЇЯ«џЯ»ѕЯ«»Я«ЙЯ«Ћ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«фЯ»іЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ, Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
i. Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕЯ««Я»ЂЯ«▒Я»ѕ: Я«ЄЯ««Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«фЯ»єЯ«░Я«┐Я«» Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»Ї, Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
ii. Я«цЯ»іЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»ЂЯ««Я»ЂЯ«▒Я»ѕ: Я«ЄЯ««Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«џЯ«┐Я«▒Я«┐Я«» Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я»Ї, Я«фЯ»єЯ«░Я«┐Я«» Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«ЁЯ«│Я«хЯ«┐Я«▓Я«ЙЯ«Е Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я«ЙЯ«Ћ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
1) Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я»Ї:
(i) Я«ЄЯ«»Я«еЯ»ЇЯ«цЯ«┐Я«░Я«фЯ»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я««Я»ЂЯ«▒Я»ѕ:
Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«єЯ«▓Я»ѕЯ«»Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐, Я«цЯ«┐Я«БЯ»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЁЯ«░Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«еЯ»ЇЯ«ц Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«єЯ«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«јЯ«цЯ«┐Я«░Я»єЯ«цЯ«┐Я«░Я»Ї Я«цЯ«┐Я«џЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї, Я«ЁЯ«цЯ«┐Я«хЯ»ЄЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї, Я«ЈЯ«▒Я«цЯ»ЇЯ«цЯ«ЙЯ«┤ Я«њЯ«░Я»Ђ Я«еЯ«┐Я««Я«┐Я«ЪЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї 7000 Я«џЯ»ЂЯ«┤Я«▒Я»ЇЯ«џЯ«┐Я«ЋЯ«│Я»ЇЯ«хЯ«░Я»ѕ Я«џЯ»ЂЯ«┤Я«▓Я»ЂЯ««Я»Ї Я«ЅЯ«▓Я»ІЯ«Ћ Я«цЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«Е.
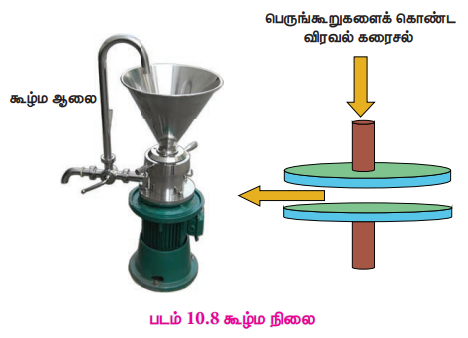
Я«фЯ«ЪЯ««Я»Ї 10.8 Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«еЯ«┐Я«▓Я»ѕ
Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«цЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є Я«ЅЯ«│Я»ЇЯ«│ Я«ЄЯ«ЪЯ»ѕЯ«хЯ»єЯ«│Я«┐Я«»Я»ѕ Я«џЯ«░Я«┐Я«џЯ»єЯ«»Я»ЇЯ«хЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«цЯ»ЄЯ«хЯ»ѕЯ«»Я«ЙЯ«Е Я«ЅЯ«░Я»ЂЯ«хЯ«│Я«хЯ»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ»єЯ«▒Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
Я«ЄЯ«еЯ»ЇЯ«ц Я««Я»ЂЯ«▒Я»ѕЯ«»Я»ѕЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЄЯ«ЎЯ»ЇЯ«ЋЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЋЯ«┐Я«░Я«ЙЯ«ЃЯ«фЯ»ѕЯ«ЪЯ»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
(ii) Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я««Я»ЂЯ«▒Я»ѕ:
Я««Я»ЂЯ«цЯ«ЕЯ»ЇЯ««Я»ЂЯ«цЯ«▓Я«┐Я«▓Я»Ї 1898 Я«▓Я»Ї Я«юЯ«ЙЯ«░Я»ЇЯ«юЯ»Ї Я«фЯ«┐Я«░Я«ЪЯ«┐Я«ЋЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«хЯ«░Я«ЙЯ«▓Я»Ї, Я«фЯ«┤Я»ЂЯ«фЯ»ЇЯ«фЯ»ЂЯ«еЯ«┐Я«▒ Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«Е Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«фЯ«ЕЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«џЯ»ѓЯ«┤Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«еЯ»ђЯ«░Я«┐Я«ЕЯ»ЂЯ«│Я»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«Е Я««Я«┐Я«ЕЯ»ЇЯ««Я»ЂЯ«ЕЯ»ѕЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЪЯ»ѕЯ«»Я»Є, Я«њЯ«░Я»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«хЯ«┐Я«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
1 amp /100 V Я«ЁЯ«│Я«хЯ»ЂЯ«ЪЯ»ѕЯ«» Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ІЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я«┐Я«ЕЯ»ЇЯ«хЯ«┐Я«▓Я»ЇЯ«▓Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ»ѕ Я«єЯ«хЯ«┐Я«»Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ, Я«ЄЯ«цЯ»Ђ Я«ЅЯ«ЪЯ«ЕЯ«ЪЯ«┐Я«»Я«ЙЯ«Ћ Я«ЋЯ»ЂЯ«│Я«┐Я«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ, Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«еЯ»ЇЯ«ц Я««Я»ЂЯ«▒Я»ѕЯ«»Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«░Я»Ї, Я«џЯ«┐Я«▓Я»ЇЯ«хЯ«░Я»Ї, Я«ЋЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ђ, Я«фЯ«┐Я«│Я«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«фЯ«▓Я»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ѕ Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«хЯ«цЯ«▒Я»ЇЯ«ЋЯ«ЙЯ«Ћ, Я«ЋЯ«ЙЯ«░ Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я«еЯ«┐Я«▓Я»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«░Я«БЯ«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
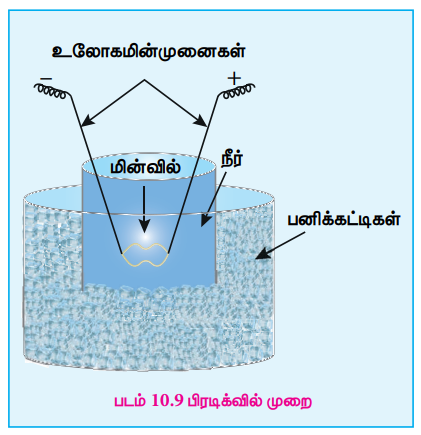
Я«фЯ«ЪЯ««Я»Ї 10.9 Я«фЯ«┐Я«░Я«ЪЯ«┐Я«ЋЯ»ЇЯ«хЯ«┐Я«▓Я»Ї Я««Я»ЂЯ«▒Я»ѕ
Я«ИЯ»ЇЯ«хЯ»єЯ«ЪЯ»ЇЯ«фЯ«░Я»ЇЯ«ЋЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«хЯ«░Я»Ї Я«ЄЯ«еЯ»ЇЯ«ц Я««Я»ЂЯ«▒Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«џЯ«┐Я«▓ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЕЯ«ЙЯ«░Я»Ї. Я«еЯ»ђЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ»ЄЯ«цЯ«┐Я«џЯ»ЇЯ«џЯ«┐Я«цЯ»ѕЯ«хЯ»ѕ Я«цЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЅЯ«»Я«░Я»Ї Я«ЁЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»єЯ«БЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я««Я«ЙЯ«▒Я»ЂЯ«цЯ«┐Я«џЯ»ѕ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ»ІЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«фЯ»єЯ«ЕЯ»ЇЯ«ЪЯ»ЄЯ«ЕЯ»Ї, Я«ѕЯ«цЯ«░Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»єЯ«ЕЯ»ЇЯ«џЯ»ђЯ«ЕЯ»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«јЯ«│Я«┐Я«цЯ«┐Я«▓Я»Ї Я«цЯ»ђЯ«фЯ»ЇЯ«фЯ«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї, Я«ЋЯ«░Я«┐Я«« Я«еЯ»ђЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»ѕ Я«ЁЯ«хЯ«░Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«ЙЯ«░Я»Ї.
(iii) Я««Я»ђЯ«»Я»іЯ«▓Я«┐Я«фЯ»Ї Я«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я««Я»ЂЯ«▒Я»ѕ:
20kHz (Я«ЋЯ»ЄЯ«ЪЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«јЯ«▓Я»ЇЯ«▓Я»ѕ) Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЁЯ«цЯ«┐Я«ЋЯ««Я«ЙЯ«Е Я«ЁЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»єЯ«БЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«њЯ«▓Я«┐ Я«ЁЯ«▓Я»ѕЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«фЯ»єЯ«░Я«┐Я«» Я«ЅЯ«░Я»ЂЯ«хЯ«│Я«хЯ»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«цЯ»іЯ«ЎЯ»ЇЯ«ЋЯ«▓Я»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ, Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«џЯ«┐Я«цЯ»ѕЯ«ЋЯ»ЇЯ«Ћ Я««Я»ЂЯ«ЪЯ«┐Я«»Я»ЂЯ««Я»Ї.
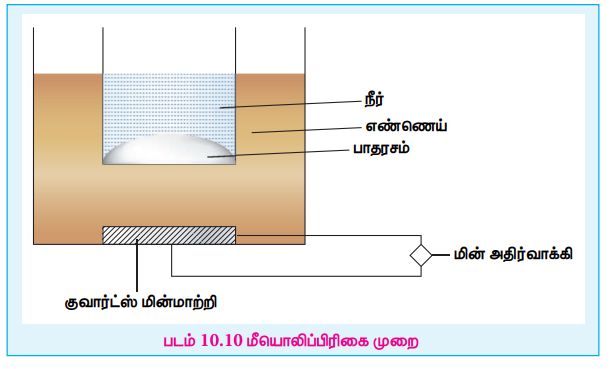
Я«фЯ«ЪЯ««Я»Ї 10.10 Я««Я»ђЯ«»Я»іЯ«▓Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«░Я«┐Я«ЋЯ»ѕ Я««Я»ЂЯ«▒Я»ѕ
Я«ЋЯ«┐Я«│Я«ЙЯ«ИЯ»Ї Я«јЯ«ЕЯ»ЇЯ«фЯ«хЯ«░Я»Ї Я«фЯ«ЙЯ«цЯ«░Я«џЯ«цЯ»ЇЯ«цЯ»ѕ, Я«ЁЯ«цЯ«┐Я«Ћ Я«ЁЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»єЯ«БЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я««Я»ђЯ«»Я»іЯ«▓Я«┐ Я«ЁЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»ЂЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«фЯ«ЙЯ«цЯ«░Я«џ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»ЇЯ«цЯ»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«цЯ»ЇЯ«цЯ«ЙЯ«░Я»Ї.
Я«ЁЯ«цЯ«┐Я«░Я»ЇЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«ЋЯ«│Я«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я»ђЯ«»Я»іЯ«▓Я«┐ Я«ЁЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»ЂЯ«ЋЯ«│Я»Ї Я«јЯ«БЯ»ЇЯ«БЯ»єЯ«»Я»Ї Я«хЯ«┤Я«┐Я«»Я«ЙЯ«Ћ Я«фЯ«░Я«хЯ«┐, Я«ЋЯ«▓Я«ЕЯ«┐Я«▓Я»Ї Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«фЯ«ЙЯ«цЯ«░Я«џЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЋЯ«ЪЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
(iv) Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«▓Я»Ї:
Я«цЯ«ЋЯ»ЂЯ«еЯ»ЇЯ«ц Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«ЋЯ«│Я»ѕ Я«џЯ»ЄЯ«░Я»ЇЯ«фЯ»ЇЯ«фЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї, Я«хЯ»ђЯ«┤Я»ЇЯ«фЯ«ЪЯ«┐Я«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«еЯ«┐Я«▓Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я««Я«ЙЯ«▒Я»ЇЯ«▒ Я«ЄЯ«»Я«▓Я»ЂЯ««Я»Ї. Я«ЄЯ«еЯ»ЇЯ«ц Я«џЯ»єЯ«»Я«▓Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ«▓Я»Ї Я«јЯ«Е Я«фЯ»єЯ«»Я«░Я«┐Я«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я««Я«┐Я«ЕЯ»ЇЯ«фЯ«ЋЯ»ЂЯ«│Я«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«ЋЯ«ЙЯ«░Я«БЯ«┐ Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«хЯ«┐Я«░Я«хЯ»ЂЯ«цЯ«▓Я»Ї Я«ЋЯ«ЙЯ«░Я«БЯ«┐ Я«јЯ«ЕЯ»ЇЯ«▒Я«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2) Я«цЯ»іЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я»Ї:
Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«цЯ»ЄЯ«хЯ»ѕЯ«»Я«ЙЯ«Е Я«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«ЕЯ«цЯ»Ђ, Я«џЯ«┐Я«▒Я«┐Я«» Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я«ЙЯ«ЋЯ«хЯ»І, Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«ЁЯ«»Я«ЕЯ«┐Я«ЋЯ«│Я«ЙЯ«ЋЯ«хЯ»І Я«ЄЯ«░Я»ЂЯ«еЯ»ЇЯ«цЯ«ЙЯ«▓Я»Ї, Я«ЁЯ«хЯ»ѕ Я«цЯ»іЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«ЁЯ«│Я«хЯ«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я««Я«┐Я«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЋЯ«хЯ«ЕЯ««Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ«▓Я»Ї Я«ЁЯ«хЯ«џЯ«┐Я«»Я««Я»Ї, Я«ЄЯ«▓Я»ЇЯ«▓Я»ѕЯ«»Я»єЯ«ЕЯ«┐Я«▓Я»Ї Я«хЯ»ђЯ«┤Я»ЇЯ«фЯ«ЪЯ«┐Я«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ«▓Я»Ї Я«еЯ«┐Я«ЋЯ«┤Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«ЪЯ»ЂЯ««Я»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«Ћ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«хЯ»ЄЯ«цЯ«┐ Я««Я»ЂЯ«▒Я»ѕЯ«ЋЯ«│Я»Ї Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ.
(i) Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї:
Я«џЯ«┐Я«▓ Я«ЁЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ««Я»ЇЯ««Я»ЂЯ«▒Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
(a) Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«»Я»ІЯ«ЪЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«ЁЯ«»Я»ІЯ«ЪЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, I2 Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я»Ї Я«ЋЯ«┐Я«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
HIO3+5HI Рєњ 3H2O+I2 (Sol)
(b) H2Se Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є O2 Я«хЯ»ѕ Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я«џЯ»єЯ«▓Я»ђЯ«ЕЯ«┐Я«»Я««Я»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я»Ї Я«ЋЯ«┐Я«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
H2Se+O2 Рєњ 2H2O+Se(sol)
(ii) Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ««Я»Ї:
Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«Ћ, Я«фЯ»ђЯ«ЕЯ»ѕЯ«▓Я»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«џЯ»ђЯ«ЕЯ»Ї, Я«ЃЯ«фЯ«ЙЯ«░Я»ЇЯ««Я«ЙЯ«▓Я»ЇЯ«ЪЯ«┐Я«╣Я»ѕЯ«ЪЯ»Ђ Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«фЯ«▓Я»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«ЋЯ«░Я«┐Я«« Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ:, Я«ЃЯ«фЯ«ЙЯ«░Я»ЇЯ««Я«ЙЯ«▓Я»ЇЯ«ЪЯ«┐Я«╣Я»ѕЯ«ЪЯ»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐, Я«єЯ«░Я«┐Я«ЋЯ»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»ѕ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«хЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЋЯ»ІЯ«▓Я»ЇЯ«ЪЯ»Ђ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я»Ї Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
2AuCl 3 +3HCHO+3H2O Рєњ 2Au(sol)+6HCl+3HCOOH
(iii) Я«еЯ»ђЯ«░Я«ЙЯ«▒Я»ЇЯ«фЯ«ЋЯ»ЂЯ«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«ЋЯ»ЂЯ«░Я»ІЯ««Я«┐Я«»Я««Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЁЯ«▓Я»ЂЯ««Я«┐Я«ЕЯ«┐Я«»Я««Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»Ђ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЄЯ«еЯ»ЇЯ«ц Я««Я»ЂЯ«▒Я»ѕЯ«»Я»ѕ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«јЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«Ћ,
FeCl3 + 3H2O Рєњ Fe(OH) 3 + 3HCl
(iv) Я«ЄЯ«░Я«ЪЯ»ЇЯ«ЪЯ»ѕЯ«џЯ»Ї Я«џЯ«┐Я«цЯ»ѕЯ«хЯ»Ђ
Я«ЄЯ«еЯ»ЇЯ«ц Я««Я»ЂЯ«▒Я»ѕЯ«»Я«ЙЯ«ЕЯ«цЯ»Ђ Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я«ЙЯ«ц Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»ѕ Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«Ћ Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«░Я»ЇЯ«џЯ«ЕЯ«┐Я«ЋЯ»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»Ђ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«ЕЯ»Ї Я«хЯ«┤Я«┐Я«»Я»Є Я«╣Я»ѕЯ«ЪЯ»ЇЯ«░Я«юЯ«ЕЯ»Ї Я«џЯ«▓Я»ЇЯ«фЯ»ѕЯ«ЪЯ»Ђ Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ»ѕ Я«џЯ»єЯ«▓Я»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я««Я«ъЯ»ЇЯ«џЯ«│Я»Ї Я«еЯ«┐Я«▒ Я«єЯ«░Я»ЇЯ«џЯ«ЕЯ«┐Я«ЋЯ»Ї Я«џЯ«▓Я»ЇЯ«фЯ«ЪЯ»Ђ Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я»Ї Я«фЯ»єЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
As2O3+3H2S Рєњ As2S3+3H2O
(v) Я«џЯ«┐Я«цЯ»ѕЯ«цЯ»ЇЯ«цЯ«▓Я»Ї
Я«еЯ»ђЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«џЯ»ІЯ«ЪЯ«┐Я«»Я««Я»Ї Я«цЯ«»Я»ІЯ«џЯ«▓Я»ЇЯ«фЯ»ЄЯ«ЪЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ«┐Я«▓ Я«цЯ»ЂЯ«│Я«┐Я«ЋЯ«│Я»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ, Я«џЯ»ІЯ«ЪЯ«┐Я«»Я««Я»Ї Я«цЯ«»Я»ІЯ«џЯ«▓Я»ЇЯ«фЯ»ЄЯ«ЪЯ»Ї Я«џЯ«┐Я«цЯ»ѕЯ«хЯ«ЪЯ»ѕЯ«хЯ«цЯ«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я«ЙЯ«ц Я«цЯ«ЕЯ«┐Я«цЯ»ЇЯ«ц Я«џЯ«▓Я»ЇЯ«фЯ«░Я»Ї Я«ЁЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я«њЯ«ЕЯ»ЇЯ«▒Я«┐Я«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«џЯ«┐Я«▒Я«┐Я«» Я«цЯ«┐Я«░Я«ЪЯ»ЇЯ«џЯ«┐Я«ЋЯ«│Я«ЙЯ«Ћ Я«њЯ«ЕЯ»ЇЯ«▒Я«┐Я«БЯ»ѕЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«цЯ»Ї Я«цЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЁЯ«│Я«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»ЂЯ«│Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«ЄЯ«еЯ»ЇЯ«ц Я«цЯ«┐Я«░Я«ЪЯ»ЇЯ«џЯ«┐Я«ЋЯ«│Я»Ї Я«ЁЯ«хЯ«▒Я»ЇЯ«▒Я«┐Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»ѕЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«еЯ»ђЯ«▓Я««Я»Ї, Я««Я«ъЯ»ЇЯ«џЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«џЯ«┐Я«хЯ«фЯ»ЇЯ«фЯ»Ђ Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«хЯ»єЯ«хЯ»ЇЯ«хЯ»ЄЯ«▒Я»Ђ Я«еЯ«┐Я«▒Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«хЯ«┤Я«ЎЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
S2O32-+2H+ Рєњ S(sol)+H2O+SO2
3) Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ»Ї Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«цЯ«»Я«ЙЯ«░Я«┐Я«фЯ»ЇЯ«фЯ»Ђ:
Я«фЯ«ЙЯ«ИЯ»ЇЯ«фЯ«░Я«ИЯ»Ї Я«ЁЯ«▓Я»ЇЯ«▓Я«цЯ»Ђ Я«џЯ«▓Я»ЇЯ«фЯ«░Я»Ї Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«џЯ«┐Я«▓ Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«єЯ«▓Я»ЇЯ«ЋЯ«╣Я«ЙЯ«▓Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«цЯ»ЇЯ«цЯ»Ђ, Я«ЁЯ«ЋЯ»ЇЯ«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ѕ Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«іЯ«▒Я»ЇЯ«▒Я»ЂЯ«хЯ«цЯ«ЕЯ»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я«ЋЯ»Ї Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї Я«фЯ»єЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е. Я«ЄЯ«хЯ»ѕ Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«»Я«ЙЯ«ц Я«ЋЯ«ЙЯ«░Я«БЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«ЋЯ»ѓЯ«┤Я»ЇЯ«« Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е.
Я«єЯ«▓Я»ЇЯ«ЋЯ«╣Я«ЙЯ«▓Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ P + Я«еЯ»ђЯ«░Я»Ї Рєњ P(Я«ЋЯ»ѓЯ«┤Я»ЇЯ««Я««Я»Ї).