வாயுக்களின் இயக்கவியற் கொள்கை - சராசரி இருமடிமூல வேகம் | 11th Physics : UNIT 9 : Kinetic Theory of Gases
11வது இயற்பியல் : அலகு 9 : வாயுக்களின் இயக்கவியற் கொள்கை
சராசரி இருமடிமூல வேகம்
சராசரி இருமடிமூல வேகம் (vrms)
அனைத்து மூலக்கூறுகளின் இருமடி வேகங்களின் சராசரியின் இருமடிமூல மதிப்பு என இதனை வரையறுக்கலாம். இதை பின்வருமாறு எழுதலாம்.
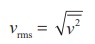
சமன்பாடு (9.8) ஐ மாற்றியமைக்கும்போது

சராசரி இருமடிமூல வேகம்
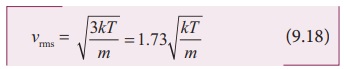
சமன்பாடு (9.18) இல் இருந்து பின்வருவனவற்றை நாம் அறிந்து கொள்ளலாம்.
i. சராசரி இருமடி மூல வேகமானது கெல்வின் வெப்பநிலையின் இருமடி மூலத்திற்கு நேர்த்தகவிலும், மூலக்கூறு நிறையின் இருமடி மூலத்திற்கு எதிர்த்தகவிலும் இருக்கும். எனவே கொடுக்கப்பட்ட வெப்பநிலையில் குறைந்த நிறைகொண்ட மூலக்கூறுகளின் சராசரி வேகம், அதிக நிறை கொண்ட மூலக்கூறுகளின் சராசரி வேகத்தைவிட அதிகமாக இருக்கும்.
எடுத்துக்காட்டு: ஒரே வெப்பநிலையில் இலேசான மூலக்கூறுகளான ஹைட்ரஜன் மற்றும் ஹீலியம் போன்றவற்றின் சராசரி இருமடி மூலத்திசைவேகம் (vrms) கனமான மூலக்கூறுகளான ஆக்ஸிஜன் மற்றும் நைட்ரஜன் போன்றவற்றின் (vrms) மதிப்பைவிட அதிகமாக இருக்கும்.
ii. வெப்பநிலை உயரும்போது வாயுமூலக்கூறுகளின் சராசரி இருமடிமூல வேகமும் (vrms) அதிகரிக்கும்.
வாயு மாறிலி R ஐப் பயன்படுத்தி vrms சமன்பாட்டினை பின்வருமாறு அமைக்கலாம். சமன்பாடு (9.18) லிருந்து
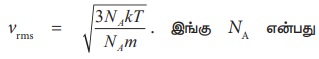
அவகாட்ரோ எண் ஆகும்.
இங்கு NAk = R மற்றும் NAm = M (மூலக்கூறு நிறை) ஆகும்
எனவே, சராசரி இருமடி மூலவேகம் அல்லது rms வேகம் என்பது

சமன்பாடு (9.6) ஐ சராசரி இருமடி மூல வேகத்தின் அடிப்படையில் பின்ருமாறு எழுதலாம்.

குறிப்பு
சராசரி இருமடி மூல வேகமானது, சராசரி வேகத்திற்குச் சமமானதல்ல. வேகமானது, இருமடி மூல வேகத்தைப் போன்று 0.92 மடங்காகும்.
சராசரி இருமடி மூல வேகம் (vrms) இயற்கையில் ஏற்படுத்தும் விளைவுகள் :
1. நிலவில் வளிமண்டலம் அற்ற நிலை.
நிலவின் குறைந்த ஈர்ப்புவிசையின் காரணமாக, நிலவுப் பரப்பில் உள்ள வாயுக்களின் சராசரி இருமடி மூல வேகமானது அதன் விடுபடு வேகத்தைவிட அதிகமாக உள்ளது. இதன் காரணமாக நிலவுப்பரப்பில் உள்ள அனைத்து வாயுக்களும் நிலவிலிருந்து வெளியேறி விடுகின்றன. .
2. புவியின் வளிமண்டலத்தில் ஹைட்ரஜன் வாயுவற்ற நிலை. ஹைட்ரஜன் வாயுவின் சராசரி இருமடி மூல வேகமானது, நைட்ரஜனைவிட மிகவும் அதிகமானது. எனவே ஹைட்ரஜன் புவியின் வளிமண்டலத்திலிருந்து எளிதாகத் தப்பிச்சென்றுவிடும். உண்மையில், தீங்கு விளைவிக்காத நைட்ரஜன் வாயுவிற்குப் பதிலாக, புவியின் வளிமண்டலத்தில் ஹைட்ரஜன் வாயு நிறைந்திருந்தால், அது பல்வேறு வகையான பேராபத்துக்களை ஏற்படுத்தியிருக்கும்.
எடுத்துக்காட்டு 9.2
அறை ஒன்றினுள் 3:1 என்ற விகிதத்தில் ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறுகள் உள்ளன. அறையின் வெப்பநிலை 27°C ஆக்ஸிஜன் (O2) மற்றும் ஹைட்ரஜன் (H2) இவற்றின் மூலக்கூறு நிறைகள் முறையே 32 g mol-1 மற்றும் 2 g mol-1 ஆகும். வாயு மாறிலி R = 8.32 J mol-1 K-1 எனில் பின்வருவனவற்றைக் கணக்கிடுக.
(a) ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இருமடி மூலவேகம்.
(b) ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறு ஒன்றின் சராசரி இயக்க ஆற்றல்.
(c) ஆக்ஸிஜன் மூலக்கூறுகள் மற்றும் ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலின் விகிதம்.
தீர்வு :
(a) கெல்வின் வெப்பநிலை
T=27°C =27+273=300 K.
வாயு மாறிலி R = 8.32 J mol-1K-1
ஆக்ஸிஜன் மூலக்கூறின் vrms
மூலக்கூறு நிறை M = 32 g = 3 × 10-3 kg mol-1
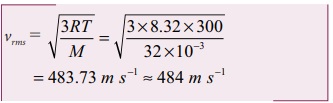
ஹைட்ரஜன் மூலக்கூறின் vrms
மூலக்கூறு நிறை M = 2 × 10-3 kg mol-1
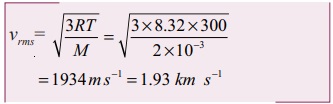
சராசரி இருமடி மூல வேகம் vrms ஆனது √M க்கு எதிர்விகிதத்தில் உள்ளதை இங்கு கவனிக்க வேண்டும். ஆக்ஸிஜனின் மூலக்கூறு நிறை ஹைட்ரஜனின் மூலக்கூறு நிறையை விட 16 மடங்கு அதிகம். இதிலிருந்து நாம் அறிவது என்னவென்றால் ஒரே வெப்பநிலையில் ஹைட்ரஜனின் சராசரி இருமடி மூல வேகம் (vrms), ஆக்ஸிஜனைவிட 4 மடங்கு அதிகமாகும். கணக்கீட்டிலிருந்து 1934/484 ≈ 4 ஆகும்.
(b) மூலக்கூறு ஒன்றின் சராசரி இயக்க ஆற்றல் 3/2 kT. இது வாயுவின் கெல்வின் வெப்பநிலையை மட்டுமே சார்ந்துள்ளது. மேலும் வாயுவின் தன்மையைச் சார்ந்ததல்ல. இரண்டு வாயுக்களின் மூலக்கூறுகளும் ஒரே கெல்வின் வெப்பநிலையில் உள்ளதால் அவற்றின் ஒவ்வொரு மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலும் ஒரே மதிப்பைப் பெற்றிருக்கும். இங்கு k என்பது போல்ட்ஸ்மென் மாறிலியாகும்.
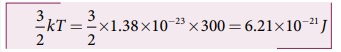
(c) அனைத்து ஆக்ஸிஜன் மூலக்கூறுகளின் சராசரி இயக்க ஆற்றல் 3/2 N0kT இங்கு N0. என்பது அறையில் உள்ள ஆக்ஸிஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கையாகும்.
அனைத்து ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இயக்க ஆற்றல் = 3/2 NHkT. இங்கு NH என்பது அறையில் உள்ள ஹைட்ரஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கையாகும்.
கொடுக்கப்பட்ட கணக்கிலிருந்து, அறையிலுள்ள ஆக்ஸிஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கை ஹைட்ரஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கையைவிட 3 மடங்கு அதிகம். எனவே ஆக்ஸிஜன் மூலக்கூறுகளின் மொத்த சராசரி இயக்க ஆற்றலுக்கும் ஹைட்ரஜன் மூலக்கூறுகளின் மொத்த சராசரி இயக்க ஆற்றலுக்கும் உள்ள விகிதம் 3:1 ஆகும்.