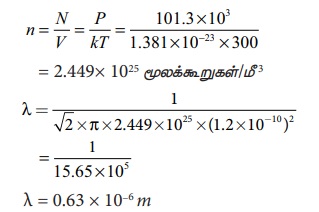11வது இயற்பியல் : அலகு 9 : வாயுக்களின் இயக்கவியற் கொள்கை
தீர்க்கப்பட்ட எடுத்துக்காட்டு கணக்குகள்: இயற்பியல் : வாயுக்களின் இயக்கவியற் கொள்கை
வாயுக்களின் இயக்கவியற் கொள்கை (இயற்பியல்)
பயிற்சிக் கணக்குகள்
1. தூயக்காற்றில் (78%) நைட்ரஜனும் (N2), (21%) ஆக்ஸிஜனும் (O2) உள்ளன. 20C வெப்பநிலையில் N2 மற்றும் O2 வின் சராசரி இருமடி மூல வேகத்தைக் (Vrms) காண்க.
தீர்வு :
1) நைட்ரஜனில் (N2),
மோலார் நிறை (m) = 0.0280 Kg/mol
வெப்பநிலை T = 20°C = 20 + 273 = 293 K
R = 8.314 J/mol K

ii) தூயக்காற்றில் (O2),
மோலார் நிறை M = 0.0320 kg/mol

விடை: For vrms = 511 m s-1
For O2vrms = 478 m s-1
2. வியாழன் கோளின் வளிமண்டலத்திலுள்ள மீத்தேன் வாயுவின் சராசரி இருமடி மூல வேகம் 471.8 ms-1 ஆகும். இம்மதிப்பின் அடிப்படையில் வியாழன் கோளின் பரப்பு வெப்பநிலை செல்சியஸ் அளவில் சுழிக்கு கீழே உள்ளது எனக்காட்டுக.
தீர்வு :
மீத்தேன் வாயுவின் RMS வேகம் = 471.8 ms-1 (Vrms)
சுழி வெப்பநிலைக்கு கீழே, மீத்தேன் வாயுவின் மூலக்கூறு நிறை m = 16.04 x 10-3 kg/mol
வியாழன் மண்டலத்திலுள்ள வெப்பநிலை T = ?

T = -130°C
எனவே வியாழன் கோளின் பரப்பு வெப்பநிலை செல்சியஸ் அளவில் சுழிக்கு கீழே உள்ளது என அறியலாம்.
விடை: -130°C
3. பழத்தர வெப்பநிலை மற்றும் அழுத்தத்தில், எந்த வெப்பநிலையில் வாயு ஒன்றின் சராசரி இருமடி மூல வேகம் அவ்வாயுவின் படித்தர வெப்பநிலை மற்றும் அழுத்தத்தில் உள்ள மதிப்பை போன்று மும்மடங்காக அதிகரிக்கும்? [படித்தர வெப்பநிலை T1 = 273K]
தீர்வு:
S.T.P- யில் வெப்பநிலை = T1 = 273K
வாயுவின் சராசரி இருமடி மூல வேகம் Vrms 1 = V
வாயுவின் RMS வேகம் மும்மடங்கு அதிகரிக்கும் போது, V rms 2 = 3V
புதிய வெப்பநிலை Vrms 2 = ?
T2 = ?
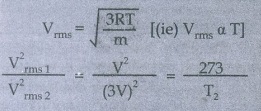
T2 = 273 × 9
T2 = 2457 K
விடை : T1 = 273 K, T2 = 2457 K
4. 80°C வெப்பநிலை மற்றும் 5 × 10-10 Nm-2 அழுத்தத்திலும் உள்ள வாயு ஒன்றின் ஓரலகு பருமனில் (1m3) உள்ள மூலக்கூறுகளின் எண்ணிக்கையைக் காண்க. (இங்கு போல்ஸ்ட்மென் மாறிலியின் மதிப்பு 1.38 × 10-23 JK-1).
தீர்வு :
வாயுவின் வெப்பநிலை
T = 80°C ⇒ 80 + 273 = 353 k
வாயுவின் அழுத்தம் P = 5 × 10-10 Nm-2
போல்ட்ஸ்மேன் மாறிலி k = 1.38 × 10-23 JK-1
வாயுவின் பருமன் V = 1m3
மூலக்கூறுகளின் எண்ணிக்கை n = ?

விடை : 1.02 × 1011
5. 2 × 103ms-1 வேகத்தில் இயங்கும் ஆக்ஸிஜன் மூலக்கூறுகள் கொள்கலன் ஒன்றில் அடைத்து வைக்கப் பட்டுள்ளன. 4cm2 சுவரின் பரப்பை ஒரு வினாடிக்கு 1020 முறை இந்த ஆக்ஸிஜன் மூலக்கூறுகள் செங்குத்துத்தளத்துடன் 30° கோணத்தில் தாக்குகின்றன எனில், அம்மூலக்கூறுகள் சுவற்றில் ஏற்படுத்தும் அழுத்தத்தினைக் காண்க. (ஒரு அணுவின் நிறை = 1.67 × 10-27kg)
தீர்வு:
ஒரு ஆக்ஸிஜன் அணுவின் நிறை = 2.67 × 10-26 kg
ஃ. ஆக்ஸிஜன் மூலக்கூறின் நிறை = 5.34 × 10-26 kg
திசைவேகம் v = 2 × 103 ms-1
பரப்பளவு A = 4cm2 = 4 × 10-4 m2
θ = 30° N = 1020
∆p = mv cos 30° × 2
F = N ∆ P
= 1020 × mv × cos 30° × 2

6. வெப்ப பரிமாற்றமில்லா நிகழ்வு ஒன்றில், ஓரணு மற்றம் ஈரணு வாயுக்கலவையின் அழுத்தம் அதன் வெப்பநிலையின் மும்மடிக்கு நேர்விகிதத்தில் உள்ளது எனில் γ = (Cp /CV) இன்மதிப்பைக் காண்க.
தீர்வு :
வெப்ப பரிமாற்றமில்லா நிகழ்வில், P1-γ Tγ = மாறிலி
P α T3

விடை: 3/2
7. படித்தர வெப்பநிலை மற்றும் அழுத்தத்தில் உள்ள காற்று மூலக்கூறு ஒன்றின் சராசரி மோதலிடைத் தூரத்தைக் காண்க. N2 மற்றும் O2 மூலக்கூறுகளின் சராசரி விட்டம் கிட்டத்தட்ட 3 × 10-10 m ஆகும்.
தீர்வு :
N2 மற்றும் O2 மூலக்கூறுகளின் சராசரி
விட்டம் d = 3 × 10-10m

சராசரி மோதலிடைத் தூரம் λ = 9.31 × 10-8 m ஆகும்.
8. 2 மோல் ஆக்ஸிஜனும் 4 மோல் ஆர்கானும் சேர்ந்த வாயுக்கலவையின் கெல்வின் வெப்பநிலை T என்க. RT யின் மதிப்பில் அவ்வாயுக்கலவையின் அக ஆற்றலைக் காண்க. (இங்கு வாயு மூலக்கூறுகளின் அதிர்வை புறக்கணிக்கவும்).
தீர்வு:
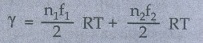
f = சுதந்திர இயக்கக்கூறுகளின் எண்ணிக்கை
f1 = ஈரணு வாயுவிற்கு = 5
f2 = ஓரணு வாயுவிற்கு = 3
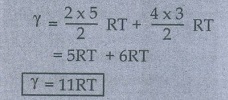
வாயுக்கலவையின் அக ஆற்றல் γ = 11RT ஆகும்.
9. 25m3 பருமனுள்ள அறை ஒன்றின் வெப்பநிலை 27°C இவ்வறையினுள் உள்ள காற்று மூலக்கூறுகளின் எண்ணிக்கையைக் காண்க.
தீர்வு:
அறையின் பருமன் V = 25m3
அறையின் வெப்பநிலை T = 27°C = 27 + 273 = 300k
அறையின் அழுத்தம் P = 1 × 1.013 × 105 Pa
PV = kBNT (என்பது நாமறிந்ததே)
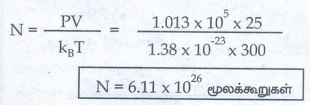
அறையிலுள்ள காற்று மூலக்கூறுகளின் எண்ணிக்கை N = 6.11 × 1026 மூலக்கூறுகள் ஆகும்.
தீர்க்கப்பட்ட எடுத்துக்காட்டு கணக்குகள்
தீர்க்கப்பட்ட எடுத்துக்காட்டு கணக்குகள் வாயு ஒன்றினால் ஏற்படும் அழுத்தத்திற்கான கோவை
எடுத்துக்காட்டு 9.1
27°C வெப்பநிலையில் உள்ள கால்பந்து ஒன்றினுள் 0.5 மோல் காற்று மூலக்கூறுகள் உள்ளன. கால்பந்தின் உள்ளே உள்ள காற்றின் அக ஆற்றலைக் கண்டுபிடி.
தீர்வு:
நல்லியல்பு வாயுவின் அக ஆற்றல் 3/2 NkT. காற்று மூலக்கூறுகளின் எண்ணிக்கை மோல்களின் எண்ணிக்கையில் கொடுக்கப்பட்டுள்ளது. எனவே சமன்பாட்டை பின்வரும் வடிவில் எழுத வேண்டும்.
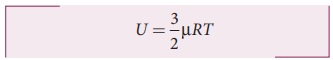
இங்கு Nk = μR (μ என்பது மோல்களின் எண்ணிக்கையாகும்)
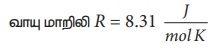
கெல்வின் வெப்பநிலை T = 273 + 27°C = 300 K
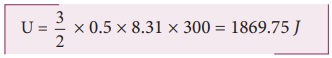
இம்மதிப்பு, 57 kg நிறையுள்ள மனிதரொருவர் 8 ms-1 வேகத்தில் ஓடும்போது அவர் பெற்றிருக்கும் இயக்க ஆற்றலுக்குச் சமமானதாகும்.
எடுத்துக்காட்டு 9.2 (சராசரி இருமடிமூல வேகம்)
அறை ஒன்றினுள் 3:1 என்ற விகிதத்தில் ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறுகள் உள்ளன. அறையின் வெப்பநிலை 27°C ஆக்ஸிஜன் (O2) மற்றும் ஹைட்ரஜன் (H2) இவற்றின் மூலக்கூறு நிறைகள் முறையே 32 g mol-1 மற்றும் 2 g mol-1 ஆகும். வாயு மாறிலி R = 8.32 J mol-1 K-1 எனில் பின்வருவனவற்றைக் கணக்கிடுக.
(a) ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இருமடி மூலவேகம்.
(b) ஆக்ஸிஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறு ஒன்றின் சராசரி இயக்க ஆற்றல்.
(c) ஆக்ஸிஜன் மூலக்கூறுகள் மற்றும் ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலின் விகிதம்.
தீர்வு :
(a) கெல்வின் வெப்பநிலை
T=27°C =27+273=300 K.
வாயு மாறிலி R = 8.32 J mol-1K-1
ஆக்ஸிஜன் மூலக்கூறின் vrms
மூலக்கூறு நிறை M = 32 g = 3 × 10-3 kg mol-1
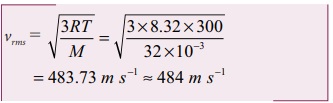
ஹைட்ரஜன் மூலக்கூறின் vrms
மூலக்கூறு நிறை M = 2 × 10-3 kg mol-1
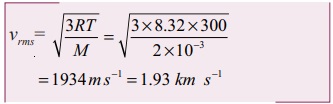
சராசரி இருமடி மூல வேகம் vrms ஆனது √M க்கு எதிர்விகிதத்தில் உள்ளதை இங்கு கவனிக்க வேண்டும். ஆக்ஸிஜனின் மூலக்கூறு நிறை ஹைட்ரஜனின் மூலக்கூறு நிறையை விட 16 மடங்கு அதிகம். இதிலிருந்து நாம் அறிவது என்னவென்றால் ஒரே வெப்பநிலையில் ஹைட்ரஜனின் சராசரி இருமடி மூல வேகம் (vrms), ஆக்ஸிஜனைவிட 4 மடங்கு அதிகமாகும். கணக்கீட்டிலிருந்து 1934/484 ≈ 4 ஆகும்.
(b) மூலக்கூறு ஒன்றின் சராசரி இயக்க ஆற்றல் 3/2 kT. இது வாயுவின் கெல்வின் வெப்பநிலையை மட்டுமே சார்ந்துள்ளது. மேலும் வாயுவின் தன்மையைச் சார்ந்ததல்ல. இரண்டு வாயுக்களின் மூலக்கூறுகளும் ஒரே கெல்வின் வெப்பநிலையில் உள்ளதால் அவற்றின் ஒவ்வொரு மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலும் ஒரே மதிப்பைப் பெற்றிருக்கும். இங்கு k என்பது போல்ட்ஸ்மென் மாறிலியாகும்.
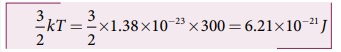
(c) அனைத்து ஆக்ஸிஜன் மூலக்கூறுகளின் சராசரி இயக்க ஆற்றல் 3/2 N0kT இங்கு N0. என்பது அறையில் உள்ள ஆக்ஸிஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கையாகும்.
அனைத்து ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இயக்க ஆற்றல் = 3/2 NHkT. இங்கு NH என்பது அறையில் உள்ள ஹைட்ரஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கையாகும்.
கொடுக்கப்பட்ட கணக்கிலிருந்து, அறையிலுள்ள ஆக்ஸிஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கை ஹைட்ரஜன் மூலக்கூறுகளின் மொத்த எண்ணிக்கையைவிட 3 மடங்கு அதிகம். எனவே ஆக்ஸிஜன் மூலக்கூறுகளின் மொத்த சராசரி இயக்க ஆற்றலுக்கும் ஹைட்ரஜன் மூலக்கூறுகளின் மொத்த சராசரி இயக்க ஆற்றலுக்கும் உள்ள விகிதம் 3:1 ஆகும்.
எடுத்துக்காட்டு 9.3
அறை ஒன்றில் இயக்கத்திலுள்ள பத்து வாயு மூலக்கூறுகளின் வேகங்கள் முறையே 2, 3, 4, 5, 5, 5, 6, 6, 7 மற்றும் 9 m s-1 ஆகும். இவற்றின் சராசரி இருமடி மூல வேகம், சராசரி வேகம் (PPP) மற்றும் மிகவும் சாத்தியமான வேகம் (vrmp) இவற்றைக் காண்க.
தீர்வு:
சராசரி வேகம்
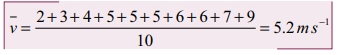
சராசரி இருமடி மூல வேகத்தைக் கணக்கிட முதலில் வேகங்களின் இருமடியின் சராசரியைக்![]() கணக்கிட வேண்டும்.
கணக்கிட வேண்டும்.
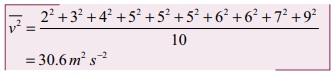
சராசரி இருமடிமூல வேகம்
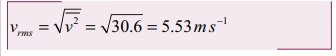
மிகவும் சாத்தியமான வேகம் vmp என்பது 5ms-1. ஏனெனில் கொடுக்கப்பட்டவற்றுள் மூன்று மூலக்கூறுகள் இவ்வேகத்தைப் பெற்றுள்ளன.
எடுத்துக்காட்டு 9.4
300 K வெப்பநிலையிலுள்ள 1 மோல் ஹைட்ரஜன் மூலக்கூறுகளின் சராசரி இருமடிமூல வேகம் (vrms) சராசரி வேகம் ![]() மற்றும் சாத்தியமான வேகம் (vmp) ஆகியவற்றைக் காண்க. இங்கு எலக்ட்ரானின் நிறையை புறக்கணிக்கவும்.
மற்றும் சாத்தியமான வேகம் (vmp) ஆகியவற்றைக் காண்க. இங்கு எலக்ட்ரானின் நிறையை புறக்கணிக்கவும்.
தீர்வு:
ஹைட்ரஜன் அணு ஒரு புரோட்டானையும் ஒரு எலக்ட்ரானையும் பெற்றுள்ளது, புரோட்டானின் நிறையுடன் ஒப்பிடும்போது எலக்ட்ரானின் நிறையை புறக்கணிக்கலாம்.
புரோட்டானின் நிறை = 1.67 × 10-27 kg.
ஒரு ஹைட்ரஜன் மூலக்கூறு = 2 ஹைட்ரஜன் அணுக்கள் = 2 × 1.67 × 10-27 kg.
சராசரி வேகம்
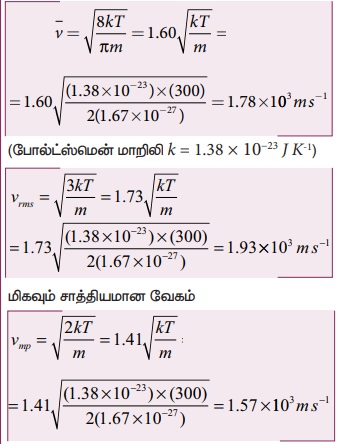
இங்கு 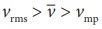 என்பதைக் கவனிக்கவும்.
என்பதைக் கவனிக்கவும்.
தீர்க்கப்பட்ட எடுத்துக்காட்டு கணக்குகள் ஆற்றல் சமபங்கீட்டு
விதி
எடுத்துக்காட்டு 9.5
இயல்பு வெப்பநிலையிலுள்ள (27°C) ஓரணு வாயு மூலக்கூறுகள் மற்றும் ஈரணு வாயு மூலக்கூறுகளின் அளவுகள் முறையே μ1 மோல் மற்றும் μ2 மோல் ஆகும். இவ்வாயுக்கலவையின் வெப்பபரிமாற்றமில்லா அடுக்குக்குறியீடு γ வின் மதிப்பைக் கணக்கிடுக.
தீர்வு
ஒரு மோல் ஓரணுவாயு மூலக்கூறின் பருமன் மாறா மோலார் தன்வெப்ப ஏற்புத்திறன் Cv = 3/2R μ1 மோல் வாயுவிற்கு,
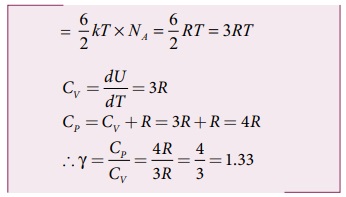
ஒரு மோல் ஈரணு வாயு மூலக்கூறின் பருமன் மாறா மோலார் தன்வெப்ப ஏற்புத்திறன் Cv = 5/2R μ2 மோல் வாயுவிற்கு,
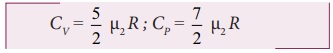
வாயுக்கலவையின் பருமன் மாறா மோலார் தன்வெப்ப ஏற்புத்திறன்

வாயுக்கலவையின் அழுத்தம் மாறா மோலார் தன்வெப்ப ஏற்புத்திறன்
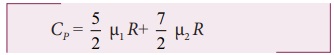
வெப்ப பரிமாற்றமில்லா அடுக்குக் குறியீடு
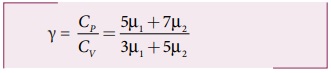
தீர்க்கப்பட்ட எடுத்துக்காட்டு கணக்குகள் சராசரி மோதலிடைத்தூரம்
எடுத்துக்காட்டு 9.6
300 K வெப்பநிலை மற்றும் 1 வளி மண்டல அழுத்தத்தில் உள்ள ஆக்ஸிஜன் மூலக்கூறு ஒன்று காற்றில் பயணிக்கிறது. ஆக்ஸிஜன் மூலக்கூறின் விட்டம் 1.2 × 10−10m எனில் அதன் சராசரி மோதலிடைத்தூரத்தைக் காண்க.
தீர்வு
சமன்பாடு (9.26) இலிருந்து 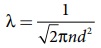
நல்லியல்பு வாயுச் சமன்பாட்டிலிருந்து நாம் எண் அடர்த்தி n ஐக் கணக்கிட வேண்டும்.