12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 12 : கார்பனைல் சேர்மங்கள் மற்றும் கார்பாக்சிலிக் அமிலங்கள்
கார்பனைல் தொகுதியின் அமைப்பு
கார்பனைல் தொகுதியின் அமைப்பு
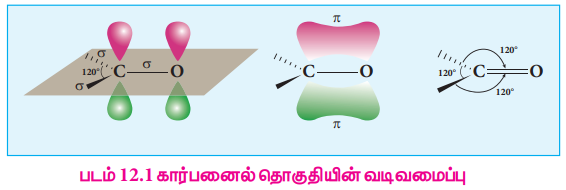
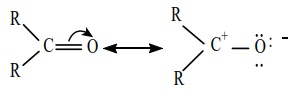
கார்பனைல் கார்பனானது 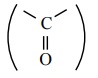 Sp2 இனக்கலப்படைந்த நிலையில் காணப்படுகிறது. மேலும், கார்பன் - ஆக்சிஜன் பிணைப்பானது, ஆல்கீன்களின் கார்பன் - கார்பன் இரட்டைப் பிணைப்பை ஒத்துள்ளது. கார்பனைல் கார்பனானது மூன்று Sp2 இனக்கலப்படைந்த ஆர்பிட்டால்களைப் பயன்படுத்தி மூன்று - பிணைப்புகளை உருவாக்குகிறது. ஆல்டிஹைடுகளில், ஆக்சிஜனுடன் ஒரு - பிணைப்பும் மேலும் ஹைட்ரஜன் மற்றும் கார்பனுடன் தலா ஒரு - பிணைப்பும் உருவாகிறது. கீட்டோன்களில் ஆக்சிஜனுடன் ஒரு 5 பிணைப்பும் மேலும் கார்பன்களுடன் மற்ற இரு - பிணைப்புகள் உருவாகின்றன. படம் 12.1 ல் காட்டியவாறு, மேற்குறிப்பிட்டுள்ள மூன்று . பிணைப்புகளும் ஒரே தளத்தில் அமைந்துள்ளன. கார்பனின் நான்காவது இணைத்திற எலக்ட்ரான் அதன் இனக்கலப்படையாத 2P ஆர்ப்பிட்டாலில் காணப்படுகிறது. இந்த ஆர்ப்பிட்டால் தளத்திற்கு செங்குத்தாக காணப்படுகிறது. மேலும், இது ஆக்சிஜனின் 2P ஆர்ப்பிட்டாலுடன் மேற்பொருந்தி ஒரு கார்பன் - ஆக்சிஜன் - உருவாக்குகிறது. ஆக்சிஜன் அணுவானது இரு பிணைப்பில் ஈடுபடா இரட்டை எலக்ட்ரான்களை கொண்டுள்ளது. இந்த எலக்ட்ரான்கள் அதன் மீதமுள்ள 2P ஆர்ப்பிட்டால்களின் இடம் பெறுகின்றன. இரண்டாவது அதிக எலக்ட்ரான் கவர் தன்மையுடைய தனிமமான ஆக்சிஜனானது, கார்பன் மற்றும் ஆக்சிஜனுக்கு இடையே பங்கிடப்பட்டுள்ள எலக்ட்ரான்களை தன்னை நோக்கி கவர்கிறது. எனவே, பிணைப்பானது முனைவு தன்மை பெறுகிறது. இம் முனைவு தன்மையானது ஆல்டிஹைடுகள் மற்றும் கீட்டோன்களில் வினைபுரியும் தன்மைக்கு காரணமாக அமைகின்றன.
Sp2 இனக்கலப்படைந்த நிலையில் காணப்படுகிறது. மேலும், கார்பன் - ஆக்சிஜன் பிணைப்பானது, ஆல்கீன்களின் கார்பன் - கார்பன் இரட்டைப் பிணைப்பை ஒத்துள்ளது. கார்பனைல் கார்பனானது மூன்று Sp2 இனக்கலப்படைந்த ஆர்பிட்டால்களைப் பயன்படுத்தி மூன்று - பிணைப்புகளை உருவாக்குகிறது. ஆல்டிஹைடுகளில், ஆக்சிஜனுடன் ஒரு - பிணைப்பும் மேலும் ஹைட்ரஜன் மற்றும் கார்பனுடன் தலா ஒரு - பிணைப்பும் உருவாகிறது. கீட்டோன்களில் ஆக்சிஜனுடன் ஒரு 5 பிணைப்பும் மேலும் கார்பன்களுடன் மற்ற இரு - பிணைப்புகள் உருவாகின்றன. படம் 12.1 ல் காட்டியவாறு, மேற்குறிப்பிட்டுள்ள மூன்று . பிணைப்புகளும் ஒரே தளத்தில் அமைந்துள்ளன. கார்பனின் நான்காவது இணைத்திற எலக்ட்ரான் அதன் இனக்கலப்படையாத 2P ஆர்ப்பிட்டாலில் காணப்படுகிறது. இந்த ஆர்ப்பிட்டால் தளத்திற்கு செங்குத்தாக காணப்படுகிறது. மேலும், இது ஆக்சிஜனின் 2P ஆர்ப்பிட்டாலுடன் மேற்பொருந்தி ஒரு கார்பன் - ஆக்சிஜன் - உருவாக்குகிறது. ஆக்சிஜன் அணுவானது இரு பிணைப்பில் ஈடுபடா இரட்டை எலக்ட்ரான்களை கொண்டுள்ளது. இந்த எலக்ட்ரான்கள் அதன் மீதமுள்ள 2P ஆர்ப்பிட்டால்களின் இடம் பெறுகின்றன. இரண்டாவது அதிக எலக்ட்ரான் கவர் தன்மையுடைய தனிமமான ஆக்சிஜனானது, கார்பன் மற்றும் ஆக்சிஜனுக்கு இடையே பங்கிடப்பட்டுள்ள எலக்ட்ரான்களை தன்னை நோக்கி கவர்கிறது. எனவே, பிணைப்பானது முனைவு தன்மை பெறுகிறது. இம் முனைவு தன்மையானது ஆல்டிஹைடுகள் மற்றும் கீட்டோன்களில் வினைபுரியும் தன்மைக்கு காரணமாக அமைகின்றன.
படம் 12.1 கார்பனைல் தொகுதியின் வடிவமைப்பு