தயாரித்தல், பண்புகள், அமைப்பு - அம்மோனியா | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
அம்மோனியா
அம்மோனியா (NH3)
தயாரித்தல்:
யூரியாவை நீராற்பகுப்பதன் மூலம் அம்மோனியா பெறப்படுகிறது.
NH2 CONH2 + H2O → 2NH3 + CO2
ஆய்வகத்தில் அம்மோனியம் உப்புக்களை, காரங்களுடன் சேர்த்து வெப்பப்படுத்தி நைட்ரஜன் தயாரிக்கப்படுகிறது.
2NH4+ + OH- → 2NH3 + H2O
2NH4Cl + Cao → CaC12 + 2NH3 + H2O
மெக்னீஷியம் நைட்ரைடு போன்ற உலோக நைட்ரைடுகளை நீருடன் சேர்த்து வெப்பப்படுத்துவதன் மூலமும் இதை தயாரிக்க இயலும்.
Mg3 N2 + 6H2O → 3Mg(OH)2 + 2NH3
இரும்பு வினைவேக மாற்றியின் மீது 750 K வெப்பநிலையில், 200 atm அழுத்தத்தில், நைட்ரஜன் மற்றும் ஹைட்ரஜன் வாயுக்கலவையை செலுத்துவதன் மூலம் தொழிற் முறையில் அம்மோனியா தயாரிக்கப்படுகிறது. (சமநிலையை விரைவாக அடைவதற்காக சிறிதளவு K2O மற்றும் A12O3 ஆகியனவும் பயன்படுத்தப்படுகின்றன ). உண்மையில், இவ்வினைக்குத் தேவையான ஹைட்ரஜன் நீர் வாயுவிலிருந்தும், திரவ காற்றை பின்ன வாலைவடித்து நைட்ரஜனும் பெறப்படுகின்றன.
பண்புகள்
அம்மோனியா காற்றைவிட லேசான, கார நெடியுடைய வாயுவாகும். இதை, ஏறத்தாழ 9 வளிமண்டல அழுத்தத்தால் எளிதில் திரவமாக்க இயலும். இத்திரவத்தின் கொதிநிலை -38.4°C மற்றும் உறைநிலை -77°C. திரவ அம்மோனியாவானது இயற் பண்புகளில் நீரை ஒத்துள்ளது. அதாவது, வலிமைமிக்க ஹைட்ரஜன் பிணைப்புகளால் மூலக்கூறுகள் ஒன்றிணைக்கப்படுள்ளன. அம்மோனியாவானது, 20°C மற்றும் 760mm அழுத்தத்தில் நீரில் மிக அதிகளவில் கரைகிறது. (1 கனஅளவு நீரில் 702கனஅளவு வீதம்)
குறைந்த வெப்பநிலைகளில், NH3.H2O மற்றும் 2NH3.H2O ஆகிய கரையும் தன்மைகொண்ட இரு வெவ்வெறு நீரேறிய மூலக்கூறுகள் பிரித்தெடுக்கப்பட்டுள்ளன. இந்த மூலக்கூறுகளில், அம்மோனியா மற்றும் நீர் மூலக்கூறுகள் ஹைட்ரஜன் பிணைப்புகளால் பிணைக்கப்பட்டுள்ளன. அம்மோனியாவானது, நீர்க்கரைசல்களிலும் இதே போல நீரேற்றம் அடைகிறது, மேலும் இதை நாம் (NH3.H2O) என குறிப்பிடுகிறோம்.
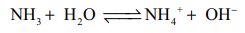
NH3 + H2ON ↔ H4+ OH
நீரைப்போன்றே, உயர் மின்கடத்தாப்பொருள் மாறிலி மதிப்பானது அம்மோனியாவை சிறந்த அயனியுறும் கரைப்பானாக செயல்படவைக்கிறது.
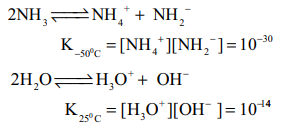
2NH3 ↔ NH4+ + NH2-
K−50C = [NH4+ ][NH2− ] = 10−30
2H2O ↔ H3O+ + OH−
K23 C = [H3O+ ][OH− ] = 10−14
வேதிப் பண்புகள்
வெப்பத்தின் விளைவு : 500°Cக்கு அதிகமான வெப்பநிலைகளில் அம்மோனியாவானது சிதைவடைந்து அதன் தனிமங்களாக மாறுகிறது. இந்த சிதைவு வினையானது நிக்கல், இரும்பு போன்ற உலோக வினைவேக மாற்றிகளினால் தூண்டப்படலாம். தொடர்ந்த மின்பாய்ச்சலின் போது அம்மோனியா முற்றிலுமாக சிதைவடைகிறது.
2NH3 → 500°C N2 + 3H2
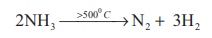
காற்று/ ஆக்ஸிஜனுடன் வினை : அம்மோனியா காற்றில் எரிவதில்லை, ஆனால், தூய ஆக்ஸிஜனில் மஞ்சள் சுவாலையுடன் எளிதாக எரிந்து நைட்ரஜன் வாயுவைத் தருகிறது.
4NH3 + 3O2 ↔ N2 + 6H2O
இது, பிளாட்டினம் போன்ற வினைவேக மாற்றியின் முன்னிலையில் எரிந்து நைட்ரிக் ஆக்சைடை உருவாக்குகிறது. இவ்வினையானது நைட்ரிக் அமிலம் தயாரிக்க பயன்படுகிறது, மேலும் இது ஆஸ்வால்ட்முறை என்றழைக்கப்படுகிறது.
4NH3 + 5O2 ↔ 4NO + 6H2O
ஒடுக்கும் பண்பு : அம்மோனியா ஒடுக்கும் காரணியாக செயல்படுகிறது. வெப்பப்படுத்தப்பட்ட உலோக ஆக்சைடுகளின் மீது செலுத்தும்போது அவற்றை உலோகங்களாக ஒடுக்குகின்றன.
3PbO + 2NH3 → 3Pb + N2 + 3H2O
அமிலங்களுடன் வினை: அமிலங்களுடன் வினைப்படுத்தும்போது இது அம்மோனியம் உப்புகளை உருவாக்குகிறது. புரோட்டான் மீதான அம்மோனியாவின் கவர்ச்சியானது நீரைவிட அதிகம் என்பதை இவ்வினை காட்டுகிறது. குளோரின் மற்றும் குளோரைடுகளுடன் வினை: குளோரின் மற்றும் குளோரைடுகளுடன் அம்மோனியா வினைப்புரிந்து இறுதி விளைபொருளாக அம்மோனியம் குளோரைடைத் தருகிறது. கீழே குறிப்பிட்டுள்ளவாறு, இந்த வினைகள் வெவ்வேறு சூழ்நிலைகளில் வெவ்வேறாக நிகழ்கின்றன. அதிகளவு அம்மோனியா உடன்
2 NH3 + 3 C12 → N2 + 6 HC1
6 HC1 + 6 NH3 → 6 NH4C1
அம்மோனியா, அதிகப்படியான குளோரினுடன் வினைப்பட்டு வெடிக்கும் தன்மையுடைய நைட்ரஜன் ட்ரைகுளோரைடைத் தருகிறது.
2 NH3 + 6 C12 → 2NC13 + 6 HC1
NH2(g) + HC1(g) → NH4C1 (s)

அமைடுகள் மற்றும் நைட்ரைடுகள் உருவாதல்: அம்மோனியா, அதிக நேர்மின்தன்மை கொண்ட சோடியம் போன்ற உலோகங்களுடன் அமைடுகளை உருவாக்குகிறது, ஆனால் மெக்னீஷியம் போன்ற உலோகங்களுடன் நைட்ரைடைத் தருகிறது.
2Na + 2NH3 → 2NaNH2 + H2
3Mg + 2NH3 → Mg3N2 + 3H2
உலோக உப்புக்களுடன் வினை : அம்மோனியா, உலோக உப்புக்களுடன் வினைப்பட்டு உலோக ஹைட்ராக்சைடுகள் (Fe உடன்) அல்லது அணைவுச்சேர்மங்களை (Cu உடன் )உருவாக்குகிறது.
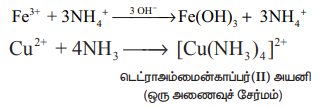
அமீன்கள் உருவாதல்: அயனி - இருமுனை கவர்ச்சியின் காரணமாக அம்மோனியா ஏற்றம் பெற்ற சேர்மங்களை அம்மோனியா உருவாக்குகிறது. எடுத்துக்காட்டு: [CaC128NH3). இதில், அம்மோனியா இருமுனையின் எதிர்முனைகள் Ca2+ அயனியை நோக்கி கவரப்படுகின்றன. அம்மோனியா மூலக்கூறானது ஈனியாகவும் செயல்பட்டு [Co(NH3)6]3+ [Ag(NH3)2]+ போன்ற அணைவுச் சேர்மங்களை உருவாக்குகிறது. எடுத்துக்காட்டாக, காப்பர் சல்பேட்டின் நீர்க்கரைசலுடன் அதிகளவு அம்மோனியாவைச் சேர்க்கும்போது அடர் நீல நிறம் கொண்ட சேர்மம் [Cu(NH3)4]2+ உருவாகிறது.
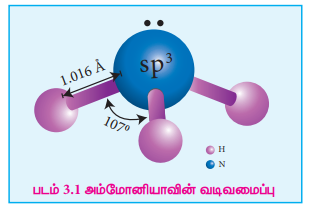
அம்மோனியாவின் வடிவமைப்பு:
அம்மோனியா மூலக்கூறானது பிரமிடு வடிவத்தில் உள்ளது. இதில், N-H பிணைப்பு நீளம் 1.016 A மற்றும் பிணைப்புக் கோண மதிப்பு 107o. ஒரு முனையில் ஒரு தனித்த இரட்டை எலக்ட்ரானைக் கொண்டுள்ள நான்முகி அமைப்பாக அம்மோனியாவின் வடிவமைப்பைக் கருத இயலும். எனவே இது படத்தில் காட்டியுள்ளவாறு பிரமிடு அமைப்புப் பெற்றுள்ளது.