தயாரித்தல், பண்புகள் - ஹைட்ரஜன் ஹைலைடுகளின் இயற் மற்றும் வேதிப் பண்புகளில் காணப்படும் போக்கு | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
ஹைட்ரஜன் ஹைலைடுகளின் இயற் மற்றும் வேதிப் பண்புகளில் காணப்படும் போக்கு
ஹைட்ரஜன் ஹைலைடுகளின் இயற் மற்றும் வேதிப் பண்புகளில் காணப்படும் போக்கு
தயாரித்தல்
ஹைட்ரஜன் குளோரைடை நேரடி இணைவின் மூலம் தயாரிக்கலாம். ஹைட்ரஜன் மற்றும் புளூரின் ஆகியவற்றிற்கிடையேயான வினை அதி தீவிரமானது. அதேநேரத்தில் புரோமின் மற்றும் அயோடின் ஆகியன ஹைட்ரஜனுடன் வினைபுரிதல் மீள்வினைகளாகும்.
இடப்பெயர்ச்சி வினைகள்
அடர் கந்தக அமிலம் அயனிக் குளோரைடுகளிலிருந்து ஹைட்ரஜன் குளோரைடை இடப்பெயர்ச்சி செய்கிறது. உயர் வெப்பநிலையில் உருவாகும் ஹைட்ரஜன் சல்பேட் மேலும் அயனி குளோரைடுடன் வினைபுரிகிறது. அயனி புளூரைடுகளிலிருந்து ஹைட்ரஜன் புளூரைடை தயாரிக்க இடப்பெயர்ச்சி வினைகள் பயன்படுகின்றன. ஹைட்ரஜன் புரோமைடு மற்றும் ஹைட்ரஜன் அயோடைடு ஆகியன அடர் கந்தக அமிலத்தால் ஆக்சிஜனேற்றம் அடைகின்றன. எனவே அவைகளை இம்முறையில் தயாரிக்க இயலாது.
பாஸ்பரஸ் ட்ரைஹேலைடுகளின் நீராற்பகுப்பு
பாஸ்பரஸ் ட்ரைபுளூரைடை தவிர்த்த பிற பாஸ்பரஸ் ஹேலைடுகளில் நீரை துளி துளியாக சேர்க்கும் போது வாயுநிலையில் உள்ள ஹைட்ரஜன்ஹேலைடுகள் உருவாகின்றன.
PX3 + 3H2O → H2PO3 + 3HX
சிகப்பு பாஸ்பரஸின் நீர்க் கலவையுடன் புரோமினை துளி துளியாக சேர்க்கும் போது ஹைட்ரஜன் புரோமைடு உருவாகிறது. இதைப்போலவே சிகப்பு பாஸ்பரஸ் மற்றும் அயோடினுடன் நீரை துளி துளியாக சேர்க்க ஹைட்ரஜன் அயோடைடு உருவாகிறது.
2P + 3X2 → 2PX3
2PX3 + 3H2O → H3PO3 + 3HX
(X=Br அல்லது I )
வாயுகளை ஈரமான சிகப்பு பாஸ்பரஸ் எடுத்துக்கொள்ளப்பட்ட கலத்தின் வழியே செலுத்தும் போது ஹைட்ரஜன் ஹேலைடுடன் வெளியேறும் ஹேலஜன் ஆவிகள் நீக்கப்படுகின்றன.
சகப்பிணைப்பு ஹைட்ரைடுகள்
சகப்பிணைப்பு ஹைட்ரைடுகளிலிருந்து பெறுதல். ஹேலஜன்கள் ஹைட்ரஜன் சல்பைடால் ஹைட்ரஜன் ஹேலைடுகளாக ஒடுக்கப்படுகின்றன.
H2S + X2 → 2HX + S
ஹைட்ரோ கார்பன் மற்றும் ஹேலஜன்களுக்கிடையேயான வினையில் துணை விளைப்பொருளாக ஹைட்ரஜன் குளோரைடு உருவாகிறது.
அட்டவணை 3.4 பொதுப்பண்புகள்
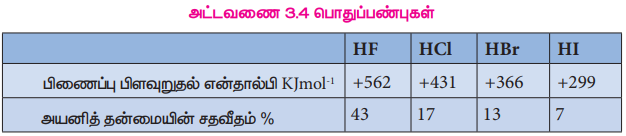
பிணைப்பு பிளவுறு என்தால்பி மதிப்பு குறைவதிலிருந்து ஹைட்ரஜன் ஹேலைடுகளின் வெப்பநிலைப்புத் தன்மையானது புளூரைடுகளிலிருந்து அயோடைடை நோக்கி வரும்போது குறைகிறது.
எடுத்துக்காட்டாக, ஹைட்ரஜன் அயோடைடு 400°C யில் சிதைவுறுகிறது. அதே வெப்பநிலையில் ஹைட்ரஜன் புளூரைடு மற்றும் ஹைட்ரஜன் குளோரைடு ஆகியன நிலைப்புத் தன்மையைப் பெற்றுள்ளன.
அறை வெப்பநிலையில், ஹைட்ரஜன் ஹேலைடுகள் வாயுக்கள் ஆனால் ஹைட்ரஜன் புளூரைடை எளிதில் திரவமாக்கலாம். இவ்வாயுக்கள் நிறமற்றவை. ஆனால் ஈரமான காற்றில் ஹைட்ரோ ஹேலிக் அமிலங்கள் உருவாவதால் அடர் புகையைத் தருகின்றன. HF யில் வலிமையான ஹைட்ரஜன் பிணைப்புக்காணப்படுவதால் அது உயர் உருகுநிலை மற்றும் கொதிநிலை மதிப்புகளைப் பெற்றுள்ளது. இப்பிணைப்பு மற்ற ஹைட்ரஜன் ஹேலைடுகளில் காணப்படுவதில்லை.
அமிலப் பண்புகள்
அயனியாதல் காரணமாக ஹைட்ரஜன் ஹேலைடுகள் நீரில் நன்கு கரைகின்றன.
HX + H2O H3O+ + X-
(X - F, C1, Br, அல்லது I)
ஹைட்ரஜன் ஹேலைடுகளின் நீரில் கரைசல் அமிலத் தன்மையுடையவை. மேலும் இவைகள் ஹைட்ரோ ஹேலிக் அமிலங்கள் என அழைக்கப்படுகின்றன. ஹைட்ரோ குளோரிக், ஹைட்ரோ புரோமிக், ஹைட்ரோ அயோடிக் அமிலங்கள் ஏறத்தாழ முழுவதும் அயனியுறுகின்றன. எனவே அவைகள் வலிமைமிக்க அமிலங்களாகும். ஆனால் HF ஆனது வலிமை குறை அமிலம். அதாவது 0.1M கரைசல் 10% மட்டுமே அயனியுறுகிறது. ஆனால் 5M மற்றும் 15M HF கரைசல்கள் பின்வரும் வேதிச் சமநிலையின் காரணமாக வலிமையான அமிலமாக செயல்படுகின்றன.
HF + H2O ↔ H3O+ + F-
HF + F ↔ HF2-
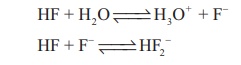
அதிகச் செறிவில், சமநிலையில் புளூரைடு அயனிகள் நீக்கப்படுதல் முக்கியத்துவம் பெறுகிறது. ஏனெனில் இது ஹைட்ரஜன் புளூரைடின் பிரிகையுறுதலை பாதிக்கிறது. மேலும் ஹைட்ரஜன் அயனியின் செறிவை அதிகரிக்கிறது. NaHF2, KHF2 மற்றும் NH4HF2 போன்ற பல நிலையான உப்புகள் அறியப்படுகின்றன. பிற ஹைட்ரஜன் ஹேலைடுகள் ஹைட்ரஜன் டைஹேலைடுகளை உருவாக்குவதில்லை.
ஹைட்ரோ ஹேலிக் அமிலங்கள் வழக்கமான அமில பண்புகளைப் பெற்றுள்ளன. இவைகள் காரங்களுடன் உப்புகளை தருகின்றன. மேலும் உலோங்களுடன் வினைபட்டு ஹைட்ரஜனை தருகின்றன. ஈரமான ஹைட்ரோ புளூரிக் அமிலமானது (உலர்ந்தது அல்ல). சிலிக்கா மற்றும் கண்ணாடியுடன் விரைவாக வினைபுரிகிறது.
SiO2 + 4HF → SiF4 + 2H2O
Na2SiO3 + 6HF → Na2SiF6 + 3H2O
ஆக்சிஜனேற்றம்: ஹைட்ரஜன் அயோடைடு எளிதாக அயோடினாக ஆக்சிஜனேற்றமடைகிறது. எனவே இது ஒரு ஒடுக்கும் காரணியாகும்.
2HI ↔ H+ + I2 + 2e-
அயோடைடுகளின் அமிலக் கரைசல் எளிதில் ஆக்சிஜனேற்றம் அடையும். அயோடின் வெளியேறுவதால் ஸ்டார்ச்சுடன் சேர்ந்து கரு நீல நிறம் உருவாகிறது. ஹைட்ரஜன் அயோடைடுன் ஒப்பிடும் போது ஹைட்ரஜன் புரோமைடை ஆக்சிஜனேற்றம் அடையச் செய்தல் மிகக் கடினமானதாகும். HBr ஆனது H2SO4 யை மெதுவாக ஒடுக்கி கந்தக டை ஆக்சைடாக மாற்றுகிறது.
2HBr + H2SO4 → 2H2O + Br2 + SO2
ஆனால் ஹைட்ரஜன் அயோடைடு மற்றும் அயனி தன்மையுடைய அயோடைடுகள் H2SO4 ஆல் விரைவாக ஒடுக்கமடைந்து H2S ஆக மாற்றமடைகிறது.
8HI + H2SO4 → 4H2O + 4I2 + H2S
ஆல்கஹால்களை ஈத்தேனாக மாற்றும் வினையில் ஹைட்ரஜன் அயோடைடு பயன்படுத்தப்படுகிறது. இவ்வினையிலிருந்தும் இதன் ஒடுக்கம் பண்பை விளக்கலாம். இது நைட்ரிக் அமிலத்தை நைட்ரஸ் அமிலமாகவும் மாற்றுகிறது. ஹைட்ரஜன் குளோரைடானது அடர் கந்தக அமிலத்தால் பாதிக்கப்படுவதில்லை. வலிமையான ஆக்சிஜனேற்றியான MnO2, பொட்டாசியம் பெர்மாங்கனேட் போன்றவற்றால் பாதிக்கப்படுகிறது. இந்த போக்கினை பின்வரும் அட்டவணையில் சுருக்கமாக பார்க்கலாம்.
அட்டவணை 3.5
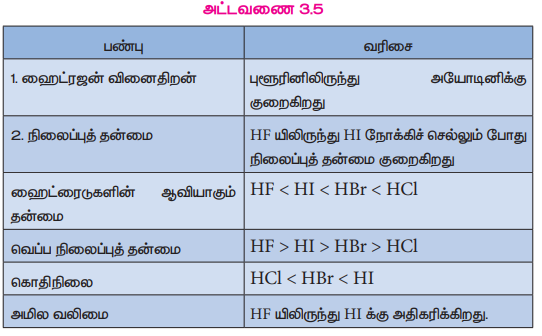
பண்பு | வரிசை
1. ஹைட்ரஜன் வினைதிறன் : புளூரினிலிருந்து அயோடினிக்கு குறைகிறது
2. நிலைப்புத் தன்மை : HF யிலிருந்து HI நோக்கிச் செல்லும் போது நிலைப்புத் தன்மை குறைகிறது
ஹைட்ரைடுகளின் ஆவியாகும் தன்மை : HF < HI < HBr < HCl
வெப்ப நிலைப்புத் தன்மை : HF > HI > HBr > HCl
கொதிநிலை : HCl < HBr < HI
அமில வலிமை : HF யிலிருந்து HI க்கு அதிகரிக்கிறது.