தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள் - கந்தக டை ஆக்சைடு | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
கந்தக டை ஆக்சைடு
கந்தக டை ஆக்சைடு
தயாரித்தல்
கந்தகத்திலிருந்து தயாரித்தல் கந்தகத்தை காற்றில் எரிப்பதன் மூலம் பெருமளவில் கந்தக டை ஆக்சைடு தயாரிக்கப்படுகிறது. 6 - 8% கந்தகமானது கந்தக ட்ரைஆக்சைடாக (SO3) ஆக்சிஜனேற்றம் அடைகிறது.
S+ O2 → SO2
2S + 3O2 → 2 SO3
சல்பைடுகளிலிருந்து தயாரித்தல் கலீனா (PbS), ஜிங்க்பிளன்ட் (ZnS) போன்ற சல்பைடு தாதுக்களை காற்றில் வறுக்கும் போது கந்தக டைஆக்சைடு வெளியேற்றப்படுகிறது. கந்தக அமிலம் தயாரிப்பதற்கும் மற்ற தொழிற் செயல்முறைகளுக்கும் பெருமளவில் தேவைப்படும் கந்தக டைஆக்சைடு இம்முறையில் தயாரிக்கப்படுகிறது.
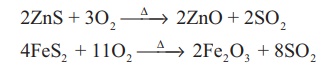
ஆய்வகதயாரிப்பு: உலோகம் அல்லது உலோக சல்பைட்டினை கந்தக அமிலத்துடன்வினைபடுத்தி கந்தக டைஆக்சைடு ஆய்வகத்தில் தயாரிக்கப்படுகிறது.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
SO3-+ 2H+ → H2O + SO2
பண்புகள்
எரிமலை வெடித்தலில் வெளியேறும் வாயுவில் கந்தக டை ஆக்சைடு காணப்படுகிறது. கரி மற்றும் எண்ணெய்களைப் பயன்படுத்தும் ஆற்றல் உற்பத்தி நிலையங்கள் மற்றும் காப்பர் உருக்கு ஆலைகள் பெருமளவில் கந்தக டை ஆக்சைடு வாயுவை வளிமண்டலத்தில் வெளியேற்றுகின்றன. இது நிறமற்ற மூச்சு திணறலை ஏற்படுத்தும் மணமுடைய வாயு. இது அதிக அளவில் நீரில் கரைகிறது. காற்றை விட2.2 மடங்கு கனமானது. கந்தக டைஆக்சைடை 2.5 atm வளி அழுத்தத்தில் 288 K வெப்பநிலையில் திரவமாக்கலாம் (கந்தக டைஆக்சைடின் கொதிநிலை 263K).
வேதிப் பண்புகள்
கந்தக டைஆக்சைடு ஒரு அமில ஆக்சைடு ஆகும். இது நீரில் கரைந்து சல்பியூரஸ் அமிலத்தை தருகிறது.
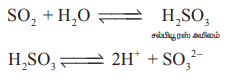
சோடியம் ஹைட்ராக்சைடு மற்றும் சோடியம் கார்பனேட்டுடன் வினை : கந்தக டை ஆக்சைடு, சோடியம் ஹைட்ராக்சைடு மற்றும் சோடியம் கார்பனேட்டுடன் வினைபடும் போது முறையே சோடியம் பைசல்பைட் மற்றும் சோடியம் சல்பைட்டை தருகிறது.
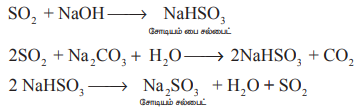
SO2 + NaOH → NaHSO3 (சோடியம் பை சல்பைட்)
2SO2 + Na2CO3 + H2O → 2NaHSO3 + CO2
2NaHSO3 → Na2SO3 + H2O + SO2 (சோடியம் பை சல்பைட்)
ஆக்சிஜனேற்றம் பண்பு கந்தக டை ஆக்சைடு ஹைட்ரஜன் சல்பைடை, கந்தகமாக ஆக்சிஜனேற்றமடையச் செய்கிறது. மேலும் மெக்னீசியத்தை மெக்னீசியம் ஆக்சைடாக மாற்றுகிறது.
2H2S + SO2 → 3S + 2H2O
2Mg + SO2 → 2MgO + S
ஒடுக்கும் பண்பு இது எளிதில் ஆக்சிஜனேற்றம் அடையும் என்பதால் ஒடுக்கும் காரணியாக செயல்படுகிறது. இது குளோரினை ஹைட்ரோகுளோரிக் அமிலமாக ஒடுக்கம் அடையச் செய்கிறது.
SO2+ 2H2O + C12 → H2SO4 + 2HCI
இது பொட்டாசியம் பெர்மாங்கனேட் மற்றும் டைகுரோமேட் ஆகியனவற்றை முறையே Mn'+ மற்றும் Cr3+ ஆக ஒடுக்கமடையச் செய்கிறது.
2KMnO4 + 5SO2 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
K2Cr2O7 + 3SO2 + H2SO4 → K2SO4 + Cr2 (SO4)3 + H2O
ஆக்சிஜனுடன் வினை கந்தக டைஆக்சைடை ஆக்சிஜனுடன் சேர்த்து அதிக வெப்பநிலையில் வெப்பப்படுத்தும் போது கந்தக ட்ரைஆக்சைடு உருவாகிறது. இவ்வினை கந்தக அமிலத்தை தயாரிக்கப் பயன்படும் தொடு முறையில் பயன்படுகிறது.
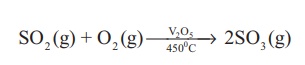
கந்தக டைஆக்சைடின் வெளுக்கும் பண்பு நீரின் முன்னிலையில் நிறமுடைய கம்பளி, பட்டு, ஸ்பாஞ்சுகள் ஆகியனவற்றை கந்தக டைஆக்சைடானது தனது ஒடுக்கும் பண்பினால் நிறமற்றவைகளாக மாற்றுகிறது.
SO2 + 2H2O → H2SO4 + 2(H)
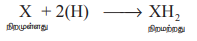
எனினும், வெளுக்கப்பட்ட பொருளை காற்றில் வைத்திருக்கும் போது, வளிமண்டல ஆக்சிஜனால் மீளவும் ஆக்சிஜனேற்றமடைந்து அதன் உண்மையான நிறம் பெறப்படுகிறது. எனவே, கந்தக டை ஆக்சைடின் வெளுக்கும் தன்மையானது ஒரு தற்காலிக பண்பாகும்.
பயன்கள்
1. முடி, பட்டு, கம்பளி போன்றவற்றை வெளுக்கப் பயன்படுகிறது.
விவசயாத்தில் தாவரங்கள் மற்றும் பயிர்களில் காணப்படும் தொற்றுகளை நீக்க பயன்படுத்தலாம்.
கந்தக டைஆக்சைடின் வடிவமைப்பு
கந்தக டைஆக்சைடின் கந்தக அணு sp2 இனகலப்பு அடைந்துள்ளது. S மற்றும் O ஆகியனவற்றிற்கிடையே ஏற்படும் pr- dr மேற்பொருந்துதலால் அவைகளுக்கிடையே ஒரு இரட்டைப் பிணைப்பு உருவாகிறது.
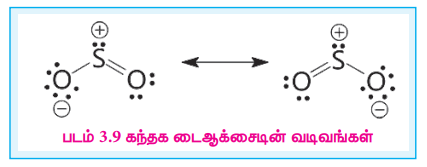
படம் 3.9 கந்தக டைஆக்சைடின் வடிவங்கள்