தயாரித்தல், இயற்பண்புகள், வேதிப் பண்புகள், குளோரினின் பயன்கள் - குளோரின் | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
குளோரின்
குளோரின் அதிக வினைத்திறன் மிக்கது. எனவே இயற்கையில் இது தனித்து கிடைப்பதில்லை. வழக்கமாக இது உலோக குளோரைடுகளாகக் கிடைக்கிறது. மிக முக்கியமான குளோரைடு சோடியம் குளோரைடு ஆகும். இது கடல் நீரில் காணப்படுகிறது.
தயாரித்தல்
மாங்கனீஸ் டை ஆக்சைடு முன்னிலையில் குளோரைடுகளை அடர் கந்தக அமிலத்துடன் வினைபடுத்தி குளோரின் தயாரிக்கப்படுகிறது.
4NaC1 + MnO2 + 4H2SO4 → C12 + MnC12 + 4NaHSO4 + 2H2O
மாங்கனீஸ் டைஆக்சைடு, லெட் டைஆக்சைடு, பொட்டாசியம் பெர்மாங்கனேட் அல்லது டைகுரோமேட் போன்ற பல்வேறு ஆக்சிஜனேற்றிகளை பயன்படுத்தி ஹைட்ரோகுளோரிக் அமிலத்தை ஆக்சிஜனேற்றமடையச் செய்து குளோரினைப் பெறலாம்.
PbO2 + 4HC1 → PbC12 + 2H2O + C12
MnO2 + 4HC1 → MnC12 + 2H2O + C12
2KMnO4 + 16HC1 → 2KC1 +2MnC12 + 8H2O + 5C12
K2Cr2O7 + 14HC1 → 2KC1 + 2CrC13 + 7H2O + 3 C12
சலவைத் தூளை கனிம அமிலங்களுடன் வினைபடுத்தும் போது குளோரின் வெளியேறுகிறது.
CaOC12 + 2HC1 → CaC12 + H2O + C12
CaOC12 + H2SO4 → CaSO4 + H2O + C12
பெருமளவில் குளோரினைத் தயாரித்தல்
சோடியம் குளோரைடை மின்னாற்பகுத்தல் அல்லது HCI ஐக் காற்றைக் கொண்டு ஆக்சிஜனேற்றமடையச் செய்தல் ஆகிய முறைகளில் இதனை பெருமளவில் தயாரிக்கலாம்.
மின்னாற்பகுத்தல் செயல்முறை சோடியம் குளோரைடு (NaC1) கரைசலை மின்னாற்பகுக்கும் போது Na+ மற்றும் C1- அயனிகள் உருவாகுகின்றன. உருவாகும் Na+ அயனிகள் நீரின் OH- அயனிகளோடு சேர்ந்து சோடியம் ஹைட்ராக்சைடை தருகிறது. ஹைட்ரஜன் மற்றும் குளோரின் ஆகிய வாயுக்கள் வெளியேறுகின்றன.
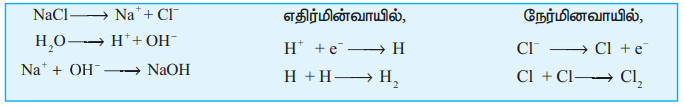
டெக்கான் முறை: பல அடுக்குகளை உடைய கலனின் வழியே காற்று மற்றும் ஹைட்ரோகுளோரிக் அமிலம் ஆகியனவற்றின் கலவை செலுத்தப்படுகிறது. குப்ரஸ் குளோரைடில் நனைக்கப்பட்ட படிகக்கற்களின் அடுக்குகளில் வைக்கப்பட்டுள்ளன. 723K வெப்பநிலையில் அறையைச் சுற்றியுள்ள மூடப்பட்ட பகுதியின் வழியே சூடான வாயுக்கள் செலுத்தப்படுகின்றன.
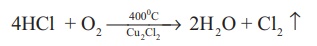
இம்முறையில் உருவான குளோரின் நீர்த்த நிலையில் உள்ளது. இதனை சலவைத் தூள் தயாரிக்கப் பயன்படுத்தலாம்.
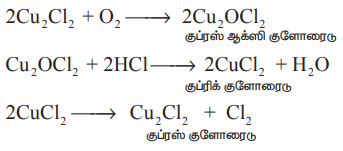
2Cu2C12 + O2 → 2Cu2OC12(குப்ரஸ் ஆக்ஸி குளோரைடு )
Cu2OC12+ 2HC1 → 2CuC12 + H2O ( குப்ரிக் குளோரைடு )
2CuC12 → Cu2C12 + C12 (குப்ரஸ் குளோரைடு )
இயற்பண்புகள்
குளோரின் ஒரு பசுமை கலந்த மஞ்சள் நிற வாயு. எரிச்சலூட்டும் மணமுடையது. மிகச் சிறிதளவு நுகரப்படினும் தலைவலியினை ஏற்படுத்துகிறது. ஆனால், அதிக அளவு நுகரப்படின் மரணம் நிகழலாம். காற்றை விட 2.5 மடங்கு கனமாகிறது. குளோரின் நீரில் கரைகிறது. இதன் கரைசல் குளோரின் நீர் என அழைக்கப்படுகிறது. இது பசுமைக் கலந்த மஞ்நிற குளோரின் டெக்கா ஹைட்ரேட்டாக படிகிறது (C128H2O). இதனை திரவமாகவும் (கொதிநிலை - 34.6° C), மஞ்சள் நிற திண்ம படிகங்களாகவும் (உருகுநிலை-102° C) மாற்றலாம்.
வேதிப் பண்புகள்
உலோகங்கள் மற்றும் அலோகங்களுடன் வினை இது உலோகங்கள் மற்றும் அலோங்களுடன் வினைப்பட்டு அவைகளின் குளோரைடுகளைத் தருகிறது.
2Na + C12 → 2NaC1
2Fe + 3C12 → 2FeC13
2A1+ 3C12 → 2A1C13
Cu + C12 → CuC12
H2 + C12 → 2HC1 ; ∆H = - 44kCa1
2B+ 3C12 → 2BC13
2S + C12 → S2C12
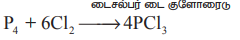
2As + 3C12 → 2AsC13
2As + 3C12 →2SbC13
ஹைட்ரஜன் மீது நாட்டம் : டர்பென்டைனுடன் சேர்த்து எரிக்கும் போது கார்பன் மற்றும் ஹைட்ரோ குளோரிக் அமிலத்தை தருகிறது.
C10H16 + 8C12 →10C + 16HC1
சூரிய ஒளியின் முன்னிலையில் நீருடன் வினைபடும் போது ஆக்சிஜனைத் தருகிறது. நீரில் உள்ள குளோரின் சூரிய ஒளியின் தாக்கத்திற்க்கு உட்படும் போது குளோரினானது ஹைட்ரோகுளோரிக் அமிலமாக மாற்றமடைவதால் அதன் நிறம் மற்றும் மணத்தை இழக்கிறது.
2C12 + 2H2O → O2 + 4HCI
குளோரின் அம்மோனியாவுடன் வினைப்பட்டு அம்மோனியம் குளோரைடு மற்றும் இதர விளைப்பொருட்களை பின்வருமாறு தருகிறது. அதிகளவு அம்மோனியாவுடன்,
2NH3 + 3C12 → N2 + 6HC1
6HC1 +6NH3 → +6NH4C1
ஒட்டு மொத்த வினை
8NH3 + 3C12 → N2 + 6NH4C1
அதிக அளவு குளோரினுடன்
NH3 + 3C12 → NC13 + 3HC1
3HC1 + 3NH3 → 3NH4C1
ஒட்டு மொத்த வினை
4NH3 + 3C12 → NC13 + 3NH4C1
குளோரின், ஹைட்ரஜன் சல்பைடை சல்பராக ஆக்சிஜனேற்றமடையச் செய்கிறது. புரோமைடு மற்றும் அயோடைடு ஆகியனவற்றினை முறையே புரோமின் மற்றும் அயோடினாகவும் ஆக்சிஜனேற்றமடையச் செய்கிறது. எனினும் புளூரைடுகளை இது ஆக்சிஜனேற்றமடையச் செய்வதில்லை.
H2S + C12 → 2HC1 + S
C12 + 2KBr → 2KC1 + Br2
C12+ 2KI → 2KC1 +I2
காரங்களுடன் வினை குளோரின் குளிர்ந்த நீர்த்தக் காரத்துடன் வினைபட்டு குளோரைடுகளைகள் மற்றும் ஹைபோ குளோரைட்டுகளைத் தருகிறது. சூடான அடர் காரங்களுடன் வினைபட்டு குளோரைடுகள் மற்றும் குளோரேட்டுகள் உருவாகின்றன.
C12 + H2O → HC1 + HOC1
HC1 + NaOH → NaC1 + H2O
HOC1 + NaOH → NaOC1 + H2O
ஒட்டு மொத்த வினை
C12 + 2NaOH → NaOC1 + NaC1 + H2O
(C12 + H2O → HC1 + HOC1) x 3
(HC1 + NaOH → NaC1 + H2O) x 3
(HOCI + NaOH → NaOC1 + H2O) x 3
3NaOC1 → NaClO3 + 2NaC1
ஒட்டு மொத்த வினை
3C12 + 6NaOH → NaC1O3 + 5NaC1 + 3H2O
ஆக்சிஜனேற்றம் மற்றும் வெளுக்கும் பண்பு: பிறவிநிலை ஆக்சிஜன் காரணமாக, குளோரின் ஒரு வலிமைமிக்க ஆக்சிஜனேற்றி மற்றும் வெளுக்கும் காரணியாகும்.
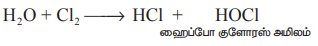
HOC1 → HCl + (O)
நிறமுள்ள பொருள் + பிறவிநிலை ஆக்சிஜன் → நிறமற்ற விளைப்பொருள்
குளோரினின் வெளுக்கும் பண்பு நிலையானது. இது பெர்ரஸ் உப்புகளை பெரிக் உப்புகளாகவும் சல்பைட்டுகளை சல்பேட்டுகளாவும் மேலும் ஹைட்ரஜன் சல்பைடை சல்பராகவும் ஆக்சிஜனேற்றமடையச் செய்கிறது.
2FeC12 + C12 → 2FeC13
C12 + H2O → HC1 + HOC1
2FeSO4 + H2SO4 + HOC1 → Fe2 (SO4)3 + HC1 + H2O
ஒட்டு மொத்த வினை
2FeSO4 + H2SO4 + C12 → Fe2 (SO4)3 + 2HC1
C12 + H2O → HC1 + HOC1
Na2SO3 + HOC1 → Na2SO3+ HC1
ஒட்டு மொத்த வினை
Na2SO3 + H2O + C12 → Na2SO4+ 2HC1
C12 + H2S → 2HC1 + S
சலவைத் தூளைத் தயாரித்தல் குளோரின் வாயுவை உலர்ந்த கால்சியம் ஹைட்ராக்சைடு கரைசலின் வழியாக செலுத்தும் போது சலவைத் தூள் உருவாகிறது.
Ca(OH)2 + C12 → CaOC12 + H2O
இடப்பெயர்ச்சி ஆக்சிஜனேற்ற ஒடுக்க வினைகள் குளோரினானது புரோமைடுகளிலிருந்து புரோமினையும் அயோடைடு உப்புகளிலிருந்து அயோடினையும் இடப்பெயர்ச்சி செய்கிறது.
C12 + 2KBr → 2KC1 + Br2
C12+ 2KI → 2KC1 +I2
சேர்க்கை சேர்மங்கள் உருவாதல் குளோரினாது கந்தக டைஆக்சைடு, கார்பன் மோனாக்சைடு மற்றும் எத்திலீன் ஆகியனவற்றுடன் சேர்க்கை விளைப்பொருளைத் தருகிறது. ஆல்கேன்கள் மற்றும் அரீன்களுடன் பதிலீட்டு விளைப்பொருளைத் தருகிறது.
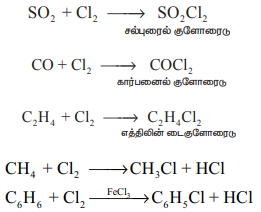
SO2 + C12 → SO2C12,(சல்புரைல் குளோரைடு)
CO + C12 → COC12 (கார்பனைல் குளோரைடு)
C2H4 + C12 → C2H4C12 ( எத்திலின் டைகுளோரைடு)
CH4 + C12 → CH3C1 HC1
C6H6 + C12 FeC13 → C6H5C1 + HCI
குளோரினின் பயன்கள்
1. குடிநீரைத் தூய்மையாக்கல்
2. பருத்தி துணிகள், காகிதம் மற்றும் ரேயான் ஆகியனவற்றை வெளுக்க
3. தங்கம் மற்றும் பிளாட்டினம் ஆகியனவற்றின் பிரித்தெடுத்தல் போன்றவற்றில் பயன்படுகிறது