தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள், சோதனை - கந்தக அமிலம் | 12th Chemistry : UNIT 3 : p-Block Elements-II
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 3 : P-தொகுதி தனிமங்கள் -II
கந்தக அமிலம்
கந்தக அமிலம் (Sulpuric acid H2SO4)
தயாரித்தல்
காரீய சிற்றறை முறையில் கந்தக அமிலம் பெருமளவில் தயாரிக்கப்படுகிறது. தொடு முறை, அடுக்கு முறை ஆகியனவற்றின் மூலமும் கந்தக அமிலத்தை தயாரிக்கலாம். தொடு முறையில் கந்தக அமிலம் தயாரிக்கும் முறை இங்கு விளக்கப்பட்டுள்ளது. இதில் பின்வரும் படி நிலைகள் உள்ளன.
(i) தொடக்கத்தில், கந்தகம் அல்லது இரும்பு பைரைட்டுகளை காற்றில் எரித்து கந்தக டைஆக்சைடு பெறப்படுகிறது.
S +O2 → SO2
4FeS2+ 11O2 → 2Fe2O3 + 8SO2
(ii) உருவான கந்தக டைஆக்சைடானது V2O5 அல்லது பிளாட்டினம் ஏற்றப்பட்ட ஆஸ்பெஸ்டாஸ் ஆகியவற்றின் முன்னிலை கந்தக ட்ரைஆக்சைடாக காற்றினால் ஆக்சிஜனேற்றம் அடைகிறது.
(iii) கந்தக ட்ரைஆக்சைடானது அடர் கந்தக அமிலத்தில் உறிஞ்சப்பட்டு ஓலியத்தைத் (H2S2O7) தருகிறது. இதனுடன் நீரைச் சேர்த்து கந்தக அமிலமாக மாற்றப்படுகிறது.
SO3 + H2SO4 → H2S2O7 →H2O→ 2H2SO4
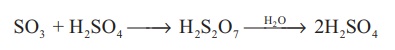
அதிகவிளைப்பொருளைப்பெற 2barஅழுத்தம்மற்றும 720K வெப்ப நிலையில் பாராமரிக்கப்படுகிறது. இம்முறையில் தயாரிக்கப்படும் கந்தக அமிலம் 96% தூய்மையானது.
இயற்பண்புகள்
தூய கந்தக அமிலம் நிறமற்றது. பாகுநிலையுடைய திரவம் (298 K அடர்த்தி 1.84 g/mL 298 K) ஹைட்ரஜன் பிணைப்பின் காரணமாக மூலக்கூறுகளுக்கிடையே இணைவுத் தன்மை காணப்படுகிறது.
283.4 K வெப்பநிலையில் இந்த அமிலம் உறைகிறது. மேலும் 590K வெப்பநிலையில் கொதிக்கிறது. இது நீரில் அதிகம் கரைகிறது. மேலும் நீரின் மீது அதிக நாட்டத்தினைப் பெற்றுள்ளது. எனவே இதனை நீர் நீக்கும் விளைப்பொருளாகப் பயன்படுத்தலாம் நீரில் கரைக்கும் போது மோனோ (H2SO4 H2O) மற்றும் டைஹைட்ரேட்டுகளை (H2SO4 2H2O) தருகின்றது. இந்த வினையானது ஒரு வெப்ப உமிழ் வினையாகும். கரிமச் சேர்மங்களான ஆக்சாலிக் அமிலம், ஃபார்மிக் அமிலம் போன்றவற்றை எடுத்துக்காட்டாக கொண்டு இதன் ஒடுக்கும் தன்மையினை அறிந்துக்கொள்ளலாம்.
C12H22O11 + H2SO4 → 12C + H2SO4 11H2O
HCOOH + H2SO4 → CO + H2SO4 H2O
(COOH)2 + H2SO4 → CO + CO2 + H2SO4 H2O
வேதிப் பண்புகள்
கந்தக அமிலம் அதிக வினைதிறன் உடையது. இது வலிமைமிக்க அமிலம் மற்றும் ஆக்சிஜனேற்றியாக செயல்படுகிறது.
சிதைவடைதல் : கந்தக அமிலம் நிலைப்புத்தன்மை உடையது. எனினும் உயர் வெப்பநிலைகளில் சல்பர் ட்ரை ஆக்சைடாக சிதைவடைகிறது.
H2SO4 → H2O + SO3
அமிலத் தன்மை: இது இரு காரத்துவ அமிலமாகும். எனவே காரத்துடன் சல்பேட்கள் மற்றும் பைசல்பேட்கள் ஆகிய இருவகை உப்புக்களை உருவாக்குகிறது.
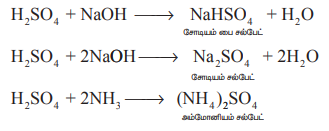
H2SO4 + NaOH → NaHSO4 + H2O
சோடியம் பை சல்பேட்
H2SO4 + 2NaOH → Na2SO4 + 2H2O
சோடியம் சல்பேட்
H2SO4 + 2NH3 → (NH4) 2 SO4
அம்மோனியம் சல்பேட்
கந்தக அமிலமானது பின்வருமாறு வினை நிகழ்விட ஆக்சிஜன் வாயுவை தருவதால் இது ஆக்சிஜனேற்றியாகும்.
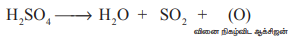
H2SO4 → H2O + SO2 + (O) (வினை நிகழ்விட ஆக்சிஜன்)
கந்தக அமிலமானது கார்பன், சல்பர் மற்றும் பாஸ்பரஸ் போன்ற தனிமங்களை ஆக்சிஜனேற்றமடையச் செய்கிறது. மேலும் இது புரோமைடு மற்றும் அயோடைடுகளை முறையே புரோமினாகவும், அயோடினாகவும் ஆக்சிஜனேற்றமடையச் செய்கிறது.
C + H2SO4 → 2SO2 + 2H2O + CO2
S + H2SO4 → 3SO2 + 2H2O
P4 + 10H2SO4 → 4H3PO4 + 10SO2 + 4H2O
H2S + H2SO4 → SO2 + 2H2O + S
H2SO4 + 2HI → SO2 + 2H2O + I2
H2SO4 + 2HBr → SO2 + 2H2O + Br2
உலோகங்களுடன் வினை கந்தக அமிலமானது உலோகங்களுடன் வினைபடும் போது வினை நிகழ் நிபந்தனைகளைப் பொருத்து வெவ்வேறு விளைப்பொருளை தருகின்றன.
நீர்த்த கந்தக அமிலமானது வெள்ளீயம் (Sn) , அலுமினியம், துத்தநாகம் போன்ற உலோகங்களுடன் வினைபட்டு அவைகளின் சல்பேட்டைத் தருகிறது.
Zn + H2SO4 → ZnSO4 + H2 ↑
2A1 + 3H2SO4 → A12(SO4)3 + 3H2 ↑
சூடான அடர் கந்தக அமிலம் தாமிரம் மற்றும் காரீயம் ஆகிய தனிமங்களுடன் வினைபட்டு அவைகளின் சல்பேட்டுக்களை தருகிறது.
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2 ↑
Pb + 2H2SO4 → PbSO4 + 2H2O + SO2 ↑
கந்தக அமிலனமானது, உயரிய உலோங்களான தங்கம், வெள்ளி மற்றும் பிளாட்டினம் ஆகியனவற்றுடன் வினைபுரிவதில்லை .
உப்புகளுடன் வினை வெவ்வேறு உலோக உப்புகளுடன் இது வினைபட்டு உலோக சல்பேட்டுகள் மற்றும் பைசல்பேட்டுகளைத் தருகின்றது.
KCI+ H2SO4 → KHSO4 + HCI
KNO3 + H2SO4 → KHSO4 + HNO3
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
2NaBr + 3H2SO4 → 2NaHSO4 + 2H2O + Br2 + SO2
கரிமச் சேர்மங்களுடன் பினை இது பென்சீன் போன்ற கரிமச் சேர்மங்களுடன் வினைபட்டு, சல்போனிக் அமிலங்களைத் தருகிறது.
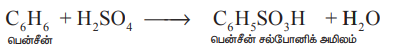
C6H6 + H2SO4 → C6H5SO3H + H2O
பென்சீன் பென்சீன் சல்போனிக் அமிலம்
கந்தக அமிலத்தின் பயன்கள்
1. அமோனியம் சல்பேட் மற்றும் சூப்பர் பாஸ்பேட் போன்ற உரங்களை பெருமளவில் தயாரிக்கும் தொழிற்சாலைகளில் கந்தக அமிலம் பயன்படுகிறது. மேலும் ஹைட்ரோகுளோரிக், நைட்ரிக் அமிலம் போன்ற வேதிப் பொருட்கள் தயாரிப்பிலும் பயன்படுகிறது.
2. இது உலர்த்தும் காரணியாக பயன்படுகிறது. மேலும், நிறமி பொருட்கள், வெடிப் பொருட்கள் போன்ற தயாரிப்பில் பயன்படுகிறது.
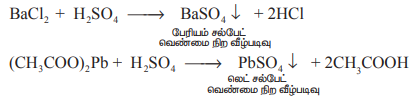
சல்பேட்கள் / கந்தக அமிலத்திற்கான சோதனை
கந்தக அமிலத்தின் நீர்த்த கரைசல் / சல்பேட்டுகளின் நீர் கரைசல் ஆகியன பேரியம் குளோரைடு கரைசலுடன் சேர்ந்து வெண்மை நிற பேரியம் சல்பேட் வீழ்படிவைத்தருகிறது. இதனைலெட் அசிட்டேட் கரைசலைக் கொண்டும் கண்டறியலாம். இங்கு வெண்மை நிற லெட் சல்பேட் வீழ்படிவாகிறது.
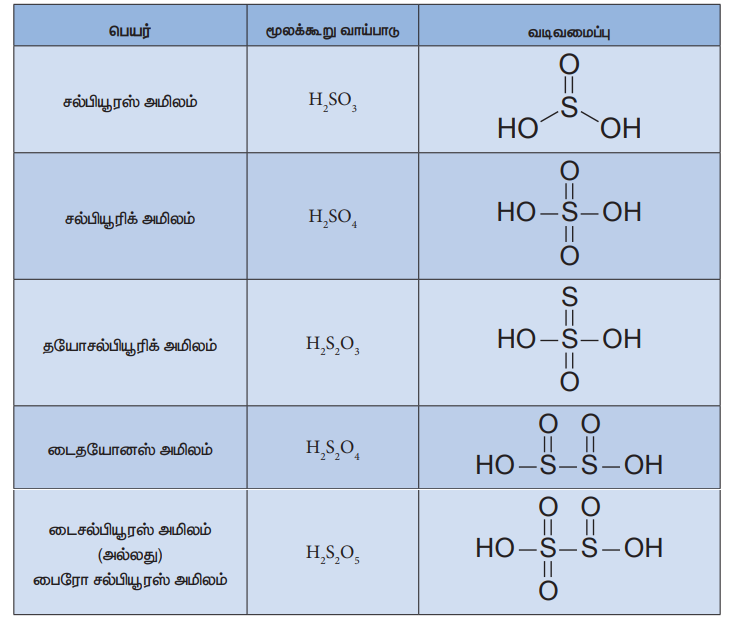
கந்தகத்தின் ஆக்சோ அமிலங்களின் வடிவமைப்புகள்
கந்தகமானது பல்வேறு ஆக்சோ அமிலங்களை உருவாக்குகிறது. அவற்றுள் மிக முக்கியமானது கந்தக அமிலமாகும். சல்பியூரஸ் மற்றும் டைதயோனிக் அமிலங்கள் அவைகளின் உப்பு நிலையில் மட்டுமே காணப்படுகிறது. ஏனெனில் அவைகளின் தனித்த நிலையிலுள்ள அமிலங்கள் நிலைப்புத் தன்மையற்றை கந்தகத்தின் பல்வேறு ஆக்சோ அமிலங்களின் வடிவமைப்புகள் பின்வருமாறு.